酪氨酸家族激酶在大鼠脊髓背角LTP中的作用及其机制
2011-11-20黄阳亮许继德
钟 祎, 黄阳亮, 许继德
(1广州医学院生理教研室,广东 广州 510182 ;2中山大学附属第一医院脊柱外科,广东 广州 510700)
酪氨酸家族激酶在大鼠脊髓背角LTP中的作用及其机制
钟 祎1△, 黄阳亮2, 许继德1
(1广州医学院生理教研室,广东 广州 510182 ;2中山大学附属第一医院脊柱外科,广东 广州 510700)
目的探讨酪氨酸家族激酶(SFKs)在大鼠脊髓背角C纤维诱发电位的长时程增强(LTP)中的作用及其机制。方法用在体电生理方法检测SFKs抑制剂对高频刺激坐骨神经诱导的脊髓背角LTP的影响;用Western blotting方法检测高频刺激诱导脊髓LTP的不同时点大鼠脊髓背角磷酸化SFKs的表达情况;用免疫荧光双染方法检测高频刺激诱导脊髓LTP后大鼠脊髓背角磷酸化SFKs表达的细胞学定位。结果SFKs的抑制剂(PP2或SU6656)可以完全阻断LTP的诱导,甚至将LTP逆转为长时程抑制(LTD);高频电刺激大鼠坐骨神经诱导脊髓LTP后15 min开始,刺激同侧的脊髓背角中磷酸化SFKs表达明显增加,并且这些高表达的磷酸化SFKs仅仅存在于脊髓小胶质细胞中。结论在脊髓背角,小胶质细胞中的SFKs 是诱导LTP的必要条件,抑制SFKs及其下游分子可能有助于治疗病理性疼痛。
Src家族激酶类; 长时程增强; 疼痛; 脊髓背角
C纤维诱发电位的长时程增强(long-term potentiation, LTP)是指传入C纤维与脊髓背角神经元之间突触传递效率的持续增强,以前的研究发现电刺激传入C纤维以及末梢神经损伤可以诱导脊髓背角LTP[1, 2]。由于传入C纤维传递痛觉信息并与脊髓浅层神经元形成突触联系,而且诱导LTP的刺激可以在人身上引起长时间的痛觉过敏和痛觉超敏[3],脊髓LTP被认为是一种痛觉记忆,是目前研究病理性疼痛的突触模型[4,5]。酪氨酸家族激酶(Src-family kinases, SFKs)广泛表达于哺乳动物的中枢神经系统,参与了神经系统的增生和分化[6,7],最近的研究表明末梢神经损伤激活脊髓中的SFKs, 并且活化的SFKs仅仅存在于脊髓小胶质细胞中;鞘内给予SFKs的抑制剂PP2可以阻断神经损伤引起的痛觉过敏的产生,这说明SFKs在病理性疼痛的产生中起重要作用。本研究观察SFKs抑制剂对脊髓LTP诱导的影响,以及脊髓LTP诱导后脊髓背角SFKs磷酸化水平的变化。
材 料 和 方 法
1材料
1.1动物 实验采用Sprague-Dawley雄性大鼠(250-280 g), 由广州医学院实验动物中心提供。动物分笼饲养,自由饮食,室温保持在(24±1) ℃, 湿度50%-60%。
1.2主要试剂 PP2、SU6656 和PP3 (Calbiochem)首先溶解在二甲基亚砜(dimethyl sulphoxide, DMSO)中配成50 mmol/L的储存液,分装储存在-80 ℃冰箱中,使用前用生理盐水稀释成所需浓度。工作液中DMSO的浓度低于0.5% (V/V)。多克隆兔抗大鼠 p-SFKs抗体、多克隆兔抗大鼠 SFKs 抗体和多克隆兔抗大鼠 β-actin 抗体均购自Cell Signalling Technology; 抗-神经元特异性核蛋白抗体(neuronal-specific nuclear protein, NeurN)、抗-胶质细胞纤维酸性蛋白抗体(glial fibrillary acidic protein, GFAP)和抗-小胶质细胞抗体OX-42均购自Chemicon。辣根过氧化酶(HRP) 标记的山羊抗兔IgG购自Santa Cruz; FITC 标记的Ⅱ抗和CY3 标记的Ⅱ抗购自Jackson Immunolab。
2方法
2.1在体电生理记录 乌拉坦(1.5 g/kg)腹腔注射麻醉,行气管插管使大鼠自然呼吸;一侧颈动脉插管持续监测大鼠血压(波动于80 mmHg-120 mmHg);在腰4-腰6(L4-L6)间行椎板切除术,暴露腰膨大。游离左侧坐骨神经,使用双极氯化银电极刺激坐骨神经。除用于记录的脊髓节段外,暴露的神经组织均用石蜡油覆盖。用热反馈式电热毯使大鼠肛温维持在37.0 ℃-37.5 ℃。脊髓背角C纤维诱发电位的记录方法如文献所述[8,9]。简单地说, 通过氯化银电极电刺激游离的左侧坐骨神经以诱发脊髓场电位,钨丝微电极(电阻0.5-1 MΩ)进行细胞外记录,用电控的微量推进器(Narishige Scientific Instrument Laboratory)将电极深度控制在脊髓表面下100-500 μm。用数/模转换器(ADC-42,PICO)以10 kHz的速度处理和储存数据。以C纤维诱发电位的幅度作为参数。单方波(10-20 V,0.5 ms,1 min)刺激分离的左侧坐骨神经诱发脊髓背角场电位,高频刺激(40 V,0.5 ms,100 Hz,持续1 s,间隔10 s,4次)诱导C纤维诱发电位LTP。坐骨神经的刺激点到脊髓背角的记录点约为11 cm。
2.2Western blotting 分离刺激同侧腰4-腰5(L4-L5)脊髓背角组织,在培养皿中去除软脊膜和残留血块,将组织迅速放入液氮罐中(10 s), 随后将组织按重量加入Tris 裂解缓冲液[超纯水 2.8 mL, 1.0 mol/L Tris (pH 6.8) 1 mL, 10% SDS 6 mL, 2% β-巯基乙醇 0.2 mL; 10 mL配方] 中,加入蛋白酶抑制剂混合物cocktail (1∶1 000; Roche Molecular Biochemicals) 和磷酸酶抑制剂 (1∶1 000), 冰上匀浆,超声破碎, 低温离心。 取上层含组织蛋白的液体分装保存在-80 ℃。用Micro-BAC法测定蛋白浓度。取等量蛋白样品(50 μg)加入1/10体积的上样缓冲液,混匀沸水浴10 min变性。随后加入SDS-PAGE胶孔中,电泳分离蛋白,电转至PVDF膜上。常温下5%封闭液封闭PVDF膜2 min,Ⅰ抗孵育,4 ℃摇床过夜。洗脱3次,每次15 min,常温下Ⅱ抗孵育2 h,洗脱3次,每次15 min,ECL显色,曝光。
2.3免疫组织化学 取出诱导LTP后不同时段或不同药物处理后的大鼠,首先经主动脉快速灌注4 ℃肝素化的生理盐水300 mL,然后用4 %多聚甲醛300 mL灌注30 min,解剖动物取出腰膨大脊髓后,再放入4 %的多聚甲醛溶液中后固定3 h,随后转入30 %蔗糖中脱水2 d。标本经蔗糖脱水后进行冰冻切片(Leica CM1900)并收集于含有0.01 mol/L PBS 的24 孔板内,4 ℃短暂保存。脊髓为横切片,厚度为25 μm。收集脊髓冰冻切片立即用0.01 mol/L PBS 洗3 次,每次5 min,然后室温下用封闭液作用于切片,以封闭非特异性结合位点。1 h后吸去封闭液并加入兔抗-大鼠 p-SFKs 抗体(1∶500),4 ℃摇床下作用48 h 后,吸去Ⅰ抗,用0.01 mol/L PBS 洗3 次,加入标记CY3 的驴抗兔Ⅱ抗(1∶200),避光室温下作用1 h,再用0.01 mol/L PBS 洗3 次,随机挑选切片贴于载玻片上,立即于荧光显微镜(Olympus IX71)下观察并拍照。对于进行免疫荧光双染的脊髓切片,在封闭液处理切片后,立即加入抗-p-SFKs(1∶500)与脊髓细胞标志物(抗-NeuN、抗-GFAP或抗- OX-42)抗体的混合物,常温作用2 h。切片经以上抗体双标记后,用0.01 mol/L PBS 洗3 次,然后加入FITC 和CY3标记的2种Ⅱ抗(1∶200),避光室温下反应1 h,再用0.01 mol/L PBS 洗片,随机挑选切片贴片后,立即于荧光显微镜下观察并拍照。
3统计学处理
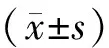
结 果
1SFKs的抑制剂对脊髓LTP诱导的影响
PP2(100 μmol/L, 200 μL)不影响C纤维基础电位,但是可以将高频刺激诱导的LTP逆转为长时程抑制(long-term depression, LTD),即脊髓LTP不能被诱导。而用PP2的无活性结构类似物PP3作用后,高频刺激(high-frequency stimulation, HFS)坐骨神经依然可以诱导出脊髓LTP,见图1A。SFKs的另一种广谱抑制剂SU6656也得到相同的结果,见图1B。以上结果表示SFKs的激活是脊髓LTP诱导的必要条件。
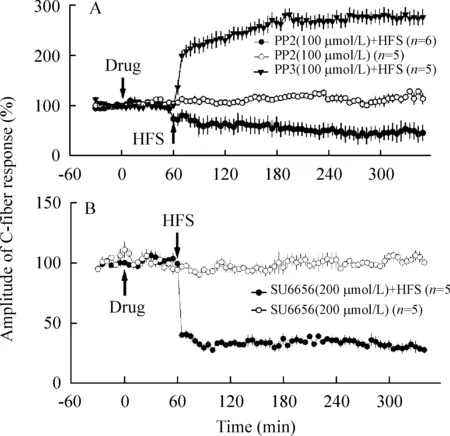
Figure 1. High-frequency stimulation(HFS) induce LTD in animals pretreated with SFKs inhibitor PP2 or SU6656. A: PP2 (100 μmol/L, filled circle) enabled HFS to induce LTD,but its inactive form PP3 (100 μmol/L, filled triangle) enabled HFS to induce LTP. The same dose of PP2 did not affect baseline of C-fiber responses (open circle). B: pretreatment with SU6656 (200 μmol/L), which did not affect basal synaptic transmission (open circle), also reversed the effect of HFS (closed circle).
2高频刺激诱导脊髓LTP后,脊髓背角SFKs磷酸化表达明显上升
结果如图2所示,与对照组相比,高频刺激诱导脊髓LTP后15 min,脊髓背角p-SFKs表达大量增加 (Plt;0.05)。一直持续到诱导LTP后60 min恢复到对照组水平(Pgt;0.05).而SFKs蛋白总量保持不变。

Figure 2. The Src-family kinases were activated after LTP induction in spinal doral horn. A: the bands showed the phosphorylated and total SFKs and β-actin from protein samples of ipsilateral spinal dorsal horn (L4-L5) 15, 30, 60 and 180 min after LTP induced by HFS. In control animals C-fiber responses were recorded but no HFS was conducted. B: the bar chart showed the p-SFKs levels that were normalized by total SFKs levels and expressed as percentages of their controls±s.n=3**Plt;0.01 vs control.
3高频刺激诱导脊髓LTP后,脊髓背角SFKs磷酸化表达仅存在于小胶质细胞中
结果如图3所示,脊髓背角p-SFKs和小胶质细胞的标记物OX-42 (图3E)共存而不是和神经元的标记物NeuN (图3D)或星形胶质细胞的标记物GFAP (图3F) 共存。这表明高频刺激诱导脊髓LTP后,脊髓背角SFKs的激活仅仅存在于小胶质细胞中,这与已经报道的神经损伤引起脊髓小胶质细胞中SFKs的大量激活是一致的。为验证抗体特异性,我们取部分切片做了免疫荧光单染,结果LTP组(图3C)脊髓背角p-SFKs的表达明显高于对照组(图3B) p-SFKs的表达。

Figure 3. The activated Src-family kinases were exclusively expressed in spinal microglia after LTP induction. A: the photograph showed no signal was detected in negative control experiments, in which only secondary antibody but no primary antibody was added (n=2). B-C: the photographs showed the expression of p-SFKs in spinal dorsal horn 15 min after HFS(C) and that in control animals(B). D-F: the photographs showed that p-SFKs (E, red) were co-localized with OX-42 (microglia marker, E, green), but without NeuN (neuron marker, D, green) or GFAP (astrocytes marker, F, green). The yellow cells indicated double-labeled cells. Scale bar = 100 μm (A-F).
讨 论
本实验结果显示,抑制SFKs可以完全阻断脊髓LTP的诱导,甚至将高频刺激诱导的LTP逆转为LTD。脊髓LTP诱导后15 min开始,刺激同侧脊髓背角中SFKs的磷酸化表达明显增加,维持到LTP诱导后60 min恢复到对照水平,这些大量表达的磷酸化SFKs仅仅存在于脊髓小胶质细胞中。因此SFKs的激活是诱导脊髓背角C纤维诱发电位LTP的必要条件。
大量文献报道,SFKs 在中枢神经系统的发育过程中是各种信号途径的交会点,在学习和记忆等生理可塑性过程以及癫痫和神经退行性变等病理可塑性过程中起关键作用[10,11]。在海马,SFKs表达在突触后致密区(post synaptic density, PSD),在海马LTP诱导后1-5 min就大量激活[12],抑制了SFKs可以阻断LTP的诱导,但不能逆转为LTD。而灌注Src可以增强AMPA(alpha-amino-3-hydroxy-5-methl-4-isoxalzole propionic acid)受体介导的电流,后者是依赖于钙离子流入NMDA(N-methyl-D-aspartate)受体通道的。在脊髓背角,最近有研究表明腰5 脊神经损伤后1d,脊髓背角SFKs 磷酸化水平显著升高,持续至少14 d。SFKs 抑制剂PP2 抑制神经损伤引起的机械痛敏。与海马不同,腰5脊神经损伤引起的SFKs 激活仅发生在脊髓小胶质细胞,而在脊髓神经元、星形胶质细胞及腰4、腰5 背根神经节均未检出SFKs 的磷酸化[13]。
我们第二部分的结果表明,与正常大鼠和进行电生理记录而未给高频刺激的大鼠相比,高频刺激诱导脊髓LTP后非常短的时间内(15 min)脊髓背角磷酸化的SFKs表达明显增加(300 %),可以维持到LTP诱导后60 min。而免疫荧光双染结果又证明这种大量表达的p-SFKs仅仅存在于小胶质细胞而非神经元或者星形胶质细胞中。这些结果和已经报道的神经损伤后脊髓背角磷酸化SFKs表达增加,并且只存在于小胶质细胞中的结果是一致的。不同的是外周神经机械损伤后脊髓中p-SFKs表达的时间可以持续到术后14 d, 而我们Western blotting的结果发现高频刺激坐骨神经诱导LTP后15 min时脊髓背角p-SFKs明显增加,到60 min时恢复到对照水平,这可能是机械切断外周神经和高频刺激坐骨神经这两种刺激方式不同造成的。根据现有文献报道,小胶质细胞的激活在病理性疼痛的产生中起重要作用,而病理性疼痛的维持需要星形胶质细胞的激活。而我们Western blotting的结果也证明高频刺激诱导脊髓LTP后15 min-60 min,脊髓背角SFKs大量激活,说明SFKs仅仅在LTP的早期诱导阶段起作用,其维持阶段需要激活另外的信号通路最终活化NF-kappa B导致新的蛋白质合成。LTP诱导阶段需要激活小胶质细胞中的SFKs, LTP诱导后的维持阶段可能需要星形胶质细胞和突触后神经元的共同参与。
综合上述结果并结合已有研究,我们认为脊髓LTP的诱导和维持是一个复杂的过程,需要多种因素参与;脊髓小胶质细胞中SFKs的激活在脊髓LTP的诱导中起着不可缺少的作用;晚期LTP的维持则需要新蛋白质的合成;以小胶质细胞及其中SFKs为靶点的药物将有助于治疗病理性疼痛。
[1] Liu XG, Sandkühler J. Long-term potentiation of C-fiber-evoked potentials in the rat spinal dorsal horn is prevented by spinalN-methyl-D-aspartic acid receptor blockage [J]. Neurosci Lett, 1995, 191(1-2): 43-46.
[2] Zhang HM, Zhou LJ, Hu XD, et al. Acute nerve injury induces long-term potentiation of C-fiber evoked field potentials in spinal dorsal horn of intact rat [J]. Acta Physiologica Sinica, 2004, 56(5): 591-596.
[3] Klein T, Magerl W, Hopf HC, et al. Perceptual correlates of nociceptive long-term potentiation and long-term depression in humans [J]. J Neurosci, 2004, 24(4): 964-971.
[4] Ji RR, Kohno T, Moore KA, et al. Central sensitization and LTP: do pain and memory share similar mechanisms? [J]. Trends Neurosci, 2003, 26(12): 696-705.
[5] Willis WD. Long-term potentiation in spinothalamic neurons [J]. Brain Res Rev, 2002, 40(1-3): 202-214.
[6] Kuo WL, Chung KC, Rosner MR. Differentiation of central nervous system neuronal cell by fibroblast-derived growth factor requires at least two signaling pathways: role of Ras and Src [J]. Mol Cell Biol, 1997, 17(8): 4633-4643.
[7] Hoffman-Kim D, Kerner JA, Chen A, et al. pp60c-srcis a negative regulator of laminin-1 -mediated neurite outgrowth in chick sensory neurons [J]. Mol Cell Neurosci, 2002, 21(1): 81-93.
[8] Liu XG, Sandk ( (hler J. Characterization of long-term potentiation of C-fiber-evoked potentials in spinal dorsal horn of adult rat: essential role of NK1 and NK2 receptors [J]. J Neurophysiol, 1997, 78(4): 1973-1982.
[9] Liu XG, Sandk ühler J. Activation of spinalN-methyl-D-aspartate or neurokinin receptors induces long-term potentiation of spinal C-fibre-evoked potentials in spinalized rats [J]. Neuroscience, 1998, 86(4): 1209-1216.
[10]Purcell AL, Carew TJ. Tyrosine kinases, synaptic plasticity and memory: insights from vertebrates and invertebrates [J]. Trends Neurosci, 2003, 26(11): 625-630.
[11]Kalia LV, Gingrich JR, Salter MW. Src in synaptic transmission and plasticity [J]. Oncogene, 2004, 23(48): 8007-8016.
[12]Soderling TR, Derkach VA. Postsynaptic protein phosphorylation and LTP [J]. Trends Neurosci, 2000, 23(2): 75-80.
[13]Katsura H, Obata K, Mizushima T, et al. Activation of Src-family kinases in spinal microglia contributes to mechanical hypersensitivity after nerve injury [J]. J Neurosci, 2006, 26(34): 8680-8690.
TheroleofSrc-familykinasesinlong-termpotentiationinratspinaldorsalhorn
ZHONG Yi1, HUANG Yang-liang2, XU Ji-de1
(1DepartmentofPhysiology,GuangzhouMedicalCollege,Guangzhou510182,China;2DepartmentofSpineSurgery,TheFirstAffiliatedHospital,SunYet-senUniversity,Guangzhou510700,China.E-mail:victoria0720@126.com)
AIM: To investigate the role of Src-family kinases (SFKs) in long-term potentiation (LTP) of C-fiber-evoked potentials in rat spinal dorsal horn and the underlying mechanism.METHODSThe effect of SFKs inhibitors on spinal LTP induced by high-frequency stimulation of sciatic nerve was determined by electrophysiological method. The levels of phosphorylated SFKs (p-SFKs) in spinal dorsal horn were measured by Western blotting at different time points after LTP induction. The cell types that expressed p-SFKs following LTP induction were determined by double-labeled immunofluorescence staining.RESULTSElectrophysiological data revealed that pretreatment with SFKs inhibitors (PP2 or SU6656) enabled high-frequency stimulation to induce long-term depression (LTD) rather than LTP in spinal dorsal horn. Western blotting analysis showed that the level of p-SFKs in ipsilateral spinal dorsal horn increased at 15 min after LTP induction. Double-labeled immunofluorescence staining demonstrated that p-SFKs were highly restricted to spinal microglia.CONCLUSIONSFKs in microglia play a critical role in the induction of LTP in spinal dorsal horn. Inhibition of SFKs and the downstream molecules may be helpful for curing neuropathic pain.
Src-family kinases; Long-term potentiation; Pain; Spinal dorsal horn
1000-4718(2011)04-0727-05
R338
A
10.3969/j.issn.1000-4718.2011.04.020
2010-11-05
2011-02-25
△通讯作者 Tel: 020-81340199; E-mail: victoria0720@126.com
