猪戊型肝炎病毒swCH189株衣壳蛋白基因CP239片段原核表达条件的优化
2011-11-18郝宝成梁剑平兰喜刑小勇项海涛温峰琴胡永浩柳纪省
郝宝成 梁剑平 兰喜 刑小勇 项海涛 温峰琴 胡永浩 柳纪省

摘要:为了提高猪戊型肝炎病毒swCH189株衣壳蛋白基因CP239片段在大肠杆菌中的表达量,研究了载体、温度、转速、诱导时间以及诱导剂IPTG浓度等不同条件对衣壳蛋白基因CP239片段融合蛋白表达量的影响。结果表明,用LB培养基于37 ℃培养3.5 h后,采用终浓度为0.3 mmol/L的IPTG在37 ℃、200 r/min诱导培养4 h,pET32a-CP239融合蛋白表达量最大;SDS-PAGE检测结果表明pET32a-CP239融合蛋白的分子质量与预期大小一致,约为45.3 ku;Western blotting结果表明,pET32a-CP239融合蛋白可以与抗-HEV阳性血清发生特异性反应,并具有良好的反应原性,说明衣壳蛋白基因CP239片段蛋白得到正确表达。
关键词:猪戊型肝炎病毒;衣壳蛋白;CP239片段;原核表达
中图分类号:Q786文献标识码:A文章编号:0439-8114(2011)15-3116-04
Optimization of Prokaryotic Expression for Capsid Protein Gene CP239 in the swCH189 Strain of Swine Hepatitis E Virus
HAO Bao-cheng1,2,LIANG Jian-ping1,3,LAN Xi2,XING Xiao-yong3,XIANG Hai-tao3,WEN Feng-qin3,
HU Yong-hao3,LIU Ji-xing2,3
(1. Lanzhou Institute of Animal and Veterinary Pharmaceutics Sciences,Chinese Academy of Agricultural Sciences/Key laboratory of new animal drug project/Key laboratory of new animal drug project of Gansu Province,Lanzhou 730050,China;2. Chinese Academy of Agricultural Sciences, Lanzhou Veterinary Research Institute/ livestock disease State Key Laboratory of Pathogen Biology/Ministry of Agriculture Key Laboratory of Animal Virology/Department of Agriculture focused on plant-eating animal disease laboratory in Lanzhou, Lanzhou 730046, China; 3. Gansu Agricultural University, Animal Medical College, Lanzhou 730070, China)
Abstract: To improve the expression quantity of capsid proteins genes CP239 fragment of swine hepatitis E virus swCH189 strains in Escherichia coli., the influence of vector, temperature, rotating speed, inducting time and IPTG concentration on the expression quantity was analysed. The results showed that the fusion protein expression amount of pET32a-CP239 was the largest after cultivated 3.5 h with LB at 37 ℃ and 4 h inducting cultured with 0.3 mmol/L IPTG at 37 ℃,200 r/min. The molecular weight was determined as 45.3 ku by SDS-PAGE electrophoresis which was agreement with prediction. The Western blotting detection showed a specific reaction of pET32a-CP239 fusion protein for Anti-HEV positive serum and with well reactionogenicity. It indicated that the capsid protein gene CP239 fragments was properly expressed.
Key words: swine hepatitis E virus; capsid protein; CP239 fragment; prokaryotic expression
戊型肝炎病毒(Hepatitis E virus,HEV)过去曾被认为是一种经肠道传播的非甲非乙型肝炎病毒。Balagan等[1]用免疫电镜技术从一名志愿受试者粪便中观察到直径为27~30 nm的病毒样颗粒,从而证实该病毒为新型的肝炎病毒,并对人类健康具有严重的危害性。HEV基因组为单股正链RNA,约7.3 kb,具有3个开放读码框(ORF)。病毒基因组的5′端到3′端依次为5′端非编码区、ORF1、ORF3、ORF2、3′端非编码区及polyA 尾。
HEV ORF2编码蛋白(PORF2)抗原表位数量多,结构复杂,除N端25-38 aa外,大多数分布在C端2/3部分,包括了PORF2 25-38 aa、319-340 aa、341-354 aa、390-470 aa、422-437 aa、517-530 aa、546-580 aa、631-648 aa、641-660 aa等9个抗原活性区,研究还证实在394-470 aa之间至少含有5个不同免疫活性的抗原表位[2-4]。本试验利用protean软件对HEV swCH189株的ORF2进行潜在抗原位点分析。在ORF2 C端2/3处选取CP239片段(381-623 aa)进行了原核表达,在克隆和表达了CP239片段的基础上对其表达条件进行了优化,以期获得最大产量的融合蛋白用于建立快速诊断方法。
1材料与方法
1.1病毒株
经RT-PCR检测HEV RNA为阳性的swCH189株,由中国农业科学院兰州兽医研究所传染病实验室保存。
1.2菌种和载体
菌种为大肠杆菌E.coli JM109,表达菌Rosetta及表达载体pET28a(+)、pET32a(+)由中国农业科学院兰州兽医研究所传染病实验室保存。克隆载体pMD18-T载体购自大连宝生物工程公司。
1.3试剂
辣根过氧化物酶标记的羊抗猪IgG抗体、DAB为鹏程公司产品。RNase、低分子蛋白质Marker、琼脂糖购自联创公司。Fermentas 蛋白Marker购自鹏程公司。其余试剂均为分析纯或生化试剂。
1.4融合蛋白的诱导表达
含CP239基因的重组质粒pET28a-CP239、pET32a-CP239和pET28a、pET32a空载体分别导入表达受体菌Rosetta中,挑取单菌落于37 ℃培养至OD600nm≈0.6,加入异丙基硫代半乳糖苷(IPTG)诱导一定时间,并以空菌、空载体和未加IPTG的培养物作为对照;菌体离心后弃上清液,沉淀重悬于10 mL含2% DOC的细菌裂解液,振荡混匀,室温放置15 min,4 ℃、12 000 r/min离心10 min。取沉淀再重复上述步骤2次,上清液均留样。使用最小体积的4 mol/L的尿素将沉淀溶解,4 ℃、12 000 r/min离心20 min。沉淀中若仍有透明未溶解物质,再用8 mol/L的尿素溶解,4 ℃、12 000 r/min离心20 min,弃沉淀。重悬后加入2倍SDS-PAGE上样缓冲液混匀,沸水煮5 min,12 000 r/min离心1 min后取上清液进行SDS-PAGE检测,鉴定目的基因的表达情况。
1.5融合蛋白的鉴定
Western blotting鉴定融合蛋白,即样品经12% SDS-PAGE分离后,按Bio.Rad湿转使用说明将蛋白转至硝酸纤维素膜上,200 mA,105 min完成湿转。用5%牛血清37 ℃封闭液室温封闭2 h。将硝酸纤维素膜放入干净的塑料袋中,加用封闭液稀释的人抗-HEV阳性血清(1 000倍稀释),封闭塑料袋,室温摇摆平台过夜。100 mL PBST洗膜5次,每次15 min。加入用封闭液以1 000倍稀释的辣根过氧化物酶标记的羊抗猪IgG抗体,室温温育2 h。100 mL PBST洗膜5次,每次15 min,AEC(3-氨基-9-乙基卡唑,3-amino-9-ethylcarbozole)显色15 min,用滤纸吸干膜上残余液体,拍照保存。
2结果与分析
2.1不同表达载体对CP239表达量的影响
分别将pET28a-CP239、pET32a-CP239的重组菌1%接种于含氨苄西林抗性的LB培养基中,37 ℃ 摇床培养3.5 h至OD600nm≈0.6,加入终浓度为1.0 mmol/L的IPTG,37 ℃诱导培养4 h,SDS-PAGE 检测结果表明pET32a中CP239表达量较高, pET28a中表达量较低,因此pET32a是比较适合CP239表达的载体。
2.2温度对重组菌生长和pET32a-CP239表达量的影响
重组菌1% 接种于含氨苄西林抗性的LB培养基中,37 ℃培养3.5 h至OD600nm≈0.6,加入终浓度为1.0 mmol/L的IPTG,分别在22、30、37 ℃诱导培养4 h。SDS-PAGE检测结果表明,37 ℃时pET32a-CP239表达量最高,30 ℃时表达量稍低,而在22 ℃时表达量更低。
2.3转速对重组菌生长和pET32a-CP239表达量的影响
重组菌1%接种于含氨苄西林抗性的LB培养基中,37 ℃培养3.5 h至OD600nm≈0.6,加入终浓度为1.0 mmol/L的IPTG, 分别在37 ℃、200 r/min和37 ℃、100 r/min诱导培养4 h。SDS-PAGE 检测结果表明,转速对pET32a-CP239的影响很大,37 ℃、100 r/min诱导培养条件下pET32a-CP239表达量较低。
2.4IPTG使用浓度对重组菌生长和pET32a-CP239表达量的影响
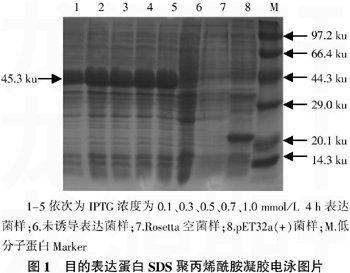
IPTG是重组菌表达目的蛋白的诱导剂,将重组菌1%的接种量接种于含氨苄西林抗性的LB培养基中,37 ℃培养3.5 h至OD600nm≈0.6,分别加入不同终浓度的IPTG(0.1、0.3、0.5、0.7、1.0 mmol/L)诱导表达。SDS-PAGE检测结果表明,IPTG对pET32a-CP239融合蛋白的表达量有明显影响,加IPTG前基本不表达; 在浓度小于0.3 mmol/L时表达量较小,在浓度等于0.3 mmol/L时能完全表达,在浓度大于0.3 mmol/L时也能完全表达,因此,在浓度为0.3 mmol/L时,表达最优(图1)。
2.5IPTG诱导时间对pET32a-CP239表达量的影响
重组菌1% 接种于含氨苄西林抗性的LB培养基中,37 ℃培养3.5 h至OD600nm≈0.6,加入终浓度为1.0 mmol/L的IPTG,诱导时间分别从1 h至8 h。SDS-PAGE电泳结果表明,IPTG诱导培养4 h时pET32a-CP239融合蛋白的表达量较高,大于4 h后表达量已没有明显差别。
2.6Western blotting鉴定结果
在优化条件下,将含重组质粒pET32a-CP239 的大肠杆菌菌株Rosetta在37 ℃培养3.5 h后,使用终浓度为1 mmol/L的IPTG在37 ℃诱导培养4 h。SDS-PAGE检测结果表明,融合后的目的蛋白为单一条带,大小约为45.3 ku,与预计的分子质量大小相符合(图2);Western blotting结果表明,pET32a-CP239融合蛋白可以与抗-HEV阳性血清发生特异性反应,并具有良好的反应原性。
3讨论
大肠杆菌是第一个用于重组蛋白生产的宿主菌,它不仅具有遗传背景清楚、培养操作简单、转化和转导效率高、生长繁殖快、成本低廉,可以快速大规模地生产目的蛋白等优点[5],而且其表达外源基因产物的水平远高于其他基因表达系统,表达的目的蛋白量甚至能超过细菌总蛋白量的30%,因此大肠杆菌是目前应用最广泛的蛋白质表达系统[6]。
目前人们运用基因工程技术已在大肠杆菌中成功地表达了许多重要的生物活性蛋白基因,但是由于目的基因结构的多样性及其与大肠杆菌基因的差异,不同的外源基因在表达效率上有很大的差异。表达系统的核心是表达载体。用来在大肠杆菌中表达外源基因的载体有很多种,一般来说,这些载体应满足以下要求:重组质粒拷贝数多,表达量高;适用范围广;表达产物容易纯化;在菌体内稳定性好。不同载体的特点不同,主要的差别有启动子类型、质粒拷贝数、基因本身的因素、密码子的偏爱性等,宿主菌的特点也很重要,融合表达策略也有利于顺利表达外源蛋白。这些就决定了对某一个特定的基因而言,并非所有的表达载体都适合。因此在本试验中,通过不同表达载体与宿主菌﹑培养条件适宜的组合来使目的蛋白获得最大量的表达。
从实验结果看温度对目的蛋白表达量的高低影响较小。试验选择37 ℃作为诱导温度,是因为目的基因在低温时表达稍低,在高温时又常常会使一些蛋白积累形成包涵体[7]。诱导温度对表达量有影响,主要体现在对宿主后续生长的影响上。
异丙基硫代半乳糖苷(IPTG)是一种作用极强的诱导剂,不被细菌代谢而且十分稳定,因此IPTG是实验室常用的乳糖操纵子诱导剂,能与lac?譙编码的阻遏蛋白特异性结合,使阻遏蛋白构象发生变化,从而诱导T7启动子驱动重组基因的转录和表达,是一种十分有效的诱导剂[8]。Fass等[9]早在1991年的研究表明IPTG的剂量有一定范围,浓度过低影响目的蛋白的表达,浓度过高则抑制细菌的生长,在培养基中少量存在时就可进入菌体内部发挥作用,是一种非代谢的诱导物。试验采用IPTG作诱导剂,从图1可以看出,IPTG对基因的表达有关键性的影响。与诱导前相比,加入IPTG后目的基因表达条带明显增加,但不同终浓度IPTG对融合蛋白的表达量影响较小。当IPTG浓度增加到1 mmol/L时,pET32a-CP239蛋白的表达量较大,继续增加IPTG的浓度,pET32a-CP239蛋白的表达量不增加反而略有下降,这可能是由于较高浓度的乳糖提高了细菌的生长速度,当细菌过快生长时,质粒的拷贝数降低,导致表达量下降。在本试验中IPTG诱导表达的最佳终浓度为0.3 mmol/L。
诱导时间对蛋白表达量有一定影响,诱导时间太短,菌体量少,目的蛋白量也少;诱导时间太长,则菌体老化,酶体系统活性减弱,代谢速度减慢,转录翻译迟钝,不利于目的蛋白的表达。从试验中发现,37 ℃诱导4 h时pET32a-CP239蛋白的表达量最大,诱导时间过短蛋白表达量稍低,诱导时间过长,表达量已经恒定,延长时间表达已没有意义,且诱导时间达7 h以上时,蛋白的表达量反而降低。原因可能是由于细菌生长接近饱和而老龄菌体增加所致,有研究报道如果再更换等体积新鲜培养基诱导或可获得更高的蛋白表达量[10]。
参考文献:
[1] BALAYAN M S, ANDJAPARIDZE A G, SAVINSKAYA S S, et al. Evidence for a virus in non-A, non-B hepatitis transmittedvia the fecal-oral route[J]. Intervirology,1983,20(1):23-31.
[2] KAUR M,HYAMS K C,PURDY M A,et al. Human linear B-cell epitopes encoded by the hepatitis E virus include determinants in the RNA-dependent RNA polymerase [J]. Proc Natl Acad Sci USA,1992,89(9):3855-3858.
[3] KHUDYAKOV Y E,KHUDYAKOVA N S,FIELDS H A,et al. Epitope mapping in proteins of hepatitis E virus[J].Virol,1993,194(1):89-96.
[4] KHUDYAKOV YU E,FAVOROV M O,JUE D L,et al. Immunodominant antigenic regions in a structural protein of the hepatitis E virus[J].Virol,1994,198(l):390-393
[5] NUC P, NUC K. Recombinant protein production in Escherichia coli[J] . Postepy Biochem,2006,52(4):448-456.
[6] DONG X, TANG B, LI J, et al. Expression and purification of intact and functional soybean (Glycine max) seed ferritin complex in Escherichia coli[J]. J Microbiol Biotechnol, 2008,18(2):299-307.
[7] 魏巍,刘璇,黄小国,等. 猪瘟病毒囊膜糖蛋白E2 的原核表达及重组蛋白ELISA 应用[J]. 畜牧与兽医,2008,40(6):70-72.
[8] 杨书慧,赵胜军,刘军,等. 乳糖诱导甜蛋白Monellin在大肠杆菌中的表达[J]. 中国生物工程杂志,2008,28(3):53-58.
[9] FASS R, VAN DE WALLE M, SHILOACH A,et al. Use of high density cultures of Escherichia coli for high level production of recombinant Pseudomonas aeruginosa exotoxin A [J]. Applied Microbiology and Biotechnology,1991,36(1):65-69.
[10] 王秋霞,张美英,张改平,等. 猪囊尾蚴排泄分泌抗原Ts8B1蛋白原核表达条件的优化[J]. 华北农学报,2009,24 (3):59-63.
