运动性疲劳动物模型制备的研究进展
2011-11-09杨道宁
杨道宁,李 丽
(1.吉林大学体育学院,吉林长春 130012;2.嘉应学院体育学院,广东梅州 514015)
运动性疲劳动物模型制备的研究进展
杨道宁1,李 丽2
(1.吉林大学体育学院,吉林长春 130012;2.嘉应学院体育学院,广东梅州 514015)
通过整理与分析运动性疲劳动物模型的建立、模型制备的注意事项及评价指标,探讨过度训练动物模型存在的问题,为过度训练的深入研究提供参考。
运动性疲劳;实验动物;模型
随着对运动性疲劳(exercise-induced fatigue)的机理及恢复等方面研究的日益深化,人们更加依赖于各种实验动物(experimental animal)来实现带有创伤性的、深层次的研究。目前人们主要选取大鼠和小鼠为研究对象,多以跑台或游泳作为训练手段来模拟人类运动训练。查阅国内外相关文献,人们在建模中所采用的实验对象、实验条件、判断标准均有较大差异,影响了有关研究的开展与深入。因此,对相关动物模型进行综述,以期为研究运动性疲劳提供基础性参考。
1 常见单因素模型(single factor modle)制备方法
1.1 急性运动性疲劳动物模型
1.1.1 大强度运动性疲劳动物模型
选用雄性SD大鼠,体重250~350g,在跑台上进行速度为28m/min(根据Bedford的最大耗氧量确定,此速度运动强度超过90%最大耗氧量,为大强度运动)水平跑运动,持续时间为20min。运动过程中采用声音和毛刷刺激,以使鼠保持持续性运动[1]。采用主观观察性指标来判断动物是否疲劳及疲劳的程度,见表1。
此模型中,大鼠疲劳已发生,但疲劳程度较轻,可通过增加动物运动组数来加深运动性疲劳程度[1]。与体育运动中由从事短时间、大强度运动的速度、爆发性项目(如100m跑、跳高、跳远以及投掷等项目)引起的人体运动性疲劳的效果相当[2]。

表1 大强度运动性疲劳动物的主观观察性指标统计表
1.1.2 有氧运动性疲劳动物模型
选用雄性SD大鼠,体重250~350g,在跑台上进行速度为18m/min(根据Bedford理论,此运动强度相当于60%~70%最大摄氧量,为中等强度运动)水平跑运动,持续时间为100min,运动过程中采用声音和毛刷刺激[1]。采用主观观察性指标来判断动物是否疲劳及疲劳的程度,见表2。

表2 有氧运动性疲劳动物的主观观察性指标统计表
动物在适当休息一定时间或降低运动强度后,仍可维持一定时间的原强度工作,表明动物虽表现为明显的疲劳特征,但并未力竭[1]。与体育运动中,由从事长时间、中等强度的项目(如800m跑、200m游泳等项目)引起的人体运动性疲劳的效果相当[2]。
1.1.3 力竭运动动物模型
1.1.3.1 跑台有氧力竭运动动物模型 选用雄性SD大鼠,体重250~350g,在跑台上进行速度为18m/min的中等强度的水平跑运动,持续时间为200min,运动过程中采用声音和毛刷刺激[1]。采用观察性指标来判断动物是否疲劳及疲劳的程度,见表3。

表3 跑台有氧力竭动物的主观观察性指标统计表
在200min运动结束时,多数动物出现力竭症状。力竭标准:当动物在较长时间休息后(一般为5min)或降低运动速度后,动物仍无力继续运动时,被视为力竭。以此可作为有氧运动力竭动物模型[1]。与体育运动中,由从事超长时间、中等强度运动项目(如5 000m跑、公路自行车、1 500m游泳等项目)引起的人体运动性疲劳的效果相当[2]。
1.1.3.2 游泳力竭运动动物模型 (1)选用雄性SD大鼠,体重约(280±6)g。采用尾部负重的游泳方式,负重重量为体重的3%,池水深50cm,水温(31±1)℃,每平方米水面同时5~6只大鼠游泳,当大鼠游至连续3次没入水底,每次超过10s,视为力竭[3-4]。
(2)选用6周龄雄性昆明种小鼠,体重(22±2)g。在水深40cm、水温(30±2)℃、长×宽×高为80cm×50cm×60cm的玻璃水池中负重6%自重游泳至力竭。力竭判断标准为:小鼠沉入水中超过10s,且放在平面上无法完成翻正反射[5]。
以上力竭运动与体育运动中,与从事超长时间、中等强度运动项目(如5 000m跑、公路自行车、1 500m游泳等项目)引起的人体运动性疲劳的效果相当。
1.2 运动性疲劳发展过程动物模型
选用雄性SD大鼠,4~6月龄,体重220~320g。将装有相当于自身体重12%的砝码的小布袋系在实验大鼠的前肢腋下,砝码带系于胸腹前,在70cm×50cm×70cm的铁箱内游泳,水深50cm,每次1只。当大鼠游至水从耳下淹到耳上,身体轻度下沉时,为运动性疲劳的开始阶段;当大鼠游至水淹过眼,其身体进一步下沉时,为疲劳的发展阶段;当大鼠游至水淹过鼻尖,身体下沉无力返回水面时,为疲劳的力竭阶段。在运动性疲劳发展过程的不同阶段对大鼠血乳酸、肝脏的光镜和电镜下结构的变化及酶组织化学进行研究,从而建立了能较客观反映糖无氧酵解供能条件下,从疲劳开始经进一步发展直至力竭的发展过程运动性疲劳动物模型。该模型经实验证明具有可重复性[3,6-8]。
1.3 慢性运动性疲劳动物模型
1.3.1 大鼠跑台模型
选用SD雄性大鼠,体重(200±20)g。训练方案见表4。造模后大鼠心室肌的肌原纤维疏散,走向紊乱,甚至部分断裂;大多数线粒体基质透明,电子致密度普遍下降,并且伴随着线粒体峪的断裂或缺失,有些线粒体膜破裂呈空泡状等[9]。有研究亦采用7周的递增负荷跑台训练建立疲劳模型,采用的运动强度稍小[10]。
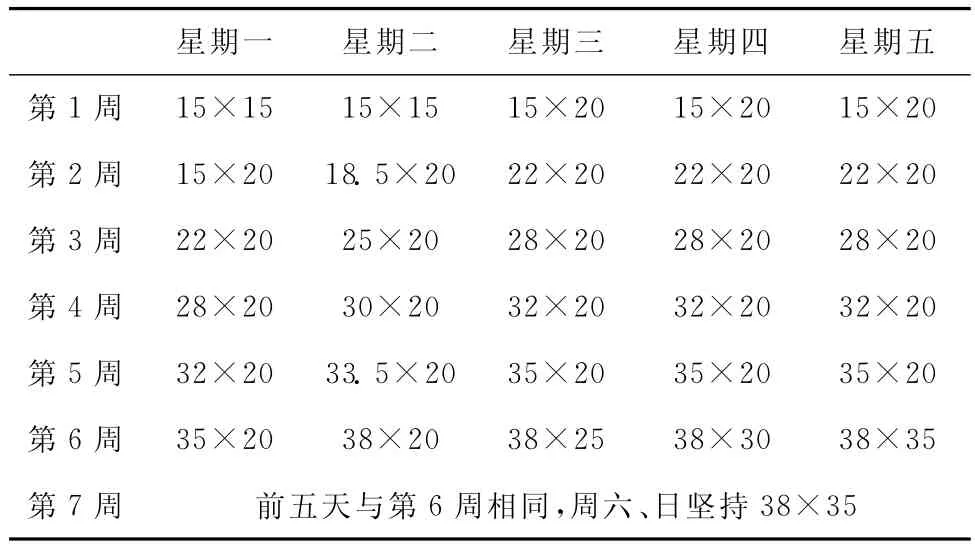
表4 大鼠7周跑台训练方案(m/min×min)
选用SD雄性大鼠,180~220g。房室温度21~24℃,相对湿度40%~55%。实验大鼠进行中等运动强度的水平跑台运动,每周7次,连续2周[11]。训练方案见表5。造模后,模型组血清、肝和骨骼肌MDA含量均显著升高,红细胞和骨骼肌SOD活性均显著降低,骨骼肌线粒体膜电位显著降低,骨骼肌线粒体游离Ca2+含量显著降低,下丘脑GABA、5-HT含量显著升高,下丘脑DA、ACh含量有显著性下降等。

表5 大鼠2周跑台训练方案(m/min×min)
1.3.2 大鼠游泳模型
选用SD雄性大鼠,10周龄,体重(200±20)g。房室温度18~25℃,相对湿度60%~70%。采用无负重游泳,静水深80cm,水温(30±1)℃。大鼠先进行3天适应性游泳训练,每天1次,每次15min。第4、5天游泳训练时间为30min,第6~8天每天递增30min,第9~10天每天进行1次力竭性游泳训练,第11~13天每天进行2次力竭性游泳训练,次间间隔6h。为防止大鼠漂浮,当发现大鼠浮在水面不运动时用木棒驱赶,使其维持运动状态。力竭的标准为:大鼠游泳的协调动作消失,水淹没鼻尖,身体下沉,至再次浮出水面的时间超过10s,并连续3次者,视为力竭[12-14]。
1.3.3 小鼠跑台模型
选用昆明种小鼠,7~8周龄,体重(27.68±2.86)g。房室温度(20±2)℃,相对湿度为(50±5)%。根据Marra的运动方案建立运动疲劳动物模型。小鼠先进行3天的适应性训练(速度为10m/min,坡度为0°),休息2天后开始进行正式跑台运动。初始速度为10m/min,在10min内逐渐增加负荷达到28m/min速度,一直持续到力竭。以这种运动方式持续运动6天。力竭标准:运动末期动物不能坚持原跑速,先后滞跑道后1/3处达3次以上,刺激驱赶无效,停跑后体征表现为呼吸急促,神情倦怠,腹卧位,对刺激反应迟钝[15-16]。1.3.4 小鼠游泳模型
(1)选用雌性2月龄BALB/c小鼠,体重为(18.20± 0.25)g。房室温度23~28℃,相对湿度为50%~65%。水温(30±2)℃,水深35cm。每周游泳6天,周日休息,共游泳12周。第1周为每次无负重游泳30min,第2周增加至60min,第3周增加至180min,第4周开始尾部负体重的4%,保持180min至第12周末。游泳过程中用玻璃棒干预,使小鼠不停地游动。造模后小鼠运动能力下降、食量大减、体重减低、体毛不洁、精神倦怠、心率增加,血红蛋白和血睾酮下降,皮质醇和血乳酸升高[17]。
(2)选用雄性5周龄昆明种小鼠,体重18~22g。房室温度22~27℃,相对湿度为40%~65%。水深35cm,水温(30 ±2)℃,进行6周无负重游泳运动,第1周游泳30min/d,以后每周递加10min,至第6周游泳90min/d,每天游泳1次,每周游泳6天,周日休息[18]。亦有将游泳时间延长为7周[19]。造模后小鼠体重的增长幅度显著慢于对照组小鼠[18、19]。
1.3.5 大耳兔跑跳模型
选用10~12月龄日本大耳白兔,体重(3.25±0.24)kg。动物放在由两根不同极性的金属条构成的面积为85cm× 160cm的金属栅栏上,电刺激器向金属栅栏放电,动物为逃避电刺激产生跳跃和奔跑而引起剧烈运动,训练量为l5s刺激一次,刺激时间为0.2~0.5s。动物受刺激后沿刺激笼跑跳数步并转弯。每天训练120min,训练60min后休息20min。每周训练6天,星期日休息,连续训练3周。造模后大耳兔腱围内纤维和小血管增生,管壁增厚,跟骨结节滑囊明显增厚,结缔组织增生,腱围肥厚[20]。
2 常见复合因素模型(complex factors modle)制备方法
有学者认为运动致疲劳动物模型的重复性、可靠性较差;单纯地施加运动因素复制运动损伤动物模型缺少竞技体育中的精神压力,不能准确反映竞技体育的运动员损伤。因此,研究者试图使用2种以上的施加因素进行造模。目前主要的复合因素有药物结合运动、刺激手段结合运动等,技术相对成熟的是药物结合运动的复合因素模型的制备,见表6。

表6 常见复合因素致疲劳的动物实验研究
3 制备模型注意事项与不同制备方法优缺点的比较
3.1 制备模型注意事项
3.1.1 实验动物的选择
从目前大多数研究人员对实验动物的选择来看,大鼠主要是SD大鼠和Wistar大鼠,以前者为多。小鼠主要是昆明种小鼠、BALB/c小鼠和ICR小鼠,以昆明种小鼠为最多。偶见兔子等其他动物模型。对于运动员来说,不同的年龄段所能承受的运动负荷存在一定差别。实验动物的生命周期(大鼠和小鼠的自然寿命为2~3年)比人类短,仅仅相差1个月乃至1~2周就可能表现出较大的差别。因此实验动物月龄或周龄的选择也应引起重视。一般将3月龄~12月龄称为成年大鼠(成年期),12月龄以后为衰退期大鼠(老龄期),3月龄以前为发育早期大鼠(未成年期)[29];1.5月龄~14月龄为成年小鼠,14月龄~17月龄为衰老起始年龄,1.5月龄以内为未成年期小鼠[30-31]。在大鼠2个月龄、小鼠1~2月龄时,即达到性成熟期,相当于人类的青春期,在此阶段无论是人还是大鼠、小鼠,运动能力都是比较强的时期,因此也是最适合进行运动的时间段[3]。不过,选择哪个年龄段主要依据研究者的研究目的。在动物性别方面,雄性动物应用最多。但如果是主要对雌性动物研究和性别有关的问题,对实验动物性别的要求就是主要考虑的问题。另外,研究者也要结合运动方式、强度和实验测试指标的需要等进行实验动物的选择。
3.1.2 模型要尽可能再现所要求的运动疲劳状态
为了复制运动员在训练过程中出现的疲劳状态,应该选择与运动员的训练(耐力、速度、力量等)相一致或接近的运动训练模式进行造模,也就是说实验动物的运动强度、运动时间、运动方式是影响疲劳形成、造模成功与否的关键。
3.1.3 注意环境因素对模型动物的影响
造模的成败往往与环境的改变有密切关系。拥挤、饮食改变、过度光照、噪音、温度、湿度(小鼠对温度和湿度均比较敏感)、通风情况的破坏等,任何一项被忽视都可能给模型动物带来严重影响。除此以外,跑台运动的刺激方法、强度和频率、跑道的宽窄,泳池的大小、水深、水温、水的清洁程度(特别是多批次动物游泳)、游泳时的环境温度、游泳密度、驱赶方法、静水或流动水、游泳后动物的干燥方法应叙述详细,使模型的建立更具科学性、可重复性。
3.1.4 对照组与实验组所处环境应一致
在实验过程中,对照组动物与实验组动物应保持在同一环境中,例如实验组动物游泳,对照组动物应在同温度的浅水中不进行游泳,以排除水温因素对实验的干扰[17]。实验动物在跑道上跑步,对照组动物应放在同规格跑道上,以排除环境的影响。
3.2 不同制备方法的优缺点比较
3.2.1 跑台和游泳的比较
3.2.1.1 跑台 优点:运动强度较容易控制。缺点:动物跑台一般采取电击、声音刺激、毛刷刺激或强气流来驱使动物进行奔跑,其产生的是非主动性运动,这是动物跑台应用中的一个局限性因素。运动时当大鼠的跑速低于跑台速度,会受到较强的刺激来强迫它以规定的强度和时间完成运动,这种刺激严格地说是一种伤害性刺激,使大鼠产生了防御性反射应激,这不是运动应激,过度应急有时会导致动物死亡[32]。有研究表明:仅仅刺激尾部的皮肤,就会引起大鼠生理上的改变,如引起去甲肾上腺素和肾上腺素的升高。而且并非所有大鼠都能学会在跑台上奔跑。易造成尾部和足部的机械性损伤,引起出血和继发感染,影响实验结果[33]。另外,不同运动时间、运动强度,对大鼠造成的过度训练程度亦有所不同。相同的运动强度下,不同的刺激方式对大鼠机体的影响也不一样。因此,研究结果进行比较与交流时,要统一刺激方法、频率等实验条件。
3.2.1.2 游泳 优点:实验所需设备大多简便易得。由于游泳是大鼠和小鼠的本能,采用游泳方式训练时大鼠和小鼠不会产生强烈的抵触情绪,在使用流动水或不停搅动水使动物不停运动时,实验动物承受体力外的不良刺激少,是一种卷入“情感因素”最少的训练方式[34]。而且易维持运动强度在较高水平[35]。另外,游泳对心脏的影响比较显著[36]。
缺点:①需水量较大:为避免实验动物尾巴撑在池底休息,要求静水深要超过实验动物身长的2倍,一般大鼠游泳水深50cm以上,小鼠游泳水深20cm以上;每只实验动物占用的水面积大多在300cm2以上。②时刻监控水温,无特殊需求一般应控制在28~36℃之间,一般上下波动幅度为1~2℃。③工作量大。有动物在游过几次之后学会了漂浮,需用木棒驱赶,个别动物会借势爬到竹竿上以逃避训练。有的动物可游数小时而不疲劳,这就需要加大强度,如负重。常用的负重方法有尾部负重、腋下胸前负重和背后负重,不同的负重部位对动物的疲劳时间、疲劳强度是否有影响,目前还不清楚。同时,不论大鼠还是小鼠在游泳时都会排便、排尿,并释放某种“警戒物质”[37]。同批次游泳要不断地清除粪便、杂草、锯末等杂质,不同批次实验动物进行游泳时,要保证游泳水的清洁最好是换水。另外,实验动物运动完要进行擦拭、吹风等干燥处理。不难看出从负重、准备游泳用水、清除杂质、保证水温、驱赶动物或搅动水、换水到干燥,制备游泳模型的实验工作量很大。④在大鼠游泳训练中,游泳时间越长呼吸道感染的发生率就较高,故需对保健问题予以足够的重视[38]。
3.2.2 单因素和复合因素的比较
3.2.2.1 单因素 优点:干扰的因素少,实验结果主要由运动引起。缺点:大小鼠等没有人类复杂的情感,所以所造模型与人类实际还有一定差距。
3.2.2.2 复合因素 优点:竞技体育运动员中经常发生的损伤是由运动因素和精神压力共同引起的。复合因素可在运动影响的基础上添加精神上的影响。缺点:干扰因素多,实验结果的归因性不强。
4 判断模型成功的典型的形态、生化改变指标
4.1 一般状况指标
4.1.1 形态的观察
主要观察动物的“表情”和“逃避”反应:实验前动物均神态安静,活泼好动,食欲良好,眼睛有神,对新异刺激及周围环境的变化反应灵敏,且皮毛紧密光滑,干净润泽。实验过程中,动物随着运动时间延长和运动量的增长,逐渐出现了神情倦怠,眯眼,双眼暗淡无光;皮毛蓬乱枯稿,皮毛不顺、片状脱落(脱毛);食欲降低,体型瘦弱,拱背,懒动,扎堆、便溏;对外界刺激反应迟钝,探究行为明显减少,出现明显的胆怯状态等现象[28,39-40]。
其中部分词语的解释如下:
眯眼:不愿睁眼,上眼睑覆盖限球1/2以上[41]。
便溏:依据泄泻的程度将粪便分为三级,“+”粪便成型,但排出时粪便表面带有较多水分;“++”便溏,易粘附锯末;“+++”:水样便[42]。
探究行为及情绪反应主要通过旷场实验和鼠尾悬挂实验来反映[5]。
旷场实验:将是实验大鼠放入开阔箱的正中格内,并开始计时,观察大鼠6min内的行为举动。测定指标包括:①方格间穿行次数(三爪以上跨入邻格的次数);②理毛修饰时间(两前肢离地1cm以上的时间,即前肢向上抬举、抓痒、洗脸、舔足)。
鼠尾悬挂实验:固定大鼠尾端,使其呈倒挂状态,四周以隔板隔离动物视线,动物为克服不正常的体位而挣扎活动,但活动一定时间后出现间断性“不动”,显示“失望”状态。计录6min内的不动时间,并同时观察大鼠挣扎次数。
拉尾排便试验(运动性脾虚模型常用):一手固定鼠笼,一手抓住大鼠尾巴中部,向后上方提拉,此时动物抓紧鼠笼尽量向前用力,这样持续1min。若1min内动物有粪便排出为拉尾排便阳性[43]。
4.1.2 运动姿势和运动能力的观察
4.1.2.1 跑台 跑的姿势:动物后蹬地不积极,吃力或无力,腹部与跑道面时有接触或一直接触(由蹬地跑变为半卧位或卧位跑)等即是疲劳的表现之一[1]。
运动能力:动物不能维持原运动强度,先后滞跑道后1/3处达3次以上,或刺激频率增加达6次/min以上,刺激时间延长等,视为大鼠疲劳[1]。
4.1.2.2 游泳 游的姿势:动物游泳的协调动作消失。
运动能力:①动物潜入水底几秒钟后反弹跳起的次数和在水面漂浮的现象明显增多。②实验动物下沉于水中一定期限不能再浮出水面(这个期限从3s至60s不等)或连续3次没入水底,每次超过10s,出水后被握持时四肢下垂或沉入水中超过10s,且放在平面时无法完成翻正反射即视为疲劳。但在实践中,有些标准太苛刻,危险性很大,往往造成动物死亡,使得所建模型不能再现或缺乏稳定性。McArdle[33]和郭庆军[4]等人推荐使用“经10s后仍不能返回水面”作衡量游泳能力时的观察指标。
4.2 典型的生化指标
4.2.1 结合定义
运动性疲劳模型是根据运动性疲劳的定义“机体工作能力暂时性降低,经过适当休息后又可以恢复”来建立的,因此生化指标的变化也应依据于此。可使用判断机体机能状态的有关指标,如血红蛋白、血细胞比容、血乳酸、血尿素、尿蛋白、血清肌酸激酶、血睾酮、皮质醇等,在运动后即刻升高,与对照值相比有显著性差异,运动后12h达到较高水平,至运动后24h虽有下降,但仍高于对照组,视为运动性疲劳。部分指标人类的参考标准:血红蛋白下降10%~15%,血细胞比例下降5%~9%,血睾酮晨安静值下降15%~20%,皮质醇晨安静值升高20%左右,尿蛋白在运动后升高3~4倍,运动4h后可恢复[44]。在以往的动物模型制备中所表现出来的数值变化幅度大于人类的变化幅度。
4.2.2 依据不同的供能方式
根据运动能力的限制因素来判断疲劳的发生。以糖酵解供能为主的运动,运动能力的限制因素主要是乳酸的堆积;强度为75%VO2max的有氧运动,运动能力的限制因素主要是肌糖原的耗竭。因此,可以通过测定血乳酸升高、肌糖原的下降来判断疲劳的发生[3,45]。
对运动性疲劳进行多指标、系统性综合评定,是一项复杂的工作,需要进一步研究。目前,国内外许多学者亦在积极探索其他较为灵敏的检测方法,如通过彗星试验(SCGE)检测细胞DNA损伤[46-47]等。
5 典型模型制备的举例
5.1 跑台
选用雄性SD大鼠,体重220~260克。实验采用Bedford据鼠体重/摄氧量回归方程所建立的渐增负荷运动模型。按以下运动程度运动至力竭:第一级负荷:坡度0°,速度8.2m/min,时间15min;第二级负荷:坡度0°,速度15m/min,时间15min;第三级负荷:坡度10°,19.3m/min(相当于76%最大摄氧量)运动至力竭。运动时使用毛刷刺激动物尾部,使动物保持在跑道前1/3处,以保证运动强度。力竭标准:第三级负荷运动中,动物未能坚持本级负荷运动跑速,先后滞跑道后1/3处达3次以上,刺激驱赶无效。行为特征:呼吸急深、幅度大、腹卧位、垂头,刺激后无反应[48-49]。
5.2 游泳
选用雄性SD大鼠,8周龄,体重(200±20)g。适应性饲养2天后,进行3天的适应性游泳训练,每天1次,每次20min,随后开始10天的正式游泳运动。训练在120cm× 120cm×120cm的玻璃缸中进行,静水深80cm,水温(30± 2)℃。在第1~7天,每天上午9:00点开始进行1次游泳运动,持续时间为3h。第8~10天每天进行2次游泳运动,次间间隔6h。在游泳过程中,当大鼠运动协调性明显下降,出现反复下沉时,将动物取出游泳缸休息3min后,再放入池中继续进行游泳,使游泳时间不少于3h。当大鼠浮在水面不运动时用木棒驱赶,使其维持运动状态[40]。
6 存在问题及思考
运动性疲劳的动物模型制备的原则是尽量模拟运动员的训练,这就提示我们有些问题值得思考。
首先如何创造训练环境:有学者研究了大、小鼠在低氧环境中进行中等强度训练后的解剖、生理和生化指标的变化情况[50,51],但低氧环境下运动性疲劳的模型制备少见报道。游泳训练中,多只实验动物在一个容器内,动物间难免出现互相蹬踩、借力,这可能会引起动物呛水、憋气上串等现象发生。Ishihara K等人[52]利用电流将游泳池分隔为几个泳道从而避免了游泳动物间的物理干扰。但会不会带来其他的干扰因素还有待于进一步研究。另外,运动员在白天训练,符合自身的24h生物节律。鼠类则一般在白天睡觉休息,晚上出来活动,而在白天进行强迫性的运动训练是不是会引起实验动物体力、免疫功能等下降呢?Wax TM等在研究C57BL/6J小鼠24h的跑笼规律时发现,小鼠在暗周期(6pm~6am)时的活动量明显大于明周期,尤以下午6时至午夜的活动量最大[53]。而这在运动性疲劳造模过程中很少强调或体现。跑台、游泳在运动性疲劳的造模中常用,而转笼(是一种自主运动无需外界刺激强迫,现阶段该模型主要用于机体适应性生理变化的研究)、举重(属于自主性随意运动,对动物无侵害,易进行调控,适用于重复阻力训练的运动能力和生理学机制等多方面的研究,但为了维持其较大强度的运动有时需要食物刺激)、负重爬(可负重,主要用于骨骼肌肥大的造模,为了维持其较大强度的运动有时需要食物或电刺激等)[54]在运动性疲劳的模型中应用较少。
第二,如何控制运动强度,部分学者对实验动物进行断尾取血进行监测,但存在一定的弊端:有创口、不能频繁断尾取血、运动中不能动态监测等;而国外学者曾通过间接测热法[55](Oxymax Deluxe同流速实验动物监测系统)对大鼠的摄氧量进行测试,但这项技术在国内还没有得以尝试或应用。
第三,对造模成功与否的评价或诊断,动物实验往往参照人类的评价标准,运动员的恢复期指标一般选运动后24h测定,但实验动物特别是鼠类,生命周期短、适应能力强(比人类要好),它们的恢复期是不是也是24h呢?人类有血清指标正常参考范围,不同品系的大、小鼠是不是也有呢?王玉良等人[56-58]曾对小鼠、Wistar大白鼠血清尿素氮、血红蛋白、血糖等指标进行了抽样测试与统计分析,但对其他实验动物及部分常见血尿指标还没有测试、对比,还缺乏更为系统的研究。
[1]田 野,高铁群.大鼠运动性疲劳模型的建立[J].北京体育大学学报,1995,18(4):49-53.
[2]蔡浩刚.大鼠运动性疲劳模型建立方法的比较研究[J].商丘职业技术学院学报,2008,7(5):111-113.
[3]郑 澜,陆爱云.运动性疲劳动物模型的研究[J].体育科技,2003,39(2):20-23.
[4]郭庆军,常耀明,李金声,等.大鼠游泳运动疲劳模型力竭标准的研究[J].现代生物医学进展,2010,15(10):2855-2858.
[5]贺 洪,唐 晖,汪保和,等.人参皂甙Rg1对小鼠力竭游泳后恢复期骨骼肌自由基代谢的影响[J].中国运动医学杂志,2002,21(6):610-612.
[6]丁同英,殷 劲,刘晓红,等.疲劳发展过程动物模型初探[J].四川体育科学,1993(4):41-44.
[7]黎 锦.大鼠疲劳模型的建立及疲劳对肝脏结构和酶组化的影响[D].成都:成都体育学院,1995.
[8]周 薇,王远金,殷 劲,等.大鼠疲劳模型的建立及疲劳对肝脏结构和功能的影响[J].成都体育学院学报,1998,24(3):81-86.
[9]王启荣,周未艾,吕丹云.理气、扶正类中药“体复康”改善运动性疲劳的大鼠心肌形态计量学研究[J].体育科学,1999,19(1):70-74.
[10]杨维益,陈家旭,梁 嵘,等.中药复方“体复康”对运动性疲劳大鼠血乳酸、β-内啡肽、亮氨酸脑啡肽及强啡肽A-(1-13)影响的实验研究[J].北京中医药大学学报,1997,20(4):37-40.
[11]汶 希,潘华山,冯 毅.大鼠运动性疲劳模型的建立[J].中国实验动物学报,2009,17(5):368-372,7.
[12]赵立平.运动性疲劳对大鼠骨骼肌蛋白质组表达谱影响的研究[D].太原:山西大学,2007.
[13]Kim NK,Joh JH,Park HR,et al.Differential expression profiling of the proteomes and their mRNAs in porcine white and red skeletal muscles[J].Proteomics,2004,11(4):3422-3428.
[14]Venditti P,Di Meo S.Antioxidants,tissue damage,and endurance in trained and untrained young male rats[J].Arch Biochem Biophys,1996,331(1):63-68.
[15]刘晓莉,苏美华,乔德才.运动疲劳诱导小鼠心肌细胞氧化应激与DNA损伤[J].中国运动医学杂志,2008,27(5):621-623.
[16]Marra S,Burnett M,Hoffman-Goetz L.Intravenous catecholamine administration affects mouse intestinal lymphocyte number and apoptosis[J].J Neuroimmunol,2005,158(1-2):76-85.
[17]田振军,张志琪.小鼠运动性疲劳相关基因筛选的初步研究[J].中国运动医学杂,2002,21(l):4-6.
[18]唐 量.芦荟对游泳训练小鼠某些生化指标、自由基代谢和组织超微结构的影响[D].西安:陕西师范大学,2001.
[19]郭丽丽,王 娟.米邦塔仙人掌对小鼠运动性疲劳影响的实验研究[J].四川体育科学,2008(4):25-28,50.
[20]刘 波,邹 明,马 建,等.运动性形体疲劳“肝肾亏虚”动物模型的实验研究[J].中国中医骨伤科杂志,2001(4):20-23.
[21]梁 嵘,杨维益,文 平,等.用泻下与劳倦因素塑造大鼠“脾气虚”症模型[J].北京中医药学院学报,1992,15(4):33-35.
[22]曲长江,刘 劲,林庶如,等.不同造模方法脾虚小鼠免疫学改变的比较研究[J].中国中医基础医学杂志,1999(4):46-49.
[23]李晓勇,靳 文,孙晓敏,等.构建复合因素致慢性疲劳大鼠模型及血生化动态变化[J].中国组织工程研究与临床康复,2008(12):4701-4704.
[24]靳 文,李晓勇,赵晓山,等.慢性疲劳大鼠模型创建研究[J].山东中医药大学学报,2008,32(2):107-108.
[25]Tanaka M,Nakamura F,Mizokawa S,et al.Establishment and assessment of a rat model of fatigue[J].Neurosci Lett.2003,352(3):159-162.
[26]朱志强,张 兰.运动性脾胃虚弱动物模型的实验研究[J].中医药学刊,2002,20(5):594-595.
[27]王天芳,陈易新,季绍良,等.慢性束缚致慢性疲劳动物模型的研制及其行为学观察[J].中国中医基础医学杂志,1999(5):25-29.
[28]曹继刚,周安方,黄琼霞,等.中医疲劳综合征大鼠模型的建立与评价[J].湖北中医杂志,2008,30(1):7-8.
[29]Hoffmann H,Hunt P S,Spear N E.Ontogenetic differences in the association of gustatory and tactile cues with lithium chloride and footshock[J].Behavioral and Neural Biology,1990,53:441-450.
[30]Bilkei-Gorzo A,Racz I,Valverde O,et al.Early age-related cognitive impairment in mice lacking cannabinoid CB1receptors[J].Proc Natl Acad Sci U S A,2005,102(43):15670-15675.
[31]朱喜科,王振宇,鲁 阳.老龄小鼠胸腺内皮细胞的变化[J].解剖科学进展,2008,14(l):24-27,31.
[32]杨晓红,王 震,徐国琴.过度训练动物模型分析[J].广州体育学院学报,2010,30(3):88-91.
[33]朱 全,浦钧宗.大鼠游泳训练在运动实验中的应用方法[J].中国运动医学杂志,1996,15(2):125-129.
[34]Kramer K,Dijkstra H,Bast A.Control of physical exercise of rats in a swimming basin[J].Physiol Behav,1993,53(2):271-276.
[35]李宁川,金其贯,孙新荣.力竭性游泳训练对建立过度训练动物模型的作用[J].体育与科学,2000,21(1):53-55.
[36]朱 全,浦钧宗,张 敏.游泳方法建立大鼠模拟过度训练模型[J].中国运动医学杂志,1997,20(2):137-140.
[37]Abel EL,Bilitzke PJ.Adrenal activity does not mediate alarm substance reaction in the forced swim test[J].Psychoneuroendocrinology,1992,17(2-3):255-259.
[38]毛 杰.大白鼠游泳训练的实验方法和运动模型[J].武汉体育学院学报,2004(3):32-34,41.
[39]杨 云,陈小野,郭育芝,等.劳倦和饥饱引起的大鼠脾虚证模型的造型及实验研究[J].中国医药学报,1989,4(2):65-67.
[40]侯莉娟,刘晓莉,乔德才.大鼠游泳运动疲劳模型建立的研究[J].实验动物科学与管理,2005,22(1):1-3.
[41]蒋时红,刘旺根,王雪萍,等.黄芪建中汤对脾虚型慢性萎缩性胃炎大鼠血象、血液和胃黏膜生化指标的影响[J].中国中医基础医学杂志,2006,12(4):279-281.
[42]杨维益,梁 嵘,陈家旭,等.脾气虚证与胰腺外分泌功能关系的实验研究[J].中国中医基础医学杂志,1995(4):41-42.
[43]刘士敬,朱倩秋.水仙碱塑造大鼠脾气虚模型的研究[J].中国中西医结合杂志,1996(S1):267-269.
[44]冯炜权.运动疲劳及过度训练的生化诊断-运动生物化学动态之三[J].北京体育大学学报,2000,23(4):498-502.
[45]武露凌,刘 钢.关于运动性疲劳动物模型建立的综述[J].体育与科学,2007,28(3):73-76.
[46]苏美华,刘晓莉,乔德才.VE对运动疲劳小鼠外周血细胞DNA氧化损伤的保护效应[J].西安体育学院学报,2010,27(2):190-193,239.
[47]张学林.热休克蛋白72(Hsp72)作为过度训练监测指标的研究[D].石家庄:河北师范大学,2004.
[48]时庆德,张 勇,文 立,等.运动性疲劳的线粒体膜分子机制研究.Ⅱ.运动性氧自由基代谢途径再探讨[J].中国运动医学杂志,2000,19(1):43-55.
[49]张 勇,时庆德,文 立,等.运动性疲劳的线粒体膜分子机制研究.1.急性力竭运动中线粒体电子漏引起质子漏增加及其相互作用[J].中国运动医学杂志,2000,18(3):236-239.
[50]赵 鹏,路瑛丽,冯连世,等.低氧训练对大鼠骨骼肌一氧化氮合酶(NOS)系统的影响[J].体育科学,2009,29(4):44-50,83.
[51]黄丽英.间歇低氧训练对大鼠氧化应激及其低氧适应机制的研究[D].上海:华东师范大学,2003.
[52]Ishihara K,Yamada A,Mita Y,et al.Improved swimming pool achieves higher reproducibility and sensitivity to effect of food components as ergogenic AIDS[J].J Nutr Sci Vitaminol(Tokyo),2009,55(3):301-308.
[53]陈运才,姚志彬,顾耀铭,等.长期运动对小鼠运动功能年龄变化的影响-1.旷场试验[J].中国运动医学杂志,1996,15(1):2-6.
[54]李俊平,徐玉明,王瑞元.常用动物运动模型的方式与发展[J].北京体育大学学报,2006,29(12):1669-1671.
[55]Leandro CG,Levada AC,Hirabara SM,et al.program of moderate physical training for Wistar rats based on maximal oxygen consumption[J].J Strength Cond Res,2007,21(3):751-756.
[56]李显华,张 宏,向绍杰,等.Wistar大白鼠血红蛋白的抽样测试与统计分析[J].动物学杂志,2000,35(1):24-26.
[57]向绍杰,杜佳林,张 宏,等.6~8周龄Wistar大白鼠血清尿素氮的抽样测试与统计分析[J].动物学杂志,1999,34(3):25-27.
[58]王玉良,李显华,张 宏,等.沈阳地区小白鼠血糖值的测试与分析[J].动物学杂志,1994,29(2):33-36,53.
A Summarizing Study on Preparation of Animal Model of Exercise-induced Fatigue
YANG Daoning1,LI Li2
(1.Physical Education Institute of Jilin University,Changchun 130012,Jilin,China;
2.PE Department of Jiaying University,Meizhou 514015,Guangdong,China)
This paper consolidated and analyzed the establishing way of animal model of exercise-induced fatigue,its cautions and assessment,and problems in animal models.It provided reference to in-depth research on exercise-induced fatigue.
exercise-induced fatigue;experimental animal;model
G804.2
A
1004-0560(2011)03-0080-06
2011-03-15;
2011-04-25
杨道宁(1963-),男,副教授,学士,主要研究方向为体育教学训练与体育健康促进。
常 波(1964-),男,教授,博士,主要研究方向为优秀运动员机能水平的监控与评定。E-mail:changbo8387@163.com。
乔艳春
◂体育教育训练学
