2,4-二氯苯酚与人血清白蛋白相互作用的研究
2011-07-25陈艳萍张业中
王 洋,陈艳萍,张业中
(长江大学化学与环境工程学院,湖北 荆州 434023)
氯酚类化合物被广泛用作防腐剂、防锈剂、除草剂及农药,在水中的溶解度大,结构稳定,不易分解和转化,它们在自然界中不断积累,给自然环境造成较大危害,已被美国环保局和我国列为优先控制污染物[1]。2,4-二氯苯酚(DCP)是氯酚类化合物的一个典型代表,作为一种重要的有机中间体,DCP能通过食物链在动物体内不断积累,对人体、动植物等具有很强的毒性、致癌性及突变性,因此,对氯酚类化合物的研究日益引起人们的关注[2]。
人血清白蛋白(HSA)是血浆中含量最丰富的重要载体蛋白,由585个氨基酸残基组成,具有存储和转运内源性代谢产物和外源性药物小分子的重要生理功能。药物分子进入血液后不同程度地与人血清白蛋白结合,可以控制药物的释放和代谢。因此,研究二者的相互作用对于了解药物在人体内的储存、运输、吸收、分布及代谢进程,阐明血清白蛋白与药物小分子相互作用的本质具有重要的指导意义[3,4]。作者利用荧光光谱法、紫外吸收光谱法、圆二色谱法和三维荧光光谱法等方法研究DCP与HSA的相互作用,获得其相互作用机理、结合常数,并考察了DCP与HSA结合后HSA构象的变化。
1 实验
1.1 试剂及仪器
2,4-二氯苯酚(溶液浓度1.0×10-3mol·L-1),上海国药集团化学试剂有限公司;2.0×10-6mol·L-1HSA溶液,Sigma公司;Tris-HCl缓冲溶液(pH值7.40);所用试剂均为分析纯,实验用水为二次蒸馏水,经检测均无荧光杂质。
LS-55型荧光分光光度计,美国PE公司;J-810型圆二色谱仪,日本Jasco公司;TU-1901型紫外可见分光光度计,北京普析分析仪器公司;AY-120M型电子分析天平,日本岛津公司;SYC-15型超级恒温水浴(控温精度±0.1℃),南京桑力电子设备厂。
1.2 方法
1.2.1 荧光光谱
测定条件:激发波长λex为285 nm、激发狭缝宽度为15 nm、发射狭缝宽度为4.0 nm。在模拟人体生理条件下,用微量进样器加入不同量的DCP溶液,测定其与HSA相互作用的荧光猝灭图谱,记录波长在300~450 nm范围内的荧光光谱。
1.2.2 紫外吸收光谱
测定条件:石英比色皿光路长为1.0 cm,测定200~320 nm波长范围内的紫外吸收光谱。
1.2.3 圆二色谱
测定条件:比色杯光路长为0.1 cm,扫描速度为200 nm·min-1。在pH值为7.40、持续氮流的条件下测定190~270 nm波长范围内HSA与DCP作用前后的圆二色谱图,通过Jasco′s Spectra Manager MT软件来控制。在相同实验条件下,作为参照物的缓冲溶液从样品光谱中扣除。圆二色谱的测量结果用平均摩尔椭圆率(MRE)表示,单位为degree·cm2·dmol-1。游离的和结合的蛋白质中,α-螺旋结构的含量根据208 nm处的MRE值依下式计算[5]:
式中:MRE208为208 nm处观测到的MRE值;4000为208 nm处β-折叠和无规卷曲构象的MRE值;33000为208 nm处纯α-螺旋结构的MRE值。
1.2.4 三维荧光光谱
测定条件:初始激发波长为200 nm,每隔5 nm记录一次200~500 nm之间的发射光谱,扫描31次,其它参数与荧光猝灭光谱的参数相同。
2 结果与讨论
2.1 荧光猝灭机制和猝灭常数
荧光猝灭过程分为动态猝灭和静态猝灭,它们可以从温度影响、粘度影响或荧光寿命等方面加以区分。研究表明,对于静态猝灭过程,其猝灭常数随温度的升高而减小;相反,动态猝灭常数随温度的升高而增大。
不同浓度的DCP与HSA作用时的荧光发射光谱如图1所示。
由图1可知,当激发波长为285 nm时,HSA在350 nm处有一个强的荧光发射峰,随着DCP浓度的增大,HSA的荧光发射光谱的峰形不变,峰位出现轻微蓝移,荧光强度规律性地降低,说明DCP对HSA的荧光有猝灭作用。
为了判断DCP对HSA的猝灭机制,用Stern-Volmer[6]方程[式(1)]分析4个温度(292 K、298 K、304 K、310 K)下的荧光猝灭数据:
F0/F=1+KSV[Q]=1+Kqτ0[Q]
(1)
式中:F0和F分别表示不存在和存在猝灭剂时生物大分子的荧光强度;KSV为Stern-Volmer猝灭常数;[Q]为猝灭剂的浓度;Kq为生物大分子的猝灭速率常数,它反映了体系中分子的彼此扩散和相互碰撞对生物大分子荧光寿命衰减速率的影响;τ0为不存在猝灭剂时荧光分子的平均寿命,生物大分子的平均寿命约为10-8s[7]。
以F0/F对[Q]作图(如图2所示),根据方程(1)算出4个温度下的猝灭常数,结果列于表1。

图2 4个不同温度下的Stern-Volmer关系图(pH=7.40)

表1 4个不同温度下 DCP与 HSA相互作用的Stern-Volmer猝灭常数(pH=7.40)
由表1可知,KSV随温度的升高呈减小趋势,并且4个温度下相应的Kq值都远大于生物大分子的最大分散碰撞猝灭速率常数(2.0×1010L·mol-1·s-1)[8]。这初步表明DCP对HSA的荧光猝灭为形成复合物所引起的静态猝灭。
动态猝灭只影响荧光分子的激发态,不会改变荧光体的吸收光谱,而在静态猝灭过程中,基态配合物的形成会导致荧光体吸收光谱的改变。所以通过观察加入药物前后HSA吸收光谱有无改变,可以判别猝灭类型。分别测定DCP、HSA和DCP-HSA的紫外可见吸收光谱,见图3。

A.c(DCP)= 2.0×10-6mol·L-1 B.c(HSA) = 2.0×10-6mol ·L-1 C.c(HSA)=c(DCP)=2.0×10-6mol·L-1(1∶1)
由图3可知,HSA的吸收光谱在加入DCP前后明显不同(曲线B和曲线C),进一步证明DCP对HSA的猝灭过程为静态猝灭。
对于静态猝灭,可用修正的Stern-Volmer方程[9][式(2)]对猝灭数据作进一步分析:
F0/(F0-F)=1/(faKa[Q])+1/fa
(2)
式中:(F0-F)为加入猝灭剂前后荧光强度的差值;fa为荧光基团可接近猝灭剂的部分(分数);Ka为有效猝灭常数,它近似于DCP-HSA相互作用的结合常数。
以F0/(F0-F)对1/[Q]作图,如图4所示,根据方程(2)算出4个温度下的有效猝灭常数,结果列于表2。

图4 4个不同温度下修正的Stern-Volmer曲线(pH=7.40)

表2 修正的Stern-Volmer方程的有效猝灭常数与DCP-HSA体系的相关热力学参数
比较表1和表2数据可知,Ka随温度的变化趋势与KSV一致,说明DCP与HSA的结合过程确实为生成复合物的静态猝灭过程。
2.2 DCP与HSA的结合模式
一般说来,小分子与生物大分子间的作用力主要包括疏水作用力、氢键、范德华力、静电引力等[10]。假如焓变(ΔH)在所研究的温度范围内变化不大,其值可近似为常数,于是熵变(ΔS)可由van′t Hoff方程[式(3)]求出:
lnK=-ΔHθ/RT+ΔSθ/R
(3)
式中:K为相应温度下的结合常数;R为气体常数。
以lnK对1/T作图(如图5所示),由斜率可求出焓变(ΔH),由截距可求出熵变(ΔS)。反应的自由能变ΔG由式(4)计算:
ΔGθ=ΔHθ-TΔSθ
(4)

图5 HSA与DCP相互作用的范特霍夫曲线
各热力学参数的计算结果列于表2。从表2可知,ΔGθ<0,说明该反应是自发过程。Ross等[11]从大量蛋白质和药物反应实验中总结出了热力学参数值与作用力类型间的联系:ΔH>0、ΔS>0为典型的疏水作用力;ΔH<0、ΔS<0为氢键和范德华力;ΔH<0、ΔS>0为静电引力。由焓变(-6.336 kJ·mol-1)和熵变(75.12 J·mol-1·K-1)的值可知,DCP与HSA分子间主要作用力为静电引力。
2.3 DCP在HSA上结合位置的确定
HSA分子中有三个相似的结构域,分别称为结构域Ⅰ、结构域Ⅱ、结构域Ⅲ,每个结构域又可分为A、B两个子域。其中结构子域ⅡA和ⅢA又被称作SiteⅠ和SiteⅡ,它们是大多数药物特异性的强结合位点[12]。在SiteⅠ结合的药物通常是电荷位于分子中央的环状结构的阴离子,在SiteⅡ结合的药物通常是电荷位于分子末端的链状分子,如脂肪酸等。DCP由于分子中存在较大的共轭体系,电荷分布在共轭体系的环上,故其结合在HSA上SiteⅠ位点的可能性较大。研究表明,华法林(Warfarin)常作为HSA上SiteⅠ的位点标记物[13]。进行了DCP与HSA-Warfarin相互作用的位点竞争实验,结果如图6所示。

T=298 K;λex=320 nm;c(HSA) = 2.0×10-6mol·L-1;c(Warfarin) =5.0×10-6mol·L-1;c(DCP) (×10-5mol·L-1),A~I:0,0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6
由图6可知,当激发波长为320 nm(华法林的最大吸收峰处的波长)时,Warfarin在390 nm附近有一个强的荧光发射峰,而DCP和HSA在390 nm附近的荧光强度几乎为零。当向Warfarin溶液中加入HSA溶液时,Warfarin的荧光强度急剧增强,且最大发射波长明显蓝移(曲线A)。随着DCP不断加入HSA-Warfarin混合溶液中,该体系的荧光强度逐渐降低且最大发射波长红移(曲线B~I)。这表明,随着DCP的加入,体系的荧光图谱逐渐向着只含有Warfarin时的荧光图谱靠近。即DCP取代了Warfarin在HSA上的结合位点,说明DCP在HSA上的结合位置为SiteⅠ。
2.4 DCP对HSA构象的影响
2.4.1 圆二色谱
DCP对HSA二级结构的影响可以用圆二色谱研究。测定室温条件下HSA和DCP-HSA体系的圆二色谱,并用MRE值来分析圆二色谱可以求出HSA中α-螺旋结构的含量,结果见图7。

c(HSA) = 2.0×10-6mol ·L-1;c(DCP)(×10-6mol·L-1),A~C:0,8.0,20.0
由图7可知,在209 nm和222 nm处出现了两个负的特征肩峰谱带,这是HSA中α-螺旋结构的特征峰[14]。游离态的HSA中,α-螺旋结构含量为58.85%,当HSA与DCP的浓度比达到1∶10时,α-螺旋结构含量降至54.24%,说明DCP与蛋白质多肽主链的氨基酸残基结合,破坏了蛋白质的氢键网,使HSA的二级结构有所伸展。虽然DCP的加入导致HSA两个负的肩峰带强度减小,但峰形和峰位并未改变,表明DCP虽对HSA的二级结构有一定的影响,但α-螺旋结构仍占主导地位。
2.4.2 三维荧光光谱
三维荧光光谱不仅可以全面展现待测样品的荧光信息,还可以用来研究蛋白质构象的变化。图8为HSA和DCP-HSA体系的三维荧光光谱,相关的特征参数列于表3。
图8中,峰a是瑞利散射峰(λex=λem)[15],加入DCP后其荧光强度有所增加,原因可能是DCP-HSA复合物的生成导致溶液中溶质的粒径增大,散射效应增强。峰b是二级散射峰(λem=2λex)。峰1(λex=285.0 nm,λem=349.0 nm)显示了色氨酸和酪氨酸残基的光谱行为,是研究荧光猝灭时的主荧光峰。峰2(λex=230.0 nm,λem=347.5 nm)是一个新的强荧光峰,它揭示了蛋白质多肽链结构的荧光特性,其荧光强度与蛋白质二级结构的变化密切相关[15]。
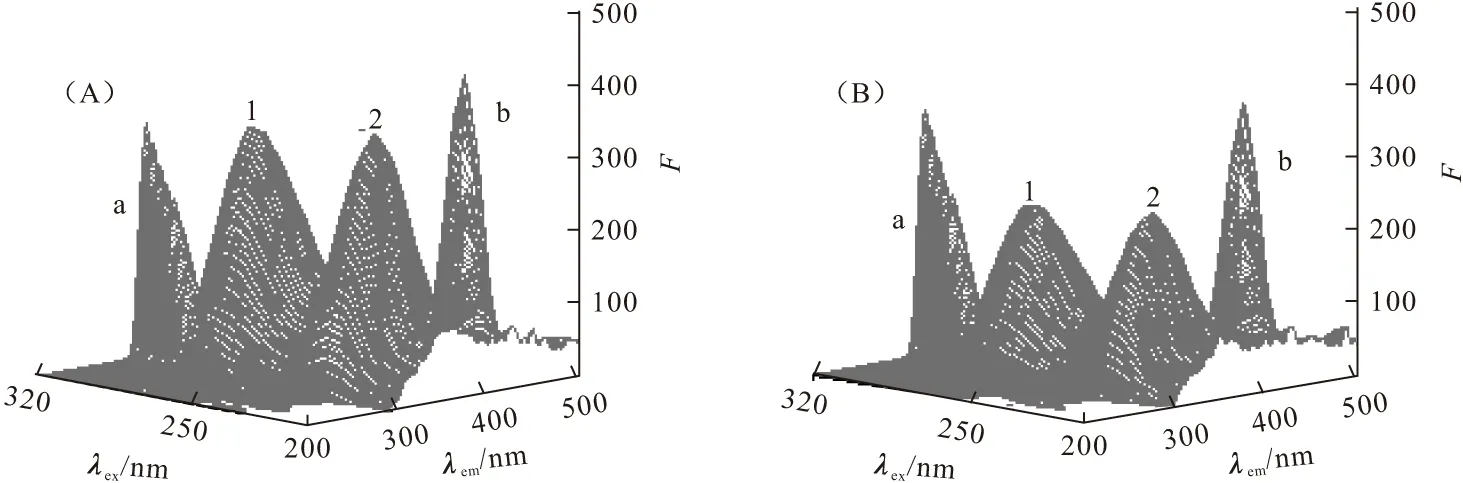
c(HSA) (×10-6mol·L-1),A:2.0,B:2.0;c(DCP) (×10-6mol·L-1),A:0,B:2.0

表3 HSA和DCP-HSA复合物的三维荧光光谱特征
从表3可以看出,加入DCP前后峰2的荧光强度发生了明显猝灭,表明加入DCP后,蛋白质的二级结构发生了很大改变,该结论与圆二色谱的分析结果相符。由此可以得出:DCP与HSA的相互作用使蛋白质的多肽链更加舒展,构象发生改变,以前包埋在圆筒内的疏水腔暴露出来,即DCP与HSA的相互作用使HSA的构象和微环境发生了改变。
3 结论
用一系列荧光方法对DCP与HSA相互作用进行了分析。由荧光光谱和紫外可见吸收光谱分析可知,该反应是形成复合物的静态猝灭过程。根据van′t Hoff方程求得的不同温度下的热力学参数推断出静电引力是维持DCP-HSA复合物稳定的主要作用力。ΔGθ<0,表明该反应能自发进行。此外,DCP在HSA的SiteⅠ位发生了较强的结合。圆二色谱和三维荧光光谱分析发现,加入DCP之后,HSA中α-螺旋结构的含量减少,肽链有所伸展,HSA的构象和所处微环境发生了变化。
[1] Sathishkumar M,Binupriya A R,Kavitha D,et al.Adsorption potential of maize cob carbon for 2,4-dichlorophenol removal from aqueous solutions:Equilibrium,kinetics and thermodynamics modeling[J].Chemical Engineering Journal,2009,147(2-3):265-271.
[2] Li N,Mei Z,Ding S G.2,4-Dichlorophenol sorption on cyclodextrin polymers[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2010,68(1-2):123-129.
[3] 严赞开,陈东丹.二氢杨梅素锌与牛血清白蛋白的相互作用[J].化学与生物工程,2010,27(3):60-62.
[4] Zhang Y Z,Dai J,Xiang X,et al.Studies on the interaction between benzidine and bovine serum albumin by spectroscopic methods[J].Molecular Biology Reports,2010,37(3):1541-1549.
[5] Lu Z X,Cui T,Shi Q L.Applications of circular dichroism and optical rotatory dispersion[J].Molecular Biology,1987:79-82.
[6] 许金钩,王尊本.荧光分析法(第三版)[M].北京:科学出版社,2006:6-7.
[7] Lakowicz J R,Weber G.Quenching of fluorescence by oxygen.A probe for structural fluctuations in macromolecules[J].Biochemistry,1973,12(21):4161-4170.
[8] Eftink M R,Ghiron C A.Fluorescence quenching studies with proteins[J].Analytical Biochemistry,1981,114(2):199-227.
[9] Sherwin L S.Solute perturbation of protein fluorescence.The quenching of the tryptophyl fluorescence of model compounds and of lysozyme by iodide ion[J].Biochemistry,1971,10(17):3254-3263.
[10] Leckband D.Measuring the forces that control protein interactions[J].Annual Review of Biophysics and Biomolecular Structure,2000,29(1):1-26.
[11] Ross P D,Subramanian S.Thermodynamic of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[12] Kang J,Liu Y,Xie M X,et al.Interactions of human serum albumin with chlorogenic acid and ferulic acid[J].Biochimica et Biophysica Acta,2004,1674(2):205-214.
[13] He X M,Carter D C.Atomic structure and chemistry of human serum albumin[J].Nature,1992,358(6383):209-215.
[14] Liu J Q,Tian J N,Tian X,et al.Interaction of isofraxidin with human serum albumin[J].Bioorganic & Medicinal Chemistry,2004,12(2):469-474.
[15] Zhang Y Z,Zhou B,Liu Y X,et al.Fluorescence study on the interaction of bovine serum albumin withp-aminoazobenzene[J].Journal of Fluorescence,2008,18(1):109-118.
