植原体病害研究概况
2011-06-12牟海青朱水芳赵文军
牟海青, 朱水芳, 徐 霞, 赵文军*
(1.中国检验检疫科学研究院,北京 100029; 2.湖南农业大学生物安全科学技术学院,长沙 410128)
植原体与其他病原物相比发现较晚。1967年,日本科学家土居养二等首次在桑树萎缩病中发现植原体[1]。近半个世纪的时间,植原体病害被误认为病毒病害。近年来,世界各地植原体病害大量报道,例如在中国南方广泛分布的柑橘黄龙病一直以来被认为是由韧皮部杆菌(Ca.Liberibacter asiaticus)引起,直到2009年,蒲雪莲等在柑橘黄龙病植株中发现植原体与韧皮部杆菌同时存在[2]。由于植原体目前仍不能进行人工培养,因此对其致病性、病害流行性、病害防治等方面研究仍处于初级阶段。植原体病害对农林业生产造成了严重的损失,各国间种苗调运以及其他农产品贸易增加了病原传播的风险,在我国已经有14种植原体被列为入境检疫性有害生物。越来越多的植物细菌学与植物病毒学研究人员对植原体病害展开了研究。
1 植原体的病原学
植原体属于细菌界,无细胞壁,由3层膜包被,呈现多态型,一般有球形、椭圆形、长杆形、梭形、带状等。球状体的直径一般在60~1 100 nm,需要在电子显微镜下观察。植原体细胞质内有核糖体、螺旋丝状物、各种代谢物质、可溶性蛋白、rRNA及少量其他核糖核酸等,没有细胞核,遗传物质为dsDNA。对四环素类抗生素敏感,而对青霉素不敏感。植原体专性寄生于植物韧皮部,主要靠吸食植物韧皮部汁液的昆虫介体传播,如叶蝉、茶翅蝽、飞虱、蚜虫[3-5]等。此外,菟丝子、人工嫁接也能传播植原体。
2 植原体的分类进化与基因组学
植原体属于细菌界柔膜菌纲、非醇原体科、植原体候选属,是最小的细菌。从形态上来看,植原体不具有细胞壁,与动物菌原体十分相似,而非病毒;分析其16S rDNA同源性,植原体与非醇原体最为接近,而与动物菌原体差别较大,故推测植原体是由非醇原体进化而来[1]。
从进化上来看,植原体与菌原体、螺原体以及其他细菌关系较近。但植原体与螺原体、菌原体以及大肠杆菌在基因组以及合成代谢途径方面仍存在较大的差异,如表1、2。
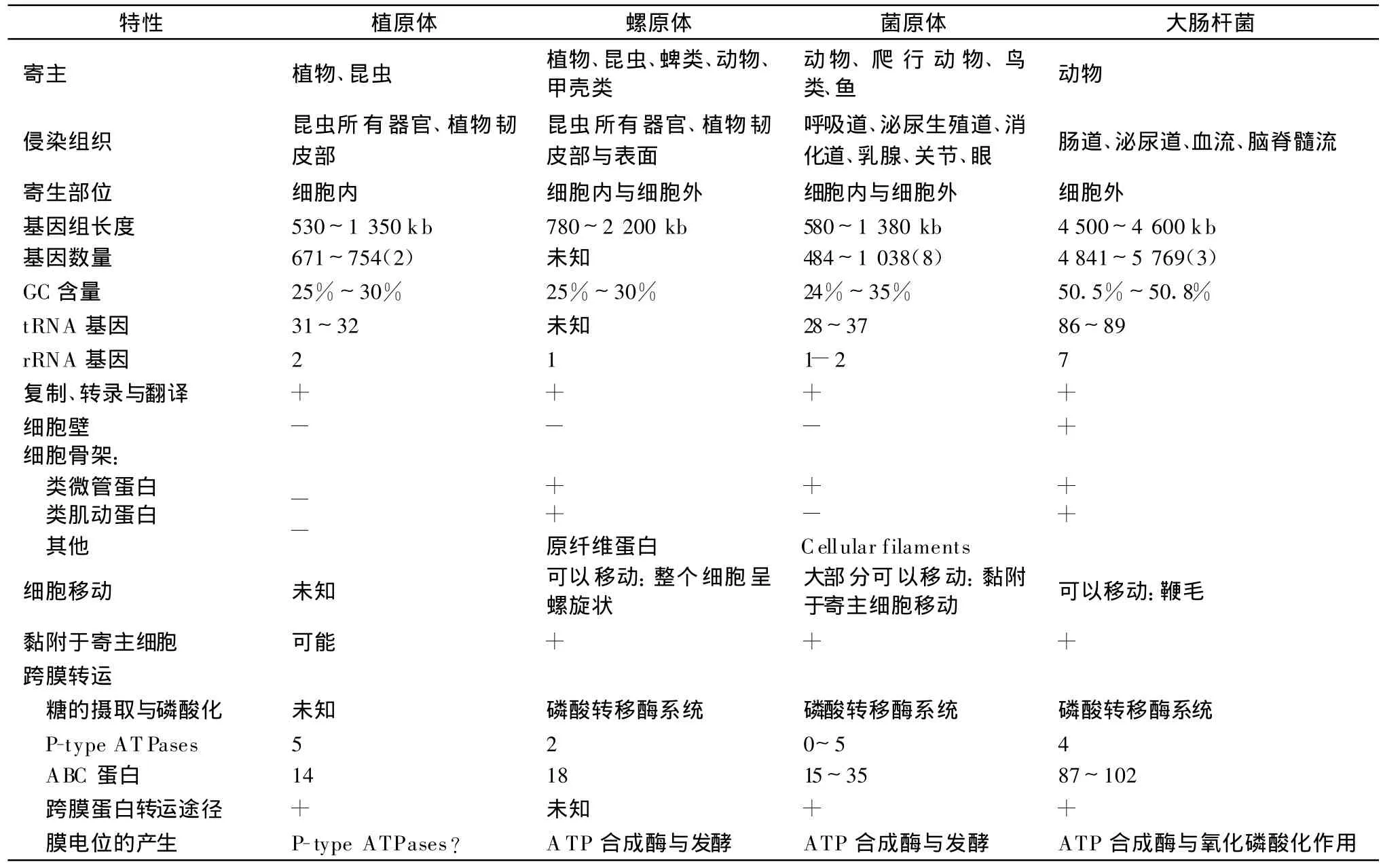
表1 植原体与其他细菌的基因组比较1)

表2 植原体与其他几种细菌代谢途径的比较1)
植原体与菌原体一样,基因组中缺乏一些与氨基酸合成、脂肪酸合成、三羧酸循环以及氧化磷酸化有关的基因。与菌原体不同的是:植原体缺乏磷酸转移酶系统以及从 UDP-半乳糖到1-磷酸葡萄糖的代谢过程。这说明植原体具有一种特殊的糖吸收与代谢系统。由于植原体生活在富含营养的寄主的细胞质中,所以可能会发生退化——丢失许多菌原体含有的基因,或者植原体根本就没有这些基因,靠吸收寄主的代谢产物而非自身合成。植原体含有编码蔗糖磷酸化酶类的基因,但是不完整,没有功能。推测由于在昆虫体中含有的蔗糖非常少,不需要此基因的表达,因此在进化过程中丢失了此基因功能。尽管植原体缺乏代谢基因,但植原体有27个基因参与转运系统,例如:苹果酸酯、金属离子与氨基酸转运体,其中有一些基因是多拷贝的。这说明了植原体能够转运寄主的一些代谢产物。植原体在侵染过程中吸收寄主的代谢产物,打破了寄主的代谢平衡,从而引起一系列的症状表现。除了与转运有关的基因,植原体中还有另外一些多拷贝基因,例如:uvrD 、h f lB 、tmk、daM与 ssb(占整个基因组的18%),这些基因在其他细菌中是单拷贝的。这可能就是植原体虽然缺失一些代谢基因,但是其基因组要比另一些病原物的还要大的原因。植原体中缺乏大部分的核苷酸合成相关基因,推测植原体不能合成核苷酸而是从其寄主中吸收。植原体基因组编码叶酸合成的有关基因,这有利于植原体的自身调节从而适应不同的植物或昆虫环境。有趣的是,在植原体基因组中没有有关A TP合成的基因,植原体是第1个被发现的缺乏ATP合成基因的微生物。推测植原体是用一种未知的机制来吸收寄主的ATP,或者植原体所利用的ATP主要是依赖于糖酵解途径合成。细菌中,戊糖磷酸途径是相对保守的,使细胞合成NADPH并获得还原能力,提供用来合成核苷酸的5-磷酸核糖。但是在植原体的基因组中却没有参与此途径的基因存在[6]。
分析已测得的植原体基因组,与洋葱黄化植原体M株系(OY-M)基因组进行比较,发现翠菊黄化丛枝植原体(AYWB)含有相对较小的重复序列的基因组。基因组中重复的部分大都成簇分布并能在基因组中移动(potential mobile units,PMU),这些PMU是植原体特有的。与动物菌原体不同,植原体缺乏DNA重组及修饰功能,而PMU可能会起到这种重组作用[7]。
由于不能进行人工培养,植原体的分类与其他细菌有所不同,主要依靠16S rDNA序列、tu f基因序列、rp基因序列以及secY基因序列的同源性进行植原体候选属内的组与亚组的分类[8-11]。2007年,Wei等利用软件分析已知植原体16S rDNA序列,通过RFLP分析,将已报道的植原体分为28个组,100个亚组。并且建议,当植原体 16S rDNA的RFLP相似系数小于0.85时,可以归为一个新的组[12],当植原体16S rDNA的RFLP相似系数小于或等于0.97时,可以归为一个新的亚组[13]。目前,已有26个植原体候选种正式发表,另外有7个植原体候选种的名字已经广泛引用,但仍未正式描述该植原体的有关信息[14]。IRPCM(2004)植原体/螺原体工作小组规定:植原体16S rRNA基因序列与已知命名的候选种的同源性小于97.5%则可以定为一个新的候选种;此外,当传播介体、天然寄主以及在分子生物学上有明显差异的植原体也可以定位一个新的候选种[15]。
植原体由非醇原体进化而来,单细胞,较小。植原体的基因组比其他细菌小得多,约500~1 000 kb,基因组富含AT,能够寄生于植物与昆虫两大生物界。植原体基因组有一个很重要的特征,基因多聚集于序列可变区(sequence-variablemosaics,SVMs),这是由来自噬菌体的可动遗传因子周期性攻击并发生重组的结果。植原体SVMs中存在原噬菌体基因组的残余,推测噬菌体对于植原体的进化起了重要作用[16]。目前已有4种植原体的基因组全序列公布,包括洋葱黄化植原体(onion yellow s phytoplasma strain M,OY-M)、翠菊黄化植原体(aster yellow s phytoplasma strain witches’broom,AY-WB)、苹果丛生植原体(Candidatus Phy toplasmamali strain AT)、澳大利亚植原体候选种(Candidatus Phytop lasmaaustraliense)。其基因组特征如表3。
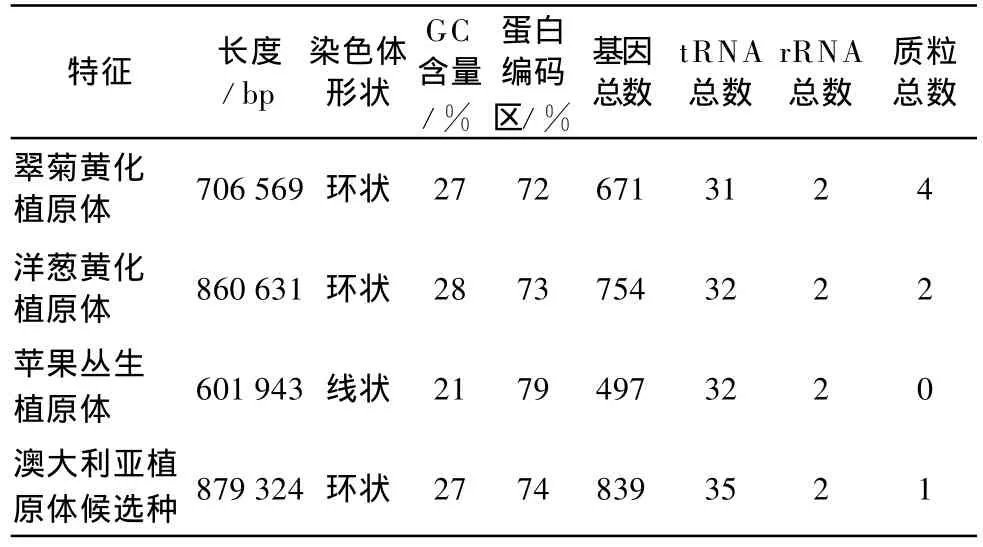
表3 4种植原体的基因组特征比较
3 植原体的危害与致病机理
植原体病害主要引起植物丛枝、黄化、绿变、花变叶、矮缩等症状,造成植株果实小、不结果,严重时可以引起植株枯死[3]。国际上已经报道的植原体病害千余种,我国报道的相关植原体病害有百余种,危害严重的主要有枣疯病、泡桐丛枝病和桑萎缩病等,受植原体侵染后木材与果实的产量、质量明显下降,长期以来给经济作物造成了巨大的危害。植原体病害在世界范围内越来越严重地危害着各国的经济作物,尤其是在葡萄、苹果、桃、梨、杏、马铃薯等等水果或粮食作物上引发的病害,严重影响了各国之间的经济贸易。因此,随着新的植原体病害的不断报道,各国也加强了对于植原体病害传入本国的预警与防范。2006年,加拿大食品检疫局(CFIA)启动了针对葡萄黄化植原体的调查行动。同年10月20日,证实在大不列颠哥伦比亚省的葡萄园中发生葡萄黄化植原体(Boisnoir phytop lasMa)。据调查,此染病葡萄种苗为2006年从法国进口,共约2000株[17]。2007年在安大略省的调查结果表明,2株来自法国的葡萄植株受到葡萄黄化植原体侵染,导致Bois noir病害[18]。葡萄黄化病严重影响了酿造葡萄酒的产量与质量,是一种葡萄园毁灭性病害。
与病毒相比,植原体基因组较大,因此分析植原体的致病机理难度较大。经高效液相色谱(HPLC)测定,受16Sr-B亚组植原体侵染后除虫菊组培苗中的除虫菊酯含量明显下降[19]。目前,多数专家认为植原体的侵染干扰了植物的激素水平、碳水化合物的替代途径、光合作用等,导致了症状的发生。受白蜡树黄化植原体侵染后,长春花叶片光合作用中最大羧化率与非环式电子传递均受到抑制[20]。受植原体侵染后的葡萄叶片中光合色素、可溶性蛋白、核酮糖-1,5-二磷酸羧化酶以及光合作用均受到抑制,光合系统Ⅱ(PSⅡ)受到严重影响,而光合系统I(PSⅠ)略受影响[21]。受植原体侵染后长春花叶片中苯基丙酸类合成途径与萜类吲哚生物碱途径大大增加,同时蔗糖、葡萄糖、绿原酸、开链马钱子甙(secologanin)等含量显著增加。推测植原体侵染后植物叶片失绿很可能是由糖类的积累造成,因为糖类的积累可以抑制光合作用相关基因的表达[22]。通过分析转录组的差异,Boisnoir植原体侵染葡萄后,碳水化合物代谢途径相关基因的表达明显上调,而光合作用相关基因的表达受到抑制,与激素合成、代谢、调控有关的基因表达也发生了明显的变化[23]。HPLC分析发病与健康泡桐内源激素和酚类物质含量,发现病株游离IAA含量明显低于健康植株,并且IAA含量与邻苯二酚含量呈显著的正相关。而细胞分裂素(Z+ZR,iPA)、赤霉素(GA3)和脱落酸(ABA)含量变化不明显[24]。
由于植原体不能进行人工培养,基因组编码几百个基因,因此找出致病基因不是一项容易的工作。多数革兰氏阴性细菌是通过TTSS分泌系统分泌毒性因子改变植物的正常生理系统、降低植物的免疫力。植原体基因组中缺乏TTSS分泌系统相关基因,但可以通过Sec转运系统将细胞内的蛋白运输出植原体细胞外。分泌到植物细胞质中的植原体蛋白很有可能是引起植物发病的致病因子。Hoshi等分析洋葱黄化植原体基因组,并在本生烟与拟南芥中表达分泌蛋白,发现 TENGU蛋白是洋葱黄化植原体引起植物丛枝与矮缩的一个致病因子[25]。TENGU是一个较小的蛋白,成熟的 TENGU蛋白仅有38个氨基酸,不仅存在植物的韧皮部,而且能够分布到植物的其他细胞中。TENGU蛋白能够引起植物中生长素有关基因表达下调,推测通过抑制生长素信号与生长素合成致使植物表现丛枝与矮缩的症状[25]。
此外,有文献报道,受植原体侵染后,葡萄、榆树等植株中的内生菌群落发生了明显的变化[26-27]。
4 植原体病害的防控
抗生素类药物是目前治疗植原体病害最常用的药物。植原体细胞无细胞壁,仅由3层膜包被,对青霉素等抗生素不敏感,但能被四环素族抗生素所抑制,如金霉素、土霉素和脱甲基氯四环素[3]。生长素类物质3-吲哚丁酸(IBA)与IAA加入培养基中,可以使发病长春花症状消失,且IBA的作用效果较好。IBA与IAA能够去除发病长春花组培苗中的HYDB植原体,但不能完全去除长春花组培苗的EY-C与SA-I植原体[28-29]。在利用转基因工程技术防治植原体病害方面,将抗菌肽shiva-1基因转入泡桐后,泡桐表现明显的抗丛枝病性状[30]。植原体病害主要靠昆虫介体、人工嫁接、菟丝子等途径传播,因此通过阻断传播途径也是一种很好的防治途径。
近年来,受植原体侵染植株表现症状后一段时间症状又消失的现象引起了研究人员的兴趣。2004-2006年,在弗留利-威尼斯-朱利亚地区的19个葡萄园中发现有葡萄黄化症状恢复现象。第1年恢复50%,第2年恢复70%,第3年基本上全部恢复[31]。在苹果丛生病中同样存在发病植株恢复健康的现象,并且苹果树冠未检测到植原体,仅在根部能检测到植原体存在。通过比较健康、发病、恢复的苹果植株中过氧化氢(H 2O2)、过氧化氢酶、还原型谷胱甘肽等含量的变化,恢复健康的植株中过氧化氢、还原型谷胱甘肽含量较高,过氧化氢酶含量较低。说明在恢复健康的植株中氧化剂清除系统活性降低,引起过氧化氢的积累,过多的过氧化氢可以与病原物的毒性因子发生作用[32]。
随着对植原体的研究增多,越来越多的由植原体引起的重要农作物病害被报道,并且研究工作也不断深入,包括基因组测序致病性机理研究等,对植原体引起的寄主植物病变与症状的表现机理有了初步认识。植原体引起植物发病症状的原因可以归为:引起激素的紊乱、与寄主植物碳水化合物代谢途径的互作、抑制寄主防卫系统活性、分泌毒性因子等。对于植原体病害的防治,除四环素类抗生素及IBA等生长素类物质的应用有较明显效果外,目前仍未发现经济、高效、环保的药物。
有关发病苹果与葡萄植株恢复健康的现象,推测内生菌起了关键作用;已发现榆树、葡萄等感病植株与抗病植株在内生菌群落上有较大差异。通过研究,植物内生菌落的差异会给今后的植原体病害防治与控制提供启发与依据。
[1]Doi Y M,Terand ka M,Yora Kand Asuyama H.Mycoplasma or PTL-group-like Microo rganisMs found in the phloeMelements of plants infected with Mulberry dwarf,potato witchesb room,aster yellow s or pau low nia w itches-broom[J].Ann Phytopathol Soc Jpn,1967,33:259-266.
[2]蒲雪莲,郭恒,蔡玲玲,等.与柑橘黄龙病症状类型相关的两类细菌的研究[C]∥中国植物病理学会 2009年学术年会论文集,2009:280.
[3]刘仲健,罗焕亮,张竟宁.植原体病理学[M].北京:中国林业出版社,1999:34-40.
[4]孙志强,傅建敏,乔杰,等.茶翅蝽对植原体的传播能力[J].林业科学研究,1999,12(6):606-611.
[5]林彩丽.泡桐丛枝病植原体质粒分子特征及其编码蛋白功能研究[D].北京:中国农业大学,2008:2-3.
[6]Oshima K,Kakizawa S,Nishigawa H,et al.Reductive evolution suggested fromthe coMplete genome sequence of a plantpathogenic phytoplasma[J].Natu re Genetics,2004,136:27-29.
[7]Bai X,Zhang J,Ew ing A,et al.Living with genome instability:the adaptation of phy toplasMas to diverse environments of their insect and plant hosts[J].Jou rnal of Bacteriology,2006,188:3682-3696.
[8]Gundersen D E,Lee I-M,Rehner S A,et al.Phylogeny of mycoplasmalike organisms(phytop lasmas):a basis for their classification[J].Jou rnal of Bacteriology,1994,176(17):5244-5254.
[9]Marcone C,Lee I-M,Davis R E,et al.Classification of aster yellow s-group phy toplasmas based on coMbined analyses of rRNA and tu f gene sequences[J].In ternational Journal of Sy stematic and Evolu tionary Microbiology, 2000, 50:1703-1713.
[10]Lee I-M,Gundersen-Rindal D E,Davis R E,et al.Revised classification scheme of phytoplasmas based on RFLP analyses of 16s rRNA and ribosomal protein gene sequen ces[J].International Jou rnal of Systematic Bacteriology, 1998,48:1153-1169.
[11]Lee I-M,Bottner-Parker K D,Zhao Y,Phylogenetic analysisand delineation of phytoplasmas based on the secY gene[J/OL].International Journal of Systematic and Evolutionary Microbiology,2010,10.1099/ijs.0.019695-0.
[12]W eiW,Davis R E,Lee I-M,etal.CoMputer-simu lated RFLP analysis of 16S rRNA genes:iden tification of ten new phy toplasma groups[J].International Jou rnal of Sy stematic and Evolutionary Microbiology,2007,57:1855-1867.
[13]W eiW,Lee I-M,Davis RE,et al.Au tomated RFLP pattern comparison and siMilarity coefficient calculation for rapid delineation of new and distinct phy toplasma 16Sr subgroup lineages[J].International Jou rnal of Systematic and Evolu tionary Microbiology,2008,58:2368-2377.
[14]In ternational comMittee on systematics of prokaryotes,subcommittee on the taxonomy ofMollicutes[C]∥Minutes of the meetings,July 2008,Tianjin,PR China,Int JSyst Evol Microbiol,2008,58:2987-2990.
[15]赖帆,李永,徐启聪,等.植原体的最新分类研究动态[J].微生物学通报,2008,35(2):291-295.
[16]W eiW,Davis R E,Jomantiene R,et al.Ancien t,recu rren t phage attacks and recombination shaped dynaMic sequence-variab lemosaicsat the root of phytoplasma genome evolution[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(33):11827-11832.
[17]NAPPO.Boisnoir phytoplasma detected in iMported g rapevine in British Columbia,Canada[EB/OL].[2006-11-24].h ttp:∥www.pestalert.org/oprDetail.cfm?oprID=242.
[18]NAPPO.Boisnoir phytop lasma infected plants found in On tario,Canada[EB/OL].[2007-12-21].h ttp:∥www.pestalert.org/oprDetail.cfm?oprID=303.
[19]Amb rozic-Dolinsek J,CaMloh M,et al.Phy toplasMa infection may affectMorphology,regeneration and pyrethrin content in pyrethruMshoot cu lture[J].Scientia Horticu lturae,2008,116:213-218.
[20]Yok Tan P,W hitlow T.Physiological responsesof Ca tharanthus roseus(periw ink le)to ash yellow s phytoplasmal infection[J].New Phy toplogist,2001,150:757-769.
[21]BertaMini M,Nedunchezhian N,Tomasi F,et al.Phy toplasma[Stolbur-subgroup(Bois Noir-BN)]infection inhibits photosyn thetic pigmen ts,ribu lose-1,5-bisphosphate carboxy lase and photosyn thetic activities in field grow n grapevine leaves[J].Physiological and Molecular Plant Pathology,2002,61:357-366.
[22]Choi Y,Tapias E,K iMH,et al.Metabolic discriMination of Catharan thus roseus leaves infected by phytoplasma using HNMR spectroscopy and multivariate data analysis[J].Plan t Physiology,2004,135:2398-2410.
[23]Hren M,Nikolic P,Rotter A,et al.‘Bois noir’phytoplasma indu cessignifican t reprogramMing of the leaf transcriptoMe in the field g row n grapevine[J].BMCGenoMics,2009,10:460.
[24]田国忠,黄钦才,袁巧平,等.感染MLO泡桐组培苗代谢变化与致病机理的关系[J].中国科学B辑,1994,24(5):84-90.
[25]H oshi A,Oshima K,Kakizaw a S,et al.A unique viru len ce factor for proliferation and dw arfisMin plants identified froma phy topathogenic bacterium[J].PNAS,2009,106(15):6416-6421.
[26]Marzorati M,A lma A,Sacchi L,et al.A novel bacteroidetes symbiont is localized in Scaphoideus titanus,the insect vector of flavescence doree in Vitis vinifera[J].App lied and Environmental Microbiology,2006,72(2):1467-1475.
[27]Mengoni A,Mocali S,Su rico G,et al.Fluctuation of endophytic bacteria and phytoplasmosis in elMtrees[J].Microbiological Research,2003,158:363-369.
[28]Perica CM,Lepedus H,Music MS.Effect of indole-3-butyric acid on phytoplasmas in infected Catha ranthus roseus shoots grow n in vitro[J].FEMS Microbiol Lett,2007,268:171-177.
[29]Perica CM.Auxin-treatmen t induces recovery of phytoplasmainfected periw ink le[J].Jou rnal of App lied Microbiology,2008,105(6):1365-2672.
[30]Du T,Wang Y,Hu Q X,et al.T ransgenic paulow nia expressing shiva-1 gene has increased resistance to paulownia Witches’b rooMdisease[J].Journal of Integrative Plan t Biology,2005,47(12):1500-1506.
[31]Bellomo C,Carraro L,E rmacora P,et al.Recovery phenomena in grapevinesaffected by grapevine yellow s in Friu liVenezia Giulia[J].Bu lletin of Insectology,2007,60(2):235-236.
[32]Musetti R,Sanita di Toppi L,Ermacora P,et al.Recovery in apple trees infected with the apple proliferation phy toplasMa:an u ltrastru cturaland biocheMical study[J].Phytopathology,2004,94(2):203-208.
