玉米灰斑病研究方法:Ⅰ.玉米灰斑病菌孢子的培养
2011-06-12赵正龙吴兴兴毛自朝何月秋
赵正龙, 吴兴兴, 毛自朝, 何月秋,*
(1.云南农业大学农业生物多样性应用技术国家工程研究中心,昆明 650201;2.云南农业大学农学与生物技术学院,昆明 650201)
玉米灰斑病(maize gray leaf spot)也称玉米尾孢叶斑病,是由Cercospora zeae-mayd is Tehon&Daniels引起的重要病害[1]。该病以发病早、传播和蔓延速度快、危害重、损失大为特点,特别是在玉米成株期暴发流行,重病地块大部分玉米叶片灰色枯焦,果穗下垂,籽粒松脱干瘪,百粒重下降,严重影响产量和品质。玉米发病后一般田块损失5%~30%,严重田块达60%以上,甚至绝收[2-3]。该病主要发生在玉米生长中后期,且常与雨季相吻合,加上植株密集、高大,发病后难以施药。品种抗病性存在差异是抗病育种的基础[4-6],然而,该病菌生长速度慢,难于分离,在人工培养条件下不易产孢[7-8],给抗病育种中的接种鉴定带来了困难。为了加速病菌孢子的培养,本文在他人研究的基础上开展了产孢条件的研究。
1 材料和方法
1.1 病菌的分离
病叶标本采自云南省峨山县双江镇宝山村,在实验室采用单孢分离法分离病菌。即在酒精灯上,将直径1mm毛细管前端部烧成圆球(取孢器),用取孢器于病斑上蘸取分生孢子,在XTS-20体视显微镜下,将孢子涂抹于加有氯霉素的4%水琼脂平板培养基上,以50倍视野下1~5个孢子为宜,再将平板培养基置于25℃的恒温培养箱内培养8 h。取出平板后,置于体视显微镜下,挑取单个萌发的孢子,并置于加有氯霉素马铃薯蔗糖琼脂(PSA)斜面培养基上,于25℃培养、备用。
1.2 培养基和菌丝生长速度的测定
试验共有PSA,燕麦番茄碳酸钙琼脂(燕麦粉15 g,番茄 200 g,碳酸钙 1 g,琼脂粉 12 g,水1 000ML,pH6.8。下称OTCA),玉米叶粉碳酸钙琼脂(玉米叶粉15 g,碳酸钙1.5 g,琼脂粉12 g,水1 000 ML。下称MLPCA),燕麦粉琼脂(燕麦粉20 g,琼脂粉12 g,水 1 000ML。下称OA),粗面粉琼脂(粗面粉 20 g,琼脂粉 12 g,水1 000 ML。下称CWPA)5种固体培养基和马铃薯汁蔗糖(PS)液体培养基。每个培养皿(直径90mm)加入40 ML固体培养基,每皿均等地接种3个直径7 mm的菌块,于25℃下培养33 d。自接种后第3天开始测量菌落直径,以后每隔1 d测一次,连续测16次。PS培养基用于菌丝体片段悬液的培养。
1.3 病菌孢子培养
1.3.1 菌丝片段悬液制备
在250 ML的三角瓶中加入100 ML PS培养基,10~20粒直径5 mm玻璃珠,灭菌冷却后,在超净工作台上,接种直径为2mm左右的灰斑病菌菌丝块。在25℃,180 r/min条件下振荡培养15 d,此时三角瓶中的菌丝已成悬浮液,取出置于4℃冰箱中保存、备用。
1.3.2 光照对病菌产孢的影响
在MLPCA平板上,加入0.2 ML菌丝悬浮液,用无菌曲玻棒涂布均匀,分别放入温度为25℃的RXZ型智能人工气候箱中全光照(12000lx)、光照(12000lx)与黑暗各12 h,以及隔水式303-4S恒温箱中培养。第12天和第14天测量产孢量,每次各处理测量3皿。测量方法:取10 ML灭菌自来水洗下培养皿中孢子,制成孢子悬浮液;用上海市求精生化试剂仪器有限公司生产的25×16规格的血球计数板在显微镜下计量孢子数。
1.3.3 培养基对病菌产孢量的影响
吸取0.2 ML菌丝悬浮液均匀地涂布于PSA、OTCA、MLPCA、OTCA和CWPA平板培养基上,放入25℃恒温箱中黑暗培养。第3天开始,在显微镜下,隔1 d测培养基孢子量1次,连续测16次,测量方法同1.3.2。
2 结果与分析
2.1 病菌在不同培养基上的生长速度
玉米灰斑病菌菌落在供试的5种固体培养基上生长速度均非常缓慢,菌落直径每天增长量在0.33 mm左右(图1)。其中以在OA(0.38 mm/d)和PSA(0.37 mm/d)上生长速度较快,在CWPA(0.32 mm/d)和OTCA(0.30 mm/d)上生长速度居中,以在 MLPCA培养基上生长速度最慢,仅0.28 mm/d。采用0.2ML菌丝悬浮液涂平板的方法培养时,大量菌丝段分散形成的菌落在第8天于5种培养基上都能长满直径90 mm的培养皿。在5种培养基上,菌落颜色有所不同。在OTCA培养基上,菌落颜色最深,为灰绿色,其次,按 PSA、CWPA、OA、MLPCA的顺序,菌落的颜色逐渐变浅,在MLPCA上菌落颜色为灰白色。气生菌丝在OA上生长最好、最致密,其次是 PSA、OTCA 、MLPCA,CWPA上的菌丝短且稀疏。在PSA和OTCA上,单个菌落独立地形成坚硬小突起,里面含有大量的水分。
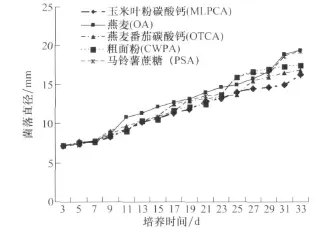
图1 不同培养基上玉米灰斑病菌菌落直径
2.2 不同光照时间对病菌产孢量的影响
在不同光照条件下,用菌丝悬液在MLPCA上涂平板的方法,检查产孢量。结果表明,在培养第12天和第14天调查,全光照处理的灰斑病菌菌落完全不产孢,只形成较多灰白色的气生菌丝。在全黑暗条件下培养12 d和14 d后,每个培养皿平均分别产生1.1×107和8.2×106孢子。在12 h光照条件下,气生菌丝多于完全黑暗条件下的菌丝,每皿分别产生4.8×106和4.0×106孢子。
2.3 玉米灰斑病菌在不同培养基上的产孢情况
采用菌丝悬浮液涂平板法,在 OTCA、PSA、CWPA、OA、MLPCA上检测灰斑病菌产孢情况,自接种后的第3天开始,隔天检测产孢数。结果表明,不同培养基上产生的孢子量存在显著差异,PSA在培养9 d时,出现产孢高峰,但与其他处理相比,孢子量少,仅 1.89×105个/皿;MLPCA在 13 d出现产孢高峰,孢子量达到77.78×105个/皿,是 PSA培养基产孢量的41倍,差异达极显著水平。MLPCA培养基在第13天产生的孢子量也极显著地高于OA培养基的第 25天的孢子量(24.07×105个/皿)。在CWPA培养基上,孢子产生的高峰期在第23天才出现,产孢量(85.65×105个/皿)才与MLPCA上孢子量相当。与上述4种培养基相比,OTCA上产孢高峰日出现时间更晚,需要27 d,其孢子量(75.00×105个/皿)才与MLPCA 的第13天相当。从连续观察的结果(图2)来看,各培养基均是在最大产孢量后,培养基上的菌丝逐渐增多,孢子量迅速下降。这可能与大量孢子萌发,而培养基中的营养逐渐消耗殆尽有关。
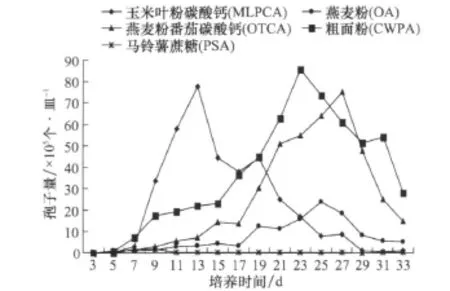
图2 不同培养基上玉米灰斑病菌的产孢量
3 讨论
玉米灰斑病菌在培养基上生长非常缓慢。由于生长慢,产孢所需时间长,在培养过程中易发生污染,影响对病原菌的生物学、玉米抗性鉴定等研究。为了克服灰斑病菌生长慢的缺点,研究者们常采用增加接种体的方法来提高工作效率。如孢子悬液涂抹平板的方法,缩短培养时间,Beckman等[8]采用长有菌落的琼脂块捣碎后,涂在玉米叶煎汁碳酸钙平板和V 8碳酸钙培养基上,置于25℃的恒温箱中,光照和黑暗各12 h培养14 d后,两种培养基分别可得到孢子 1.83×105个/皿和2.36×105个/皿。佟淑杰等[9]和徐秀德等[10]采用在培养基上继代的分生孢子涂布平板的方法,于25℃下培养5 d,每皿可获孢子高达1.36×109。然而,上述两种方法对无菌操作要求严格,否则培养基易于污染。此外,采用高粱粒培养灰斑病菌也是一种常用方法[9],但病菌在高粱粒上不产生分生孢子[9,11],不能开展喷雾接种,接种时只能将带菌的高粱粒直接施入玉米心叶中,而因灰斑病菌的潜育期较长,从建立侵入关系到病斑形成大量孢子需13 d左右,也就是从心叶上病斑产生孢子再侵染,往往需要较长时间,且发病不够均匀,从而给玉米抗性鉴定带来困难。洗脱田间病叶上的孢子也可以直接用于接种,但不能做病菌生理分化研究。本研究采用接种菌丝块于马铃薯汁蔗糖培养基(PS),加入少量氯霉素和小玻璃珠,振荡培养。一方面在培养过程中可以直接观察液体培养基中的细菌污染情况;另一方面加入了抗菌素可以最大限度地避免细菌污染,培养好的菌体悬液可置于冰箱中保存1年以上,可以随要随取,按本研究每9 cm直径培养皿接种200μL菌丝碎片悬液,培养100 ML菌悬液,便可以接种500个培养皿;第三是加入了玻璃珠后,可以打断生长中的菌丝体,便于形成更多的生长点和易于用移液器取出与涂抹。实际上,在180 r/min转速下,250 ML三角瓶中加入100 ML液体培养基,15 d左右便可以培养出粥样浓稠的菌丝体片段悬液。如果以上述悬液继代培养,则培养这种悬液的时间可以缩短至8 d左右。因此,本研究采用先培养菌丝体片悬液,再以悬液涂布固体培养基的二级分段培养法,可以明显提高玉米灰斑病菌培养效率。这种方法不仅可用于玉米灰斑病菌的孢子培养,而且还可以适用于其他在人工培养基上生长慢的真菌。
玉米灰斑病菌的产孢速度和孢子产生量与光照条件、培养基类型及接种体用量有关。连续光照不利于孢子的形成,而有利于气生菌丝生长,连续黑暗培养有利于孢子产生。应用玉米叶粉碳酸钙培养基[10]所需时间短,成本低,产生孢子量大。燕麦番茄汁碳酸钙培养基的营养丰富,与燕麦培养基相比,推迟了产孢高峰期出现,但孢子量几近是后者的3倍。常用于真菌培养的PSA,尽管有利于菌丝生长,但其产孢量较少,不适用于产孢培养基,这一结果与Beckman等[8]报道的PDA相似。然而,它适用于二级分段培养法中的菌丝培养阶段,且成本低。本研究的结果是在9 cm直径培养皿中加入200μL第1阶段培养的菌丝碎片悬液条件下取得的,如果适当增加接种体的数量,从涂板到产孢的时间是否还将缩短有待于进一步研究。
本研究中所得到的产孢量与BeckMan等[8]和Brunelli等[12]相似,即每9 cm直径的培养皿可产生百万级的孢子,与佟淑杰等[9]的十亿级的孢子相差1 000倍,这可能与各实验室培养条件不一致有关。
[1]Tehon L R,Daniels E.Notes on parasitic fungiof Illinois[J].My cologia,1925,17:240-249.
[2]涂永海,沙本才,何月秋.凤庆县玉米灰斑病发生规律初步研究[J].云南农业大学学报,2007,22(4):604-607.
[3]李富华,吴炯波,王玉涛.玉米灰斑病的研究现状、问题与展望[J].玉米科学,2005,13(3):117-121.
[4]马荣,吴景芝,吴毅歆,等.云南省区试玉米新品种对4种叶斑病的抗性鉴定[J].种子,2009,28(3):64-67.
[5]Gordon SG,Bartsch M,Matthies I,et al.Linkage ofmolecularMarkers to Cercospora zeae-mayd is resistance inmaize[J].C rop Science,2004,44:628-636.
[6]Derera J,Tongoona P,Pixley K V,et al.Gene action controlling gray leaf spot resistance in sou thern A frican maize germplasm[J].Crop Science,2008,48:93-98.
[7]王桂清,陈捷.玉米灰斑病菌致病性分化的寄主鉴定方法[J].沈阳农业大学学报,2005,36(4):432-436.
[8]Beckman PM,Payne G A.Cultu ral techniquesand conditions influencing grow th and sporulation of Cercospora zeae-may dis and lesion developmen t in corn[J].Phytopathology,1983,73(2):286-289.
[9]佟淑杰,徐秀德,董怀玉,等.玉米灰斑病菌产孢特性的初步研究[J].杂粮作物,2005,25(3):201-203.
[10]徐秀德,董怀玉,姜钰,等.玉米灰斑病抗性鉴定技术[J].植物保护学报,2003,30(2):129-132.
[11]王桂清,陈捷.玉米灰斑病菌人工接种方法[J].玉米科学,2006,14(6):148-150.
[12]BrunelliK R,Fazza A C,A thayde Sobrinho C,etal.Efeito do meio de cultu rae do regime de luzna esporulacao de Cercospora zeae-mayd is[J].Summa Phytopathologica,2006,32(1):92-94.
