转TaLEA基因小黑杨抗寒株系的筛选1)
2011-05-31刘梦然黄海娇穆怀志李志新刘桂丰
王 遂 刘梦然 黄海娇 穆怀志 李志新 刘桂丰
(林木遗传育种与生物技术教育部重点实验室(东北林业大学),哈尔滨,150040)
晚期胚胎发育丰富蛋白(Late-embryogenesis-abundant protein,简称LEA蛋白),是植物胚胎发育后期种子中大量积累的一系列小分子特异多肽,且可以被低温、渗透胁迫、外源脱落酸(ABA)等因素诱导。LEA蛋白被认为是在非生物胁迫过程中对植物起保护作用的物质之一,具有稳定细胞膜等作用[1]。由于LEA蛋白对植物的重要作用,受到广泛关注,人们纷纷克隆该基因并进行植物转基因研究[2]。大量研究证明,外源LEA基因的转入,在一定程度上提高了转基因植株的抗旱、耐盐碱、抗寒等抗逆性,LEA蛋白现已成为逆境生理学研究的一个热点[3]。2004年,林木遗传育种与生物技术教育部重点实验室(东北林业大学)采用农杆菌介导法获得了转TaLEA基因小黑杨(Poplus simonii×P.nigra);后续的系列研究表明,这些转基因株系抗旱、耐盐性均有不同程度的提高[2],在此基础上,笔者对转TaLEA小黑杨进行了低温胁迫试验,拟通过抗氧化酶类活性的变化、冷害情况、相对高生长以及叶绿素质量分数等指标,评价转基因小黑杨抗寒能力,筛选耐低温的优良株系,为深入研究TaLEA基因的抗寒功能奠定基础。
1 材料与方法
1.1 材料
将转 LEA基因小黑杨 11个株系(XL01、XL03、XL04、XL05、XL06、XL07、XL09、XL10、XL11、XL13、XL14)和非转基因对照株系(WT)定植于东北林业大学林木遗传育种基地,2010年5月初将各参试株系分别剪取50~75个,共700个插条,于塑料大棚中扦插扩繁,8月初从各株系中选取长势基本相同的苗木15~30株,移至人工气候室进行试验。
1.2 方法
低温胁迫:人工气候室内的温度由28℃开始,每日降低2℃,直至4℃,并在4℃维持3 d后,开始测定各指标。
丙二醛(MDA)质量摩尔浓度、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性的测定:从各参试株系中分别选取15棵植株,每一植株取一片位置基本相同的功能叶,混样后进行生理指标的测定。采用分光光度计法测定MDA的质量摩尔浓度[4]、POD 活性[5]、CAT 活性[6]。每个株系重复3 次。
相对高生长的测定:参试材料移至人工气候室低温胁迫前后,分别测量植株高度,求算相对高生长,公式如下:

叶绿素质量分数的测定:采用SPAD502型叶绿素仪(日本)分别测定低温胁迫前后参试株系的叶绿素质量分数,各株系选择位置基本相同的功能叶,各株系测定3个叶片。
冷害指数的评定:于低温胁迫结束后对参试株系进行冷害情况调查,计算冷害指数,公式如下:

根据下列指标确定冷害级别:
无冷害症状为0级;
轻度冷害(无冻稍,少部分叶尖枯黄,落叶数占总叶数的20%以内)为1级;
中度冷害(有稍许冻稍,部分叶边缘枯黄,落叶数占总叶数的20%~50%)为2级;
重度冷害(有明显冻稍,大部分叶枯黄,落叶数占总叶数的50%~80%)为3级;
极重度冷害(冻稍严重,叶子全部枯黄,落叶数占总叶数的80%以上)为4级。
1.3 数据处理
采用SPSS统计分析系统和Excel软件进行方差分析及多重比较,采用模糊数学中隶属函数法选择优良转基因株系[7]。
2 结果与分析
2.1 低温胁迫下各株系MDA质量摩尔浓度的比较
植物遭遇逆境或处于衰老的过程中,生物膜的破坏是由细胞产生的超氧自由基诱导脂质中的不饱和脂肪酸发生脂质过氧化造成的[8]。MDA是膜脂过氧化作用的产物,通常将其作为评判脂质过氧化损伤程度的指标之一。逆境下,MDA积累越多,表明细胞膜脂过氧化程度越高,细胞膜受损越严重。
对各转基因及非转基因对照株系(WT)的差异显著性分析显示,胁迫前后MDA质量摩尔浓度的差异显著(P<0.05)。进一步的多重比较表明,胁迫前MDA的质量摩尔浓度除XL09外,其他各株系间差异不明显。而低温胁迫后,各株系间的MDA质量摩尔浓度变化显著,除XL09略高于WT外,其余各转基因株系均低于WT。转基因株系MDA质量摩尔浓度的平均值为 35.209 μmol·g-1(表 1),低于对照 16.5%。XL11、XL10、XL14、XL04、XL13 株系显著低于 WT,其中 XL11和XL10的MDA质量摩尔浓度最低,分别为24.811、25.085 μmol·g-1。低温胁迫条件下,除XL09外,各转基因小黑杨株系的膜质过氧化程度都低于WT,表明其细胞膜受损较轻。
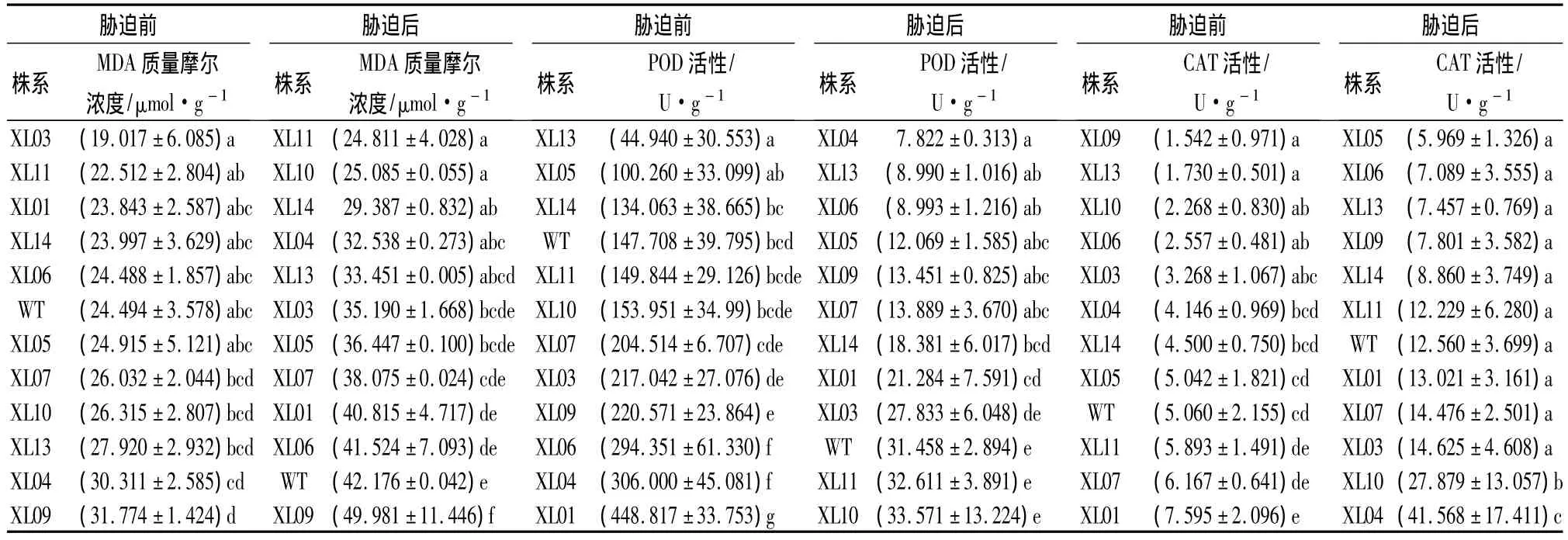
表1 低温胁迫前后各株系的MDA质量摩尔浓度、POD活性、CAT活性的比较
2.2 低温胁迫下各株系POD活性的变化
POD是植物体内担负清除H2O2的主要酶类之一,POD能催化H2O2氧化其他底物生成H2O。POD作为植物体内消除氧自由基伤害的防御酶系成员之一,与植物的抗逆境能力密切相关[9]。
低温胁迫前后,POD活性在参试株系间的差异均显著(P<0.001)。通常认为,POD活性降幅小的株系抗逆性较强[10]。为此,根据胁迫前后POD活性的变化对参试株系进行抗寒性评价,结果表明:只有XL10、XL11下降幅度最小,均为78.2%;WT的降幅次之,为78.7%;降幅在80.0%~90.0%之间的有XL13、XL14、XL03、XL05;其余株系 POD 降幅较大,均在 90.0%以上(表1)。
2.3 低温胁迫下各株系CAT活性的变化
CAT是一种酶类清除剂,可促使H2O2分解为分子氧和水,从而使细胞免于遭受H2O2的伤害,是生物防御体系的关键酶之一。
参试各株系的CAT活性在低温胁迫前后株系间的差异均显著(P<0.001)。非低温胁迫条件下,各株系的CAT活性均维持在一个比较低的水平。低温胁迫后,各株系的CAT活性均有不同程度的上升,其中:XL10和XL04上升幅度较大,分别为胁迫前的1129.2%和902.6%;其余各株系间均无显著性差异。低温胁迫后11个转基因株系的CAT活性平均值为14.634 U·g-1,略高于 WT 的12.560 U·g-1(表1)。
2.4 低温胁迫下各株系相对高生长比较
小黑杨为典型的全期生长型植物,当气温降低时,高生长迅速降低,同时,植株充分木质化,积累抗寒物质,为渡过低温时期做好准备。因此,植株相对高生长的大小是其抗寒性强弱的重要指标。
参试株系经低温胁迫处理后,各转基因株系的相对高生长量在4.0%~15.3%之间,而非转基因对照株系为3.2%(表2)。经 t检验显示,t=4.873,P=0.01 <0.05,表明各转基因株系的相对高生长明显高于WT。其中:XL03的相对高生长最大,为 15.3%;XL07、XL09、XL11、XL04、XL01、XL05、XL14株系的相对高生长在5.0%~10.0%之间;XL10和XL13相对高生长量较小,均为4.41%。
2.5 低温胁迫下各株系的冷害指数
低温影响叶绿素的生物合成和光合进程,淀粉水解以及叶绿素的光氧化,使绿叶退色成黄白[11]。同时,叶柄离区活跃,叶片开始脱落。本试验选取3个最典型的植物冷害症状,用来计算植物的冷害指数。
对参试株系的冷害情况分析发现,各转基因株系中除XL03的冷害指数高于WT外,其余的株系均低于WT(表2)。其中:XL07、XL11、XL13、XL14株系的冷害指数较低,分别为0.21、0.15、0.18、0.21,表明这些转基因株系抗寒性较强。

表2 低温胁迫下各株系相对高生长、冷害指数
2.6 低温胁迫下各株系的叶绿素质量分数比较
叶绿素质量分数是影响光合作用的重要因素,多种胁迫可使叶绿素质量分数降低[12],因此,叶绿素质量分数可以作为植物抗性强弱的标志之一。
低温胁迫前后,参试各株系叶绿素质量分数差异均显著(P<0.01)。多重比较表明,胁迫前,非转基因对照株系的叶绿素质量分数与 XL13、XL14、XL09、XL01、XL07、XL04 转基因株系差异不明显,而其余各转基因株系的叶绿素质量分数则显著高于非转基因对照(表3)。就平均值来看,非转基因对照株系的叶绿素质量分数为39.7 mg·g-1,与11个转基因株系叶绿素平均质量分数的40.4 mg·g-1差距不大。低温胁迫后,各株系叶绿素质量分数均下降,其中:XL01下降的幅度最大,为18.69%;WT降幅第二,为16.88%;而各转基因株系的叶绿素下降幅度在8.20%~16.30%之间。多重比较的结果显示,除XL01、XL04、XL09外,其余转基因株系胁迫后叶绿素质量分数均显著高于WT,表明低温胁迫对多数转基因株系的叶绿素合成影响小于对照株系。全体转基因株系叶绿素质量分数的平均值为35.1 mg·g-1,亦高于非转基因对照株系的33.0 mg·g-1,表明在低温胁迫下,转基因株系具有明显的优越性。

表3 低温胁迫前后各株系叶绿素质量分数
2.7 抗寒性生理指标综合评定
从低温胁迫后生理指标中选出与抗寒性相关、具有代表性的几个指标进行分析,并采用模糊数学中隶属函数值的方法,对转LEA基因各株系和非转基因对照株系的抗寒性差异情况进行综合评定(表4)。

表4 各株系抗寒性综合评定
从表4中可以看出,各株系的隶属函数值以XL11最大,XL09最小。7个转基因株系的隶属函数值高于非转基因对照株系,仅4个转基因株系低于非转基因对照。其中XL11、XL10、XL14、XL04转基因株系的隶属函数值较大,具有较好的抗寒性。
3 结论与讨论
对植物的抗寒性鉴定已有诸多报道,其中MDA质量摩尔浓度的变化是反映低温胁迫下质膜稳定性和植物抗寒性的一个重要指标,研究已证明,MDA质量摩尔浓度的增加与组织受伤害程度显著正相关[13-15]。
低温胁迫下参试株系的细胞膜损伤测定显示,各株系MDA 质量摩尔浓度差异较大,XL11、XL10、XL14、XL04、XL13与WT之间达到了显著的水平。其中:XL11和XL10株系的MDA质量摩尔浓度最低,分别低于WT的41.2%和40.5%,表明XL11和XL10株系的细胞膜损伤程度最小,而XL14、XL04和XL13株系次之。从MDA质量摩尔浓度方面比较可见,XL11、XL10、XL14、XL04、XL13 转基因株系在低温胁迫下细胞膜受到的伤害轻于WT。而在林木遗传育种与生物技术教育部重点实验室(东北林业大学)前期所做的转LEA基因烟草的抗寒性试验亦表明,LEA基因的导入,不同程度地减轻了低温下烟草细胞膜的伤害[16]。
植物抗氧化胁迫的能力与其抗逆性之间是呈正相关的关系[17],在逆境胁迫条件下,植物体内自由基增多,使细胞膜产生过氧化,从而导致细胞膜的损伤。POD与CAT等共同组成了植物体内活性氧的防御系统,在清除超氧自由基、H2O2等方面发挥着重要作用。低温胁迫前后POD活性的变化分析表明,只有 XL10、XL11下降幅度最小,均为78.2%(表 1)。低温胁迫后,各株系的 CAT活性均明显升高,其中 XL01、XL07、XL03、XL10、XL04 的 CAT 活性高于 WT,XL11 亦与 WT相差不大,为WT的97.4%。从胁迫前后的POD与CAT活性来看,只有XL10和XL11株系具有较好的抗氧化性。对遗传背景完全相同的小黑杨转基因株系来说,11个株系的抗氧化能力差异显著,推测是外源LEA基因的插入位)点不同,可能发生插入突变或转基因沉默,致使有些转基因株系的POD与CAT活性较低。
植物受低温胁迫时,木质化进程将加快,并逐渐停止高生长以增强抗低温的能力。一般认为,植物的相对高生长愈小、愈早木质化,抗性愈强。试验发现,参试株系中,非转基因株系的相对高生长最小,仅为3.2%,但是其冷害指数明显高于各转基因株系(XL03除外),故认为LEA基因的导入提高了小黑杨的抗寒能力,使其形成顶芽的时间推迟,导致生长期延长。
叶绿素质量分数的高低也是评价植物抗寒性的另一重要指标。低温胁迫下植物叶绿素的质量分数高,则有利于光合作用顺利进行,使有机物积累,渗透势下降,细胞保水力提高,从而增强植物的抗寒性。对11个转基因和非转基因株系的叶绿素质量分数比较发现,XL11、XL03、XL07、XL14、XL10 株系胁迫后的叶绿素质量分数仍然较高,说明低温胁迫下这些株系能维持较高的光合速率。
对植物抗寒性的研究,如果孤立地采用形态、生理生化和代谢等单一指标进行抗寒性鉴定,很难反映植物抗寒的实质。植物的生理过程是错综复杂的,其抗寒性受多种因素影响,为了克服单个指标鉴定的不足,笔者采用模糊隶属函数法,根据测定的抗寒性指标对转TaLEA小黑杨的抗寒性进行了综合评价。其中,转基因株系中的XL11、XL10、XL14和XL04综合评定指标较好,具备进一步推广试验的潜力,可进行后续试验加以验证。
[1]Shao Hongbo,Liang Zongsuo,Shao Mingan.LEA proteins in higher plants:structure,function,gene expression and regulation[J].Colloids and Surfaces B,2005,45(3/4):131 -135.
[2]白爽.转Lea基因小黑杨花粉植株抗旱、耐盐性分析[D].哈尔滨:东北林业大学林学院,2007.
[3]俞嘉宁,山仑.LEA蛋白与植物的抗旱性[J].生物工程进展,2002,22(2):10 -14.
[4]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2006:74.
[5]朱广廉.植物生理学实验[M].北京:北京大学出版社,1990:37-40.
[6]李忠光,李江鸿,杜朝坤,等.在单一提取系统中同时测定五种植物抗氧化酶[J].云南师范大学学报:自然科学版,2002,22(6):44-48.
[7]庄丽,陈亚宁,陈明,等.模糊隶属法在塔里木河荒漠植物抗旱性评价中的应用[J].干旱区地理,2005,28(3):367 -372.
[8]刘金龙,杨秀清,姚延梼.铜锌元素与华北落叶松丙二醛含量关系的研究[J].山西农业大学学报:自然科学版,2003,23(3):212-215.
[9]熊正英,张志勤,王致远,等.POD活性与水稻抗旱性的关系[J].陕西师大学报:自然科学版,1995,23(4):63 -66.
[10]冯昌军,罗新义,沙伟,等.低温胁迫对苜蓿品种幼苗 SOD、POD活性和脯氨酸含量的影响[J].草业科学,2005,22(6):29-32.
[11]潘瑞炽.植物生理学[M].6版.北京:高等教育出版社,2008:287.
[12]朱新广,张其德.NaCl对光合作用影响的研究进展[J].植物学通报,1999,16(4):332 -338.
[13]杜永吉,于磊,孙吉雄,等.结缕草3个品种抗寒性的综合评价[J].草业学报,2008,17(3):6 -16.
[14]孙清鹏,许煌灿,张方秋,等.低温胁迫对大叶相思和马占相思某些生理特性的影响[J].林业科学研究,2002,15(1):34 -40.
[15]陈钰,郭爱华,姚延涛.杏枝芽内MDA含量和电导率值变化与抗寒性关系的研究[J].天津农业科学,2007,13(4):4 -6.
[16]林士杰,李俊涛,姜静,等.转柽柳晚期胚胎富集蛋白基因烟草的耐低温性分析[J].生物技术通讯,2006,17(4):563 -566.
[17]Jiagn Mingyi,Zhang Jianhua.Water Stress-induced abscisic acid accumulation triggers the increased generation of reactive oxygen species and up-regulates the activites of antioxidant enzymes in maize leaves[J].Journal of Experimental Botany,2002,53:2401 -2410.
