霜制对苦杏仁中苦杏仁苷在大鼠尿液中的代谢与排泄影响
2011-05-26付志玲郑晓晖房敏峰
付志玲, 郑晓晖, 房敏峰
(西部资源生物与现代生物技术教育部重点实验室,西北大学生命科学学院,陕西西安 710069)
霜制对苦杏仁中苦杏仁苷在大鼠尿液中的代谢与排泄影响
付志玲, 郑晓晖*, 房敏峰*
(西部资源生物与现代生物技术教育部重点实验室,西北大学生命科学学院,陕西西安 710069)
目的 探讨霜制对苦杏仁中苦杏仁苷在大鼠尿液中的代谢与排泄影响。方法 将SD大鼠分别注射苦杏仁苷、灌胃苦杏仁生品及霜制品水煎液,于不同时间段收集尿液,HPLC测定尿液中马尿酸、苦杏仁苷及其代谢产物野樱苷,LCMSn鉴定代谢产物的结构。结果 苦杏仁苷注射给药后主要以原型排泄,马尿酸质量分数无明显变化;苦杏仁生品与霜制品灌胃给药后主要以代谢产物野樱苷的形式排泄,马尿酸质量分数有显著增长,且霜制后野樱苷的排泄时间延迟。结论 霜制对苦杏仁中苦杏仁苷的排泄有较大影响。
苦杏仁;霜制;代谢;高效液相色谱-质谱联用
苦杏仁镇咳祛痰的有效成分为苦杏仁苷[1],经霜制脱脂灭酶后有效成分显著提高[2]。苦杏仁生品及霜制品口服后在血液和组织中均未检出苦杏仁苷原型,而检出了野樱苷,且该成分在8 h内稳定存在[3]。但野樱苷是苦杏仁苷在体外水解的中间产物,极不稳定[4]。因此,有必要通过尿液代谢检测不同炮制品中苦杏仁苷的代谢终产物,据此推测苦杏仁苷的体内代谢过程,探讨苦杏仁霜制机理。
1 仪器与材料
1.1 仪器
Agilent 1100系列高效液相色谱-电喷雾-离子阱质谱联用仪;岛津LC-10AT vp高效液相色谱仪;SPD-10A vp紫外检测器;SHIMADZU CBM-102色谱工作站(日本Shimadzu Corpration);DXL-10大鼠代谢笼(上海科科医学模型有限公司);HC-3018高速离心机(科大创新股份有限公司)。
1.2 试药
苦杏仁苷对照品,购自中国药品生物制品检定所(批号110820-200403);马尿酸对照品(纯度大于98.5%,购于国药集团化学试剂有限公司,批号F20080624);苦杏仁药材(购于陕西省药材公司,由陕西省药品检验所鉴定);色谱甲醇(美国Fisher公司,批号086955);实验用水为超纯蒸馏水(自制);其他试剂均为分析纯。
1.3 动物
SD大鼠,雌雄兼用,体质量200~220 g,由西安交通大学实验动物中心提供,合格证号:医动字第09-003号。
2 方法
2.1 色谱条件
Thermo Hypersil GOLD Cl8色谱柱 (250 mm×4.6 mm,5 μm);流动相:甲醇-水-甲酸(13 ∶87 ∶0.1);体积流量 0.8 mL/min;柱温 25 °C;检测波长220 nm;进样量 10 μL。
质谱条件:电喷雾离子源;正离子模式;喷雾电压 3.5 kv,干燥气体积流量 8.0 L/min,干燥气温度350℃;雾化气压力35.0 Psi;质量扫描范围50~1 000 amu;流动相:甲醇-水-甲酸-甲酸铵(13 ∶87 ∶0.1 ∶0.1);体积流量 0.8 mL/min,入质谱分流比例为3∶1;柱温25 °C。
2.2 药材供试品溶液的制备
取苦杏仁和苦杏仁霜适量,捣碎,加沸水回流提取2次,每次15 min,滤过,浓缩,制得质量浓度为1 g生药/mL的不同炮制品供试溶液。
2.3 方法学考察
2.3.1 专属性
在拟定色谱条件下,空白尿液对苦杏仁苷(tR=27.8 min)测定无干扰。马尿酸为正常尿液中的内源性成分,所以在空白尿液色谱图中在与马尿酸对照品相同保留时间处(tR=20.8 min)出现一色谱峰,经LC-MS确认为内源性的马尿酸,经多份空白尿液测定,内源性的马尿酸峰面积相对小且恒定,故不影响观察马尿酸的变化。苦杏仁苷和马尿酸的峰形良好。
2.3.2 线性范围和检测限
精密吸取苦杏仁苷和马尿酸的系列标准尿液样品10 μL,在拟定色谱条件下进样分析。以峰面积为纵坐标(y),以苦杏仁苷和马尿酸的浓度为横坐标(x,μg/mL)进行回归分析,空白尿液中马尿酸的面积相对小且恒定,通过空白尿液扣除的方法得马尿酸的标准曲线回归方程,结果见表1,检测限为0.3 μg/mL。
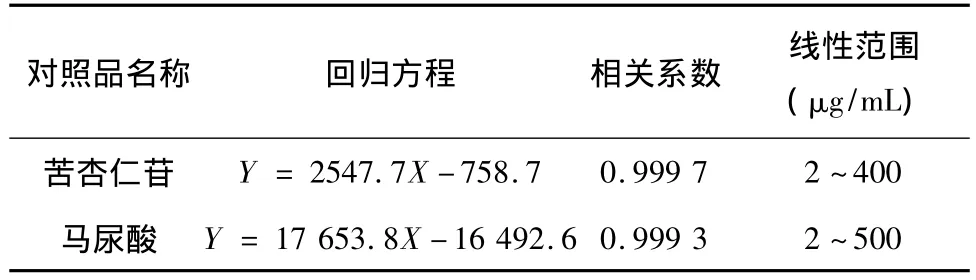
表1 苦杏仁苷和马尿酸的线性关系结果Tab.1 The linear relationship of amygdalin and hippunic acid
2.3.3 回收率、精密度和稳定性
精密配制2、20、200 μg/mL 低、中、高 3 个质量浓度的苦杏仁苷和马尿酸的空白尿液加标样品各5份,在拟定分析条件下分析,记录峰面积,由线性方程计算得到测得量,以测定值的平均值与配制的理论浓度比较,得苦杏仁苷和马尿酸的回收率均大于89%。每日每个浓度平行测定5次,分别在6日内连续测定5次,得日内及日间精密度RSD均小于5%,稳定性RSD均小于5%。
2.4 样品的采集
取健康SD大鼠,随机分3组,每组6只,实验前禁食,自由饮水。分别尾静脉注射苦杏仁苷(100 mg/kg);灌苦杏仁生品以及苦杏仁霜制品水煎液(7 g生药/kg),另设2只给予生理盐水,作为空白对照。置于大鼠代谢笼中收集给药后0~2 h,2~4 h,4~8 h,8~12 h,12~24 h,5 个时段的尿液,分别记录所收集尿液体积,得到含药和空白尿液样品,于-20°C冻存备用。
2.5 样品预处理
取2.4项下所收集的尿样适量,4 000 r/min离心10 min,取离心后的上清液用水稀释(稀释倍数视尿样中的药物浓度而定,一般为10~100倍),稀释后用0.45 μm微孔滤膜滤过,取续滤液直接进样分析。
3 结果
3.1 给药后尿液样品的LC-MS分析
分别取2.5项下的尿液样品10 μL,在拟定色谱条件下进样分析,结果显示苦杏仁苷注射给药后可在大鼠尿液中检测到苦杏仁苷原型,马尿酸的质量分数与空白组无明显差异;灌胃给药苦杏仁生品和霜制品后均未检测到苦杏仁苷原型,分别在34 min和36 min处检测到苦杏仁苷的代谢产物,经质谱分析为野樱苷的同分异构体,即D-野樱苷和L-野樱苷[5-7],马尿酸的质量分数明显增大,见图1。

图1 给药后尿液样品的HPLC图Fig.1 The HPLC graph of rat urine sample after mainline or oral administration
3.2 给药后大鼠含药尿液中马尿酸、苦杏仁苷及野樱苷随时间的变化
将不同时间点收集到的大鼠含药尿液分别进行HPLC检测。结果表明,苦杏苷注射给药后在0~2,2~4,4~8,8~12,12~24 h 5个时间段均能检测到明显的苦杏仁苷原型,其中以2~4 h排出量最大,累积排出率为69.9%。苦杏仁生品和苦杏仁霜灌胃给药后,在5个时间段均可检测到明显的代谢产物野樱苷,生品灌胃时以0~2 h排出量最大,而制霜后最大排出量集中在2~4 h,且灌胃给药后尿液中马尿酸的质量分数均显著增大,见图2和图3。
3.3 苦杏仁苷在大鼠体内的代谢过程
根据以上检测结果,结合文献[3]推测灌胃给药苦杏仁生品与霜制品后其主要成分苦杏仁苷在大鼠体内的代谢途径,如图4所示。
4 讨论

图2 大鼠灌服苦杏仁生品和霜制品后野樱苷的累积排泄曲线Fig.2 The cumulative excretion curve of prunasin after oral raw or cream product of bitter almond by rat
4.1 某些种子类中药由于富含大量脂肪油而具有毒性强、滑肠致泻剧烈等缺点,中医临床上常通过炮制去油成霜,以达降低毒性、用药安全的目的[8]。通常将药材碾碎如泥状,经微热后,压去部分油脂,制成符合一定要求的松散粉未[9]。但苦杏仁苷易被苦杏仁酶水解,故在制霜时,需将生品打成较大碎粒,蒸制灭酶后,才可做脱脂处理,否则,苦杏仁霜中有效成分损失较大。

图3 大鼠注射苦杏仁苷、灌服苦杏仁生品和霜制品后马尿酸的累积排泄曲线Fig.3 The cumulative excretion curve of hippuric acid after amygdalin given by mainline,bitter almond and its cream product given by oral in rat

图4 苦杏仁苷在大鼠体内的代谢过程Fig.4 The metabolic process of amygdalin in rat
4.2 注射给药苦杏仁苷,在尿液中主要以原型药的形式排出,灌胃给药苦杏仁生品和霜制品后主要是以代谢产物野樱苷的形式排出,野樱苷是苦杏仁苷的次级苷,推测是由苦杏仁苷在肠道内代谢形成的[10]。其体内作用过程为苦杏仁苷首先经脱糖转化为野樱苷,再经脱糖转化为苯乙腈,苯乙腈分解生成HCN和苯甲醛,HCN发挥止咳平喘的功效,苯甲醛经氧化生成苯甲酸,苯甲酸被输送到肝脏后,在ATP、Mg2+、CoA的作用下,与肽键和甘氨酸结合生成马尿酸排出体外,因此灌胃给药后马尿酸的质量分数显著升高。
4.3 苦杏仁生品灌胃时野樱苷在0~2 h排出量最大,而霜制后最大排出量集中在2~4 h。即经霜制以后,野樱苷的排泄时间与生品有明显不同,霜制后可使其排泄时间延迟,即药物在体内的作用时间延长,这种影响可能与霜制可改变苦杏仁的作用趋向,增强其止咳平喘的功效有关,苦杏仁苷的代谢产物野樱苷是否与苦杏仁止咳平喘的药理作用相关还有待进一步研究。
[1]杨书斌,刘 青,孙立立,等.HPLC测定苦杏仁饮片中苦杏仁苷的含量[J].中成药,2006,28(10):1452-1454.
[2]张振凌.临床中药炮制学[M].北京:中国中医药出版社,2007:206-207.
[3]房敏峰,付志玲,王启林,等.炮制对苦杏仁中苦杏仁苷在大鼠体内代谢的影响[J].中国中药杂志,2010,35(20):2684-2688.
[4]叶定江.中药炮制学[M].上海:上海科学技术出版社,2002:252-253.
[5]Ge B Y,Chen H X,Han F M,et al.Identification of amygdalin and its major metabolites in rat urine by LC-MS/MS[J].J Chromatogr B,2007,857:281-286.
[6]Koo J Y,Hwang E Y,Cho S,et al.Quantitative determination of amygdalin epimers from armeniacae semen by liquid chromatography[J].J Chromatogr B,2005,814:69-73.
[7]Takafumi I,Yutaka M,Keiichi Y,et al.Quantitative determination of amygdalin epimers bycyclodextrin-modified micellar electrokinetic chromatography[J].J Chromatogr A,2001,923:249-254.
[8]贾丈钦,张松乾,赵清建.中药炮制制霜方法的改进[J].中国医院药学杂志,1991,11(7):329-330.
[9]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:附录20.
[10]Strugala G J,Stahl R,Elsenhans B,et al.Small-intestinal transfer mechanism of prunasin,the primary metabolite of the cyanogensic glycoside amygdalin[J].Hum Exp Toxicol,1995,14:895-901.
Effect of defatted method on metabolism and excretion of bitter almond in rat
urine
FU Zhi-ling, ZHENG Xiao-hui*, FANG Min-feng*
(Key Laboratory of Resource Biology and Biotechnology in Western China,Ministry of Education,The College of Life Sciences,Northwest University,Xi’an 710069,China)
AIMTo explore the processing influence of removal of oil on metabolism and excretion of bitter almond in rat urine.METHODSSix SD rats were given the injection of amygdalin,other six SD rats took the perfusion of the extract of bitter almond,the third group of six SD rats took the extract of defatted bitter almond.Sample of these rats’urine was collected at various time intervals and contents of amygdalin,hippuric acid and prunasin analyzed on HPLC.LC-MS was applied to the structure analysis.RESULTSAfter drug administration,amygdain in prototype was found out in rat urine receiving injection of amygdain,hippuric acid content in rat urine continued without change.SD rats receiving perfusion excreted prunasin-metabolite of amygdain,and increased the excretion of hippuric acid。Experiment showed that the defatted bitter almond caused the excretion time interval of prunasin to be delayed.CONCLUSIONThe defatted processing may have an important effect on the excretion of amygdalin.
bitter almond;processing;metabolism;LC-MSn
R285.5
A
1001-1528(2011)07-1202-04
2010-01-20
陕西省中医管理局基金资助项目(陕中医发20072507)
付志玲(1982—),女,硕士生,从事中药炮制研究。E-mail:fuzhiling007@163.com
*通信作者:郑晓晖(1968—),男,教授,从事复方代谢研究。E-mail:zhengxh@nwu.edu.com
房敏峰(1967—),女,副教授,从事中药资源与炮制研究。E-mail:fff885@126.com
