前列地尔对局灶性脑缺血大鼠p-JNK及p-c-Jun表达的影响
2011-05-23包翠芳包翠芬闵连秋
包翠芳,魏 嘉,梁 佳,包翠芬,闵连秋
(1锦州市中心医院,辽宁锦州121000;2辽宁医学院科学实验中心;3辽宁医学院附属第一医院)
缺血性脑病(HIE)是指局部脑组织缺血、缺氧后引发的病理过程,最终导致神经细胞凋亡或坏死,是HIE患者致残、死亡的常见原因。前列地尔有扩张血管、保护血管内皮细胞等作用,近年研究发现,该药还有神经保护作用,但其机制尚不清楚。为探讨前列地尔对局灶性脑缺血大鼠大脑皮层磷酸化c-Jun氨基末端激酶(p-JNK)和磷酸化c-Jun(p-c-Jun)表达的影响,分析其抗脑缺血损伤机制,我们进行了相关研究。现报告如下。
1 材料与方法
1.1 动物、药品及试剂 SD大鼠30只,体质量200~250 g;前列地尔脂肪乳剂(北京泰德制药公司),尼莫地平注射液(山西亚宝药业);兔抗大鼠p-JNK、p-c-Jun单克隆抗体(SANTA CRUZ公司)。
1.2 方法
1.2.1 动物分组 将30只大鼠随机分为假手术组(A组)、缺血对照组(B组)、前列地尔治疗组(C组)、阳性药物对照组(D组),其中C组又分为前列地尔 1.25 μg/kg(C1 组)、2.50 μg/kg(C2 组)、5.00 μg/kg(C3组)三个亚组,每组5只。术前5 d至取材当日,C组腹腔注射前列地尔,D组注射尼莫地平,其余各组注射等量生理盐水。
1.2.2 HIE模型制备 采用改良线栓法制备HIE模型。自大鼠右颈总动脉剪一小口,置入直径0.20~0.26 mm的线栓,从颈总动脉分叉处计算,进线深度18~20 mm,直至大脑中动脉起始部,以完全阻断血供。模型成功的标志是大鼠即刻出现右侧霍纳征。A组除不置入线栓外,其他步骤同上。
1.2.3 神经功能缺损评分 大鼠苏醒后,参考Longa等[1]制定的5分制评分标准,对其进行神经功能缺损评分。0分示无明显神经病学症状;1分示不能完全伸展左侧前爪;2分示向左侧旋转;3分示行走时向左侧倾倒;4分示不能自动行走,意识下降。
1.2.4 免疫组化染色 各组缺血6 h后,采用4%多聚甲醛灌流固定,断头取脑,石蜡包埋,5 μm切片。石蜡切片常规脱蜡至水,行免疫组化Envision法染色。p-JNK和p-c-Jun阳性表达为细胞核内呈棕黄色。采用CIAS-1000型细胞图像分析系统检测每个视野p-JNK、p-c-Jun阳性细胞数占总细胞数的百分比。
1.2.5 统计学方法 采用 SPSS10.0统计软件,数据用±s表示,多组间比较用t检验、单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
各组神经功能缺损评分及大脑皮层p-JNK、p-c-Jun表达阳性率比较见表1。
表1 各组神经功能缺损评分及大脑皮层p-JNK、p-c-Jun表达阳性率比较(±s)
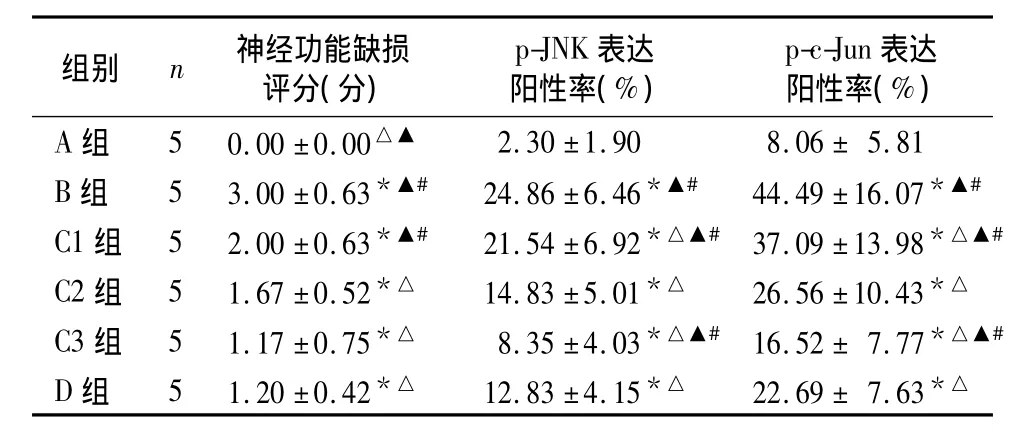
表1 各组神经功能缺损评分及大脑皮层p-JNK、p-c-Jun表达阳性率比较(±s)
注:与A 组比较,*P <0.05;与B组比较,△P <0.05;与C2组比较,▲P <0.05;与 D 组比较,#P <0.05
组别 n 神经功能缺损评分(分)p-JNK表达阳性率(%)p-c-Jun表达阳性率(%)A 组 5 0.00 ±0.00△▲2.30 ±1.90 8.06 ± 5.81 B 组 5 3.00 ±0.63*▲# 24.86 ±6.46*▲# 44.49 ±16.07*▲#C1 组 5 2.00 ±0.63*▲# 21.54 ±6.92*△▲# 37.09 ±13.98*△▲#C2 组 5 1.67±0.52*△ 14.83±5.01*△ 26.56±10.43*△C3 组 5 1.17±0.75*△ 8.35±4.03*△▲# 16.52± 7.77*△▲#D 组 5 1.20 ±0.42*△ 12.83 ±4.15*△ 22.69 ± 7.63*△
3 讨论
近年研究表明,前列地尔除有改善血流动力学、扩血管等作用外,还能有效地减轻心肌、肝脏、脑组织等缺血缺氧状态。刘畅等[2]研究发现,前列地尔预处理对大鼠心肌损伤有早期和延迟保护作用。另外,前列地尔还可有效地抑制肝缺血后的细胞凋亡,保护移植肝,缓解长时间冷保存引起的缺血再灌注损伤,延长受体存活时间[3];明显降低肝缺血后的ALT、AST、TNF-α,减轻肝脏缺血再灌注损伤程度[4]。田步先等研究显示,前列地尔预处理后,局灶性脑缺血大鼠的神经缺损症状明显改善,脑梗死灶明显缩小,脑水肿程度减轻,细胞凋亡数量明显减少。以上研究表明,前列地尔可有效地抑制缺血缺氧所致的细胞凋亡,但其作用机制尚不清楚。
现已明确,丝裂原活化蛋白激酶超家族成员JNK是体内主要介导细胞凋亡的因子之一,其通过活化下游效应分子p-c-Jun等引起一系列级联反应,进而诱导细胞凋亡。脑缺血损伤时JNK被激活,从而诱导细胞凋亡,导致缺血性损伤。因此,抑制JNK通路活化有望成为脑缺血损伤的治疗靶点。本研究发现,假手术组无神经功能缺损症状,偶见少量p-JNK、p-c-Jun阳性细胞;缺血对照组有明显神经功能缺损症状,其p-JNK、p-c-Jun阳性细胞明显增多,与文献报道[5]基本一致。经前列地尔处理后,p-JNK、p-c-Jun阳性细胞明显减少,提示前列地尔可能通过抑制JNK蛋白及其下游效应分子p-c-Jun活化,抑制局灶性脑缺血损伤后的神经细胞凋亡,发挥缺血性脑损伤的保护作用;还提示前列地尔在抑制神经细胞凋亡方面具有剂量—效应关系,即在一定范围内,随着药物剂量增加,其抑制神经细胞凋亡的作用明显。
[1]Longa EZ,Weinstein PR,Carlson S.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[2]刘畅,梅晰凡,陶贵周,等.前列地尔预处理对大鼠心肌缺血再灌注损伤的保护性作用[J].解剖科学进展,2009,15(3):286-289.
[3]王军,钱海鑫,秦磊,等.前列地尔对大鼠移植肝缺血再灌注损伤的保护作用[J].苏州大学学报(医学版),2010,30(1)69-71.
[4]贾红燕,李辉宇,赵浩亮.前列地尔注射液对犬肝脏缺血再灌注损伤的保护作用[J].山西医科大学学报,2010,41(1):8-10.
[5]Gao Y,Signore AP,Yin W,et al.Neuroprotection against focal ischemic brain injury by inhibition of c-Jun Nterminal kinase and attenuation of the mitochondrial apoptosis signaling pathway[J].J Cereb Blood Flow Metab,2005,25(6):694-712.
