SPR生物传感器在急性白血病髓系抗原CD33检测中的应用*
2011-05-06谢永红王耀玲程小丽王红理方湘怡
谢永红,王耀玲,程小丽,张 玮,王红理,方湘怡*
1.西安交通大学理学院实验物理中心,西安 710049;2.西安市第二人民医院妇产科,西安 710049;3.西安交通大学第一附属医院,血液学研究中心,西安 710049
SPR技术是一种新兴的生化检测技术。自从上世纪 80年代 Nylander和 Liedberg等将其引入到气体检测和生物传感器领域中[1-3]以来,经过 20多年的发展,SPR传感技术由于其灵敏度高、反应快速、可重复性好、样品无需标记、操作简单等优点[4],已被广泛应用于临床医学、环境监测、药品筛选等领域[5-7]。
白血病是一种起源于造血干细胞的恶性肿瘤,在我国已被列为十大高发性恶性肿瘤之一。我国白血病的发病率约为 3/10万 ~4/10万人口[8],其中急性白血病发病急、发展快、死亡率高。因此,及早地诊断白血病具有非常重大的意义。CD33是一种急性白血病髓系抗原。有关白血病免疫分型的研究资料表明:90%急性髓系白血病(AML)患者的髓系肿瘤细胞表面都表达 CD33抗原,而这种抗原在正常造血干细胞及非造血细胞表面不表达,这些发现说明 CD33抗原可能是 AML特异性诊断和治疗的最佳靶抗原[9-10]。目前,对于 CD33抗原的检测应用最广泛的方法是流式细胞术(FCM),但是这种方法需要特殊仪器,操作技术要求高,价格昂贵,结果的重复性欠佳。
本实验采用自组装单层膜技术,在传感芯片表面修饰抗 CD33单克隆抗体,首次运用自行构建的Kretschmann结构波长调制型 SPR生物传感器检测AML患者骨髓血液和健康人骨髓血液中 CD33抗原的表达,并将实验结果和 FCM结果进行比较,结果显示 SPR生物传感器能够很好的检测出人骨髓液中 CD33抗原的表达。本实验还在相同的条件下,用该 SPR生物传感器检测了分离的骨髓血液和骨髓全血,实验结果表明,SPR生物传感器对 CD33抗原的特异选择性好。
1 实验部分
1.1 仪器与试剂
自行构建的 Kretschmann结构波长调制型 SPR生物传感器、KQ-100KDE型高功率数控超声波清洗器(昆山市超声仪器有限公司)、KYKY SBC-12型真空离子溅射仪(北京中科科仪技术发展有限责任公司)、抗 CD33单克隆抗体(Beckman Coulter Inc)、人骨髓血液样品(西安交通大学第一附属医院临床采集)、TBST溶液(由第四军医大学西京医院消化病医院生物学肿瘤实验室提供)、MPA和 NHS(均购于美国,Alfa Aesar)、EDC(购于上海 Medpep有限公司)、牛血清蛋白(BSA)、丙酮、无水乙醇、丙三醇等。实验所用试剂均为分析纯,所用水均为二次去离子水,所用缓冲液为磷酸盐溶液(PBS,pH 7.4)。
1.2 实验方法
1.2.1 SPR生物传感器的原理
本实验用的 SPR生物传感器基于Kretschmann-Raether衰减全反射配置[11],采用固定入射角,在一定波长范围(400 nm~740 nm)内对共振波长进行测量。其检测方法是通过待测物和修饰在传感芯片表面的生物分子反应,引起与芯片金膜接触的介质的介电常数的变化,从而引起共振波长的改变来反映分析物的生物反应过程和性质[12]。
1.2.2 传感片的制作
本文选用稳定性好的金膜作为传感膜,折射率与棱镜相匹配的玻璃片作为基片。将基片分别用去离子水、丙酮、无水乙醇、去离子水各超声清洗 10 min,然后用氮气吹干。再将处理好的基片放入 KYKY SBC-12型真空离子溅射仪的真空腔衬底座上,先镀一层铬(厚度约为 2 nm)以增强金原子的粘附力,使金膜不容易脱落,再镀一层金膜(厚度为 50 nm)。
1.2.3 CD33单克隆抗体的固定
将传感片浸入 0.1%(m/m)MPA的无水乙醇溶液中,于室温下放置 12 h,取出后依次用无水乙醇和二次去离子水清洗以除去没有吸附的 MPA;再将0.4mol/L的 EDC溶液和 0.1 mol/L的 NHS溶液按1∶1(V/V)的比例混合,滴于传感片的金膜上,于35℃下放置1 h后用二次去离子水洗去未键合的混合溶液;然后在已活化的金膜上滴上抗 CD33单克隆抗体溶液(该溶液已用 PBS缓冲液按 1∶300的比例稀释)于 37℃下放置 1 h,用 PBS缓冲液洗去未吸附的CD33单克隆抗体;最后将 BSA溶液(1 mg/mL)滴于金膜上,于 35℃下放置 40min以封闭残余的巯基,减少非特异性吸附,然后用 PBS缓冲液洗去未吸附的BSA溶液,氮气吹干,并将已修饰好 CD33单克隆抗体的传感片置于 4℃冰箱中保存备用。
1.2.4 用 SPR生物传感器检测样品
将已经修饰了抗 CD33单克隆抗体的传感片用折射率相匹配的丙三醇耦合在棱镜上,调节光路并采集黑、白对照光谱图,在样品池中加入 100μL PBS缓冲液,记录光谱图 1,然后再在样品池中加入100μL的待测骨髓血液样品,保持 1 h使抗体-抗原充分反应,然后用 TBST溶液冲洗传感片,以减少非特异性吸附,然后再用 PBS缓冲液冲洗,记录光谱图 2,分析上述光谱图,就可以得到抗原-抗体结合后共振波长的变化值。整个 SPR实验都是在 25℃的温度条件下进行,样品加入前后的光谱图均在以PBS缓冲液为环境液体的条件下测得。这样可以有效地减少其他因素对实验结果的干扰。
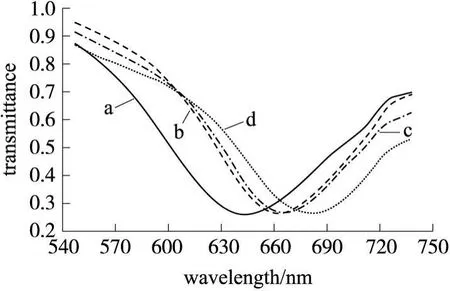
图1 MPA自组装(a)、抗 CD33单克隆抗体的固定(b)、阴性对照(c)、阳性对照(d)的 SPR光谱图
1.2.5 传感片的再生
传感片的再生就是用一定浓度的酸、碱溶液或者离子试剂,破坏抗体-抗原之间的结合,使抗体-抗原离解。本实验采用 Piranha试剂(浓 H2SO4和 30%H2O2按体积比 3∶1混合,该溶液具有强氧化性,每次少量配置)作为洗脱液滴于传感片金膜表面,每次反应 3min,然后用二次去离子水清洗,并用氮气吹干,如此重复洗3次,能有效地洗脱传感片表面吸附的所有抗体及其免疫复合物,实现传感片的再生。
2 结果与分析
2.1 抗CD33单克隆抗体的固定和抗原-抗体反应
将生物分子固定在传感片表面的方法有很多[13]。本实验采用的是自组装膜技术,先在金膜表面自组装一层巯基单分子膜,然后通过EDC和NHS混合溶液的活化作用生成 NHS活泼脂中间体,将抗 CD33单克隆抗体分子牢固地固定在金膜表面。以 AML患者骨髓血液作为阳性对照组,健康人骨髓血液作为阴性对照组,图1显示的是所测得的 SPR光谱图。
比较光谱曲线 a和 b的峰值,我们可以看到共振波长明显增大了。这是因为金膜表面附近介质的折射率发生了变化,而介质折射率的改变又与固定在金膜表面的抗体分子有关。曲线 a和 b之间的共振波长之差说明抗 CD33单克隆抗体已经很好地固定在金膜上了。再比较曲线 b,c和 d,我们可以看到:与曲线 b的共振波长相比,曲线 c的共振波长的增长幅度明显小于曲线 d的共振波长的增长幅度,其中 δλcb为1.601 nm,δλdb为 18.10 nm。这与抗原-抗体反应的特异性相符合。实验结果表明该 SPR传感器能很好的检测出样品骨髓液中 CD33抗原的表达情况。
2.2 SPR生物传感器对CD33抗原的特异选择性
骨髓全血是从 AML患者身上采集的骨髓血液,没有经过分离,它除了含有表达 CD33抗原的细胞之外,还含有其他蛋白质分子以及脂类分子等,成分十分复杂,而经过分离的骨髓血液的成分则相对简单。本实验在相同条件下检测了 AML患者骨髓全血和经过分离的骨髓血液,以此研究 SPR生物传感器对 CD33抗原的特异选择性。
在其他实验条件相同的前提下,用上述检测方法对 AML患者骨髓全血和经过分离的骨髓血液进行检测,结果如表 1所示。
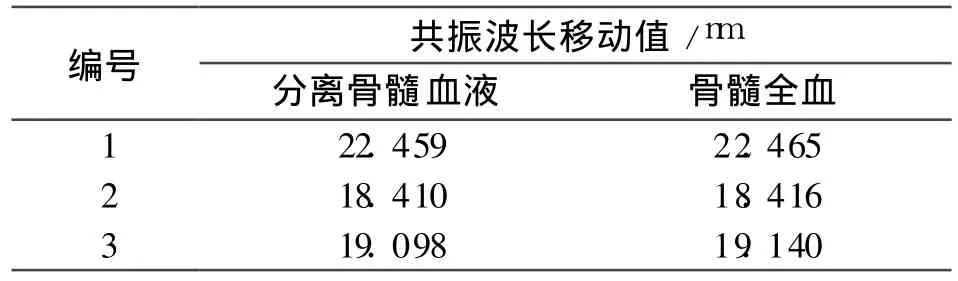
表1 SPR生物传感器对不同类型的骨髓血液的响应值
从表 1的结果可以看出,SPR生物传感器对上述两种类型骨髓血液的响应值基本一致。这表明,其他蛋白质分子对检测结果的干扰很小,SPR生物传感器对 CD33抗原具有良好的特异选择性。
2.3 SPR结果和FCM结果的比较
本实验用 SPR生物传感器检测了几组样品,并将结果与西安交通大学第一附属医院的流式细胞术结果相比较。图 2显示的是 SPR方法与 FCM方法检测的结果。
比较图 2(A)和(C)中的曲线 a,b可得待样品溶液充分反应后共振波长的增长值分别为 16.865 nm和 1.027 nm。对照阴性实验组和阳性实验组,判断(A)中的样品 1为阳性,即为 AML病人骨髓液,(C)中的样品 2为阴性,即为健康人骨髓液。比较此结果和流式细胞术的结果,两者一致。
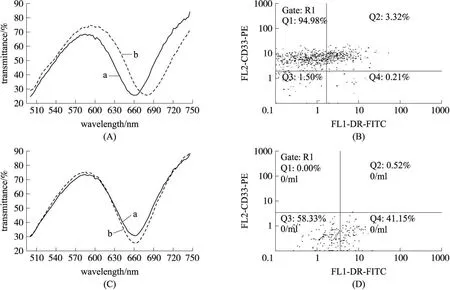
图2 SPR结果与 FCM结果的比较。(A)和(B),(C)和(D)分别表示样品 1和样品 2的SPR谱和FCM图。其中,(A)和(C)中的曲线 a为修饰了抗 CD 33单克隆抗体的传感芯片的 SPR谱,曲线 b为样品的 SPR谱
为了进一步验证 SPR方法的可行性和准确性,本实验检测了由西安交通大学第一附属医院血液学研究中心提供的临床诊断为 AML病人的骨髓液和健康人的骨髓液,结果如图 3所示。其中 No.1,3~6,8~10,12,13,15,16,18~20为 AML病人骨髓液,No.2,7,11,14,17,21,22为健康人骨髓液。
从图 3的检测结果来看,AML病人骨髓液的共振波长增长值远远大于健康人骨髓液的共振波长增长值,其中,该 SPR生物传感器对 AML患者和健康人骨髓血液中 CD33抗原的最大响应值分别为 20.637 nm和 3.402 nm。其结果均与流式细胞术的结果相符。从图 3中我们也可以看到,尽管都是 AML病人骨髓液,但是它们的共振峰移动幅度却不相同,究其原因,可能与白血病的高度异质性和异源性有关。
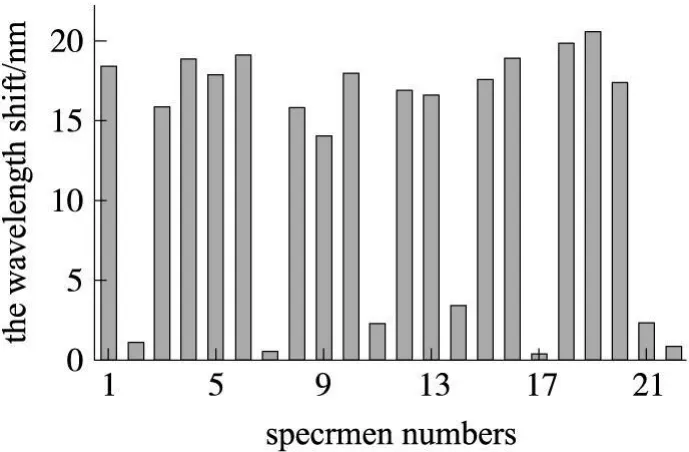
图3 22个样品的SPR检测结果柱形图。样品1,3~6,8~10,12,13,15,16,18~20为 AML患者的骨髓液,样品 2,7,11,14,17,21,22为健康人骨髓液
3 结论
本实验首次运用 SPR生物传感器,在传感芯片表面固定抗 CD33单克隆抗体,以健康人骨髓血液为阴性对照组,已知属性的 AML患者骨髓血液为阳性对照组,检测人骨髓血液中急性白血病髓系抗原CD33的表达。结果显示 SPR生物传感器能很好地检测出样品血液中 CD33的表达差异。同时,实验表明 SPR生物传感器对 CD33抗原的特异选择性好。与传统的 FCM方法相比,SPR生物传感器还具有操作简单、样品无需标记、灵敏度高、能够快速给出定量结果的优点,因此 SPR生物传感器在急性白血病髓系抗原 CD33的检测中有着广阔的应用前景。同时,该实验也为 SPR生物传感器在白血病的临床诊断中的应用研究提供了新思路。
[1]Nylander C,Liedberg B,Lind T.Gas Detection by Means of Surface Plasmons Resonance[J].Sensors and Actuators,1983,3:79-88.
[2]Liedberg B,Nylander C,Lundstrom I.Biosensing with Surface Plasmons Resonance-How it All Started[J].Biosensors and Bioelectronics,1995,10(8):1-6
[3]Piliarik M,Vaisocherova H,Homola J.Towards Parallelized Surface Plasmons Resonance Sensor Platform for Sensitive Detection of Oligonucleotides[J].Sensors and Actuators B:Chemical,2007,121(1):187-193.
[4]Stenberg E,Persson B,Roos H,etal.Quantitative Determination of Surface Concentration of Protein with Surface Plasmon Resonance Using Radiolabeled Proteins[J].Journal of Colloid and Interface Science,1991,143(2):513-526.
[5]Trevino J,Calle A,Mellado M.et al.Determ ination of Human Growth Hormone in Human Serum Samples by Surface Plasmon Resonance Immunoassay[J].Talanta,2009,78:1011-1016.
[6]李昌峰.基于表面等离子体共振生物传感器的研究[D]:[硕士学位论文].天津:天津大学,2007.
[7]Kumbhat S,Sharma K,Gehlot R,et al.Surface Plasm on Resonance Based Immunosensor for Serological Diagnosis of Dengue Virus Infection[J].Journal of Pharmaceutical and Biomedical Analysis,2010,52:255-259.
[8]曹晖.白血病的发病及治疗进展[J].实用医技杂志,2007,14(16):2253-2254.
[9]蒋俊煌,赵伟,景红梅,等.急性白血病免疫表型分析及其临床意义[J].白血病◦淋巴瘤,2007,16(3):184-187.
[10]Legrand O,Perrot JY,Baudard M,et al.The Immunophenotype of 177 Adults with Acute Myeloid Leukemia:Proposal of a Prognostic Score[J].Blood,2000,96(3):870-877.
[11]Yuk JS,Jung SH,Jung JW,et al.Analysis of Protein Interactions on Protein Arrays by a Wavelength Interrogation-Based Surface Plasmon Resonance Biosensor[J].Proteomics,2004,4(11):3468-3476.
[12]邓海东,叶志清,聂义友.金属包覆多层 ATR生物传感器的理论研究.传感技术学报,2004,17(1):172-178.
[13]张先恩.生物传感器[M].北京:化学工业出版社,2005:42-56.
