南疆地区小花棘豆中苦马豆素的分离与鉴定
2011-04-25吴书奇胡建军马春晖
王 帅,吴书奇,胡建军,张 玲,马春晖
(新疆生产建设兵团塔里木畜牧科技重点实验室 塔里木大学动物科学学院,新疆 阿拉尔 843300)
小花棘豆(Oxytropisglabra)是豆科棘豆属植物,有醉马草(新疆策勒、轮台)、苦马豆(新疆莎车)等多种俗称[1-3]。在牧草缺乏的冬季和初春,家畜如果大量采食,就会引起中毒甚至死亡。新疆阿克苏地区每年因采食小花棘豆中毒而死亡的家畜占5%~10%,严重时达50%[2],对畜牧业生产造成了严重的危害。
近年来,有学者对小花棘豆的毒性成分进行了研究。目前认为小花棘豆的有毒成分可分为三类[3-4],即脂肪族硝基化合物、硒及硒化合物、生物碱类物质。葛鹏斌等[4]从小花棘豆中成功分离到苦马豆素,并认为内蒙古小花棘豆的主要有毒成分不是脂肪族硝基化合物和硒类化合物。王占新[5]认为宁夏小花棘豆的主要毒性成分是苦马豆素。但小花棘豆物候期、生长地域、生长年限等的不同会导致其毒性物质含量的明显差异[6]。与宁夏小花棘豆[5]相比,新疆南疆地区小花棘豆中不含蒽醌和香豆素类物质,酚类和生物碱类化合物的组成也存在着一定的差异[7]。目前对内蒙古、宁夏等地的小花棘豆研究较多[4-8],但尚无新疆南疆地区小花棘豆主要毒性成分的相关报道,本研究通过对新疆南疆地区小花棘豆中苦马豆素的分离和鉴定,为新疆南疆地区家畜小花棘豆中毒的防治工作提供基础。
1 材料与方法
1.1材料
1.1.1植物材料 2010年8月,在新疆阿拉尔市托喀依乡(40°33′24″ N,81°15′30″ E)随机采集结实期的小花棘豆植株地上部分,由塔里木大学动物科学学院草业科学学科组鉴定后,阴干、粉碎、过20目筛。
1.1.2试验试剂 吡啶(色谱纯,天津市光复精细化工研究所);苦马豆素标准品(SIGMA);双(三甲基硅烷基)三氟乙酰胺(BSTFA)+三甲基氯硅烷(TMCS)(99∶1),氘代氯仿(CDCl3)(均为美国SUPELCO);其他试剂均为国产分析纯。
1.1.3试验仪器 X-6型精密显微熔点测定仪(北京福凯仪器有限公司);Carry100型紫外-可见分光光度计(美国Varian);Nicolet380(k)型傅立叶红外光谱分析仪(美国热电);TRACE GC ULTRA DSQ型气相色谱质谱联用仪(美国菲尼根);AVANCE NANOBAY型核磁共振谱仪(德国BRUKER)。
1.2试验方法
1.2.1苦马豆素的分离 称取小花棘豆干粉5 kg,用0.1 mol/L稀盐酸浸泡3次,每次12 h,过滤后合并滤液,滤液过已处理完全的732强酸性氢型阳离子交换树脂。用1 mol/L 氨水洗脱,结合碘化铋钾监测直至生物碱检测为阴性,浓缩后烘干。使用氯仿多次溶解,过滤,回收氯仿后即得到总生物碱。将总碱用甲醇完全溶解,过滤,回收甲醇后的残留物上180 μm硅胶柱,使用氯仿∶甲醇∶氨水∶水(体积比为70∶26∶2∶2)混合溶剂洗脱,每10 mL收集一份,薄层层析检测,合并同类项,挥干后残留物在90 ℃、-0.094 MPa真空条件下升华。对得到的白色结晶物进行检测。
1.2.2薄层层析检测 采用常规方法制备硅胶板,将待测样品与苦马豆素标准品溶解于少量甲醇中,用毛细管吸取微量溶液点于硅胶板上,展开剂体系为以下3种,分别为丙酮∶蒸馏水∶氨水(体积比为6∶1∶1)、氯仿∶甲醇∶氨水∶蒸馏水(体积比为70∶26∶2∶2)、乙酸乙酯∶乙醇∶氨水(体积比为4∶1∶1)[7-8]。上行法展开,取出待溶剂完全挥干后,均匀喷洒10% H2O2,待完全挥干后置于105 ℃电热板上加热10 min,取下放凉;再均匀喷洒10%乙酸酐乙醇溶液,完全挥干后置于105 ℃电热板上加热10 min,待无酸味后取下放凉;最后均匀喷洒Ehrlich’s试剂,待完全挥干后置于115 ℃电热板上显色10 min。记录各板斑点形状、颜色,并计算Rf值。
1.2.3分离物鉴定 经熔点(MP)测定、紫外光谱(UV)、红外光谱(IR)、质谱(MS)及核磁共振(NMR)分析,比较文献资料[4-6,8-13],并与苦马豆素标准品进行对照分析,鉴定提取物的结构。
2 结果
2.1提取率 共得到白色晶体质量为99.74 mg,经计算样品提取率为19.95 mg/kg。
2.2薄层层析检测 将此白色结晶物与苦马豆素标准品在3种不同的展开剂体系下于同一条件下上行法展开并显色(图1)。在氯仿∶甲醇∶氨水∶蒸馏水(体积比为70∶26∶2∶2)展开剂条件下,样品Rf值(Ehrlich’s试剂显色)分别为0.486(紫色)和0.487(紫色);在丙酮∶蒸馏水∶氨水(体积比为 6∶1∶1)展开剂条件下,样品Rf值分别为0.502(紫色)和0.504(紫色);在乙醇∶乙酸乙酯∶氨水(体积比为1∶4∶1)展开剂条件下,样品Rf值均为0.499(紫色)。二者展开后所得的斑点形状、颜色均相同,Rf值相近,初步确认此白色结晶物为苦马豆素。
2.3分离物鉴定 分离得到的白色结晶物熔点为145 ℃;紫外-可见全波长扫描(溶剂为丙酮)最大吸收峰为210 nm(图2)。IR 最大吸收峰(KBr压片,cm-1,图3)为3 423.83(-OH吸收峰),2 943.64、2 886.32(均为-CH吸收峰),1 316.25 (-CN吸收峰),1 072.59(C-O吸收峰);2 828.85~2 724.00 cm-1出现的谱带判断为Bohlman Band,说明样品中存在trans CH-N的吸收,与资料报道[9-11]的苦马豆素的两环结构相符合。GC-MS[BSTFA+TMCS(99∶1)衍生处理,质荷比,图4]为173(分子离子峰),155(173-H2O),138(155-OH),113、96、72、43(均为母核裂解碎片峰);质子裂解与资料报道的质谱图一致[9-11]。1HNMR(400 MHz,CDCl3,CDCl3兼做内标):δ1.228(qd,J=4.0和12.8 Hz,H-7ax);δ1.504(qt,J=4.0 和13.2 Hz,H-6ax),δ1.708(br,d,J=13.6 Hz,H-6eq),δ1.918(m,J=3.6和12.8 Hz,H-5ax),δ1.945(m,H-8a),δ2.031(m,H-7eq),δ2.543(dd,J=8.0和11.2 Hz,H-3ax),δ2.868(dd,J=2.0和8.0 Hz,H-3eq),δ2.896(m,H-5eq),δ3.792(td,J=4.4和10.4 Hz,H-8),δ4.245(dd,J=4.0和5.6 Hz,H-1),δ4.340(m,J=2.0和8.0 Hz,H-2),δ7.26(内标)。13CNMR(100 MHz,CDCl3,CDCl3兼做内标):δ25.5(C-6),δ34.8(C-7),δ54.0(C-5),δ62.9(C-7),δ68.7(C-8a),δ71.4(C-8),δ72.0(C-1),δ75.1(C-2),δ77.0(内标),与文献资料报道的苦马豆素核磁谱数据一致[9-11]。
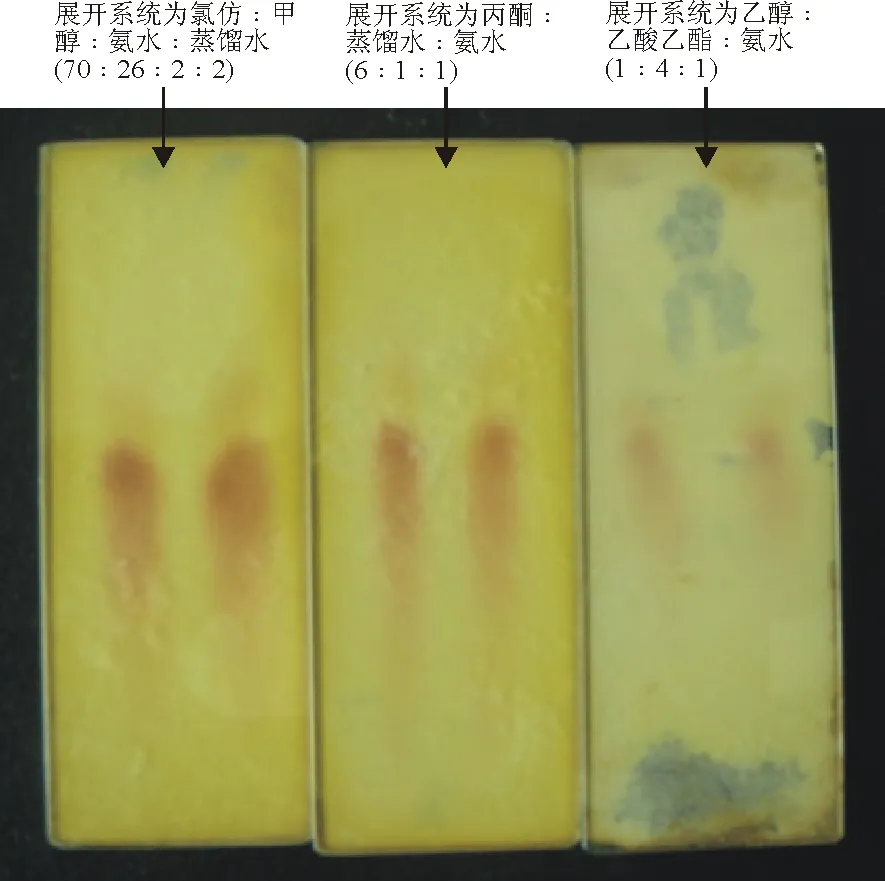
图1 待测样品在3种展开剂中展开并显色
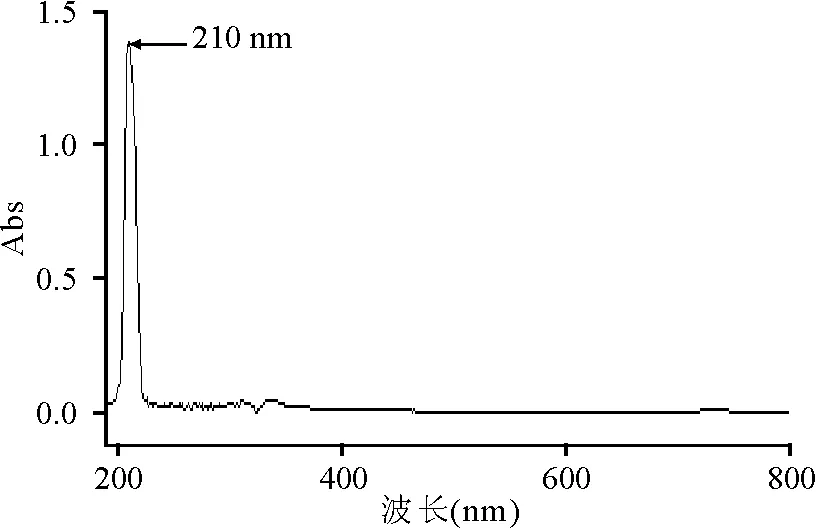
图2 待测样品全波长(190~800 nm)扫描结果
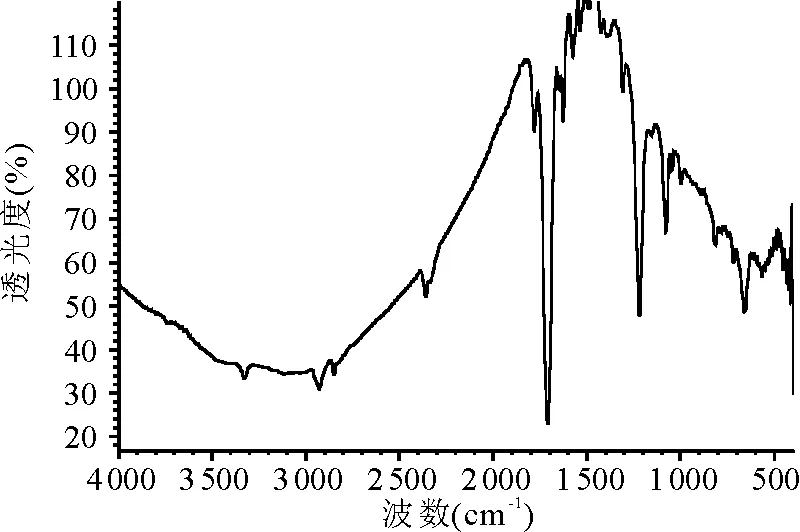
图3 待测样品的红外色谱图
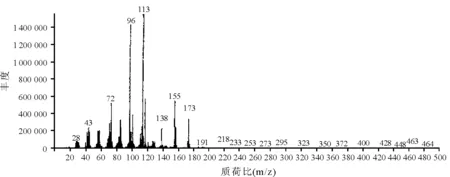
图4 待测样品的质谱图
3 讨论与小结
3.1苦马豆素不同提取方法的比较 苦马豆素的传统提取工艺为大体积的乙醇或甲醇溶液浸提,然后使用一系列极性不同的有机溶剂萃取。整个操作过程耗时长,成本较高[9-10]。本研究采用稀盐酸浸提,阳离子交换树脂分离,无需消耗大量的有机溶剂,提取时间也可大大缩短。另外,苦马豆素的极性较大[9-11],相对于醇类溶剂,苦马豆素更易溶于水。传统方法苦马豆素提取率为14~16 mg/kg[7-8],本方法提取率为19.95 mg/kg,明显高于传统方法。本方法节约了大量有机溶剂,而且在提取过程中没有长时间加热,最大程度的保存了植物中的苦马豆素,适合于批量提取植物中的苦马豆素。
3.2分析化学中不同物质结构鉴定方法的比较 目前有机结构化学中的常见方法有薄层色谱、紫外光谱、红外光谱、质谱和核磁共振等。薄层色谱分析简单快捷,定性准确,常用于分离过程中的适时检测;质谱试验可以得到化合物的分子量,并且通过裂解方式提供分子的结构信息[11-13];对于分子量在1 000以下的化合物一般单用核磁共振分析就可以确定其结构[12];而一些分子量很大,结构也非常复杂的微量成分,若能得到良好的单晶(每边不少于0.1 mm),可单独使用X射线单晶衍射的方法快速确定整个分子的立体结构[12-13]。对于已知化合物鉴定,最方便的方法是找到对照样品及其红外光谱图谱。但本研究的对照品苦马豆素价格昂贵,而文献中关于苦马豆素的红外光谱数据只有几个最大吸收峰[4,7-9],这对于化合物的结构鉴定是不够的。故本研究采用气相色谱分离-质谱测定的方法检测分离样品的分子量,核磁共振图谱检测分离样品的分子结构。
应用乙醇提取,柱层析分离,升华法从小花棘豆草粉中得到99.74 mg白色晶体,提取率为19.95 mg/kg;经薄层色谱、熔点、紫外光谱、红外光谱、质谱、核磁共振鉴定,确定该白色晶体为苦马豆素。
[1]中国科学院植物研究所.中国高等植物图鉴(第二册)[M].北京:科学出版社,2002.
[2]高木木.新疆棘豆属植物研究[D].石河子:石河子大学,2008.
[3]卢萍,赵萌莉,韩国栋,等.小花棘豆毒性的危害与利用[J].草业科学,2009,26(3):97-101.
[4]葛鹏斌,赵宝玉,童德文,等.小花棘豆中苦马豆素的提取分离与结构鉴定[J].中国农学通报,2003,19(1):1-4.
[5]王占新.小花棘豆化学成分、营养成分评价及疯草苦马豆素动态变化规律[D].杨凌:西北农林科技大学,2010.
[6]曾惠玲.中药化学成分提取新技术研究进展[J].海峡药学,2005,17(5):1-3.
[7]王帅,胡建军,阿里木别克,等.南疆地区小花棘豆的营养成分分析[J].草业科学,2010,27(5):136-139.
[8]崔忠华.酶法和气相色谱法测定苦马豆素含量的研究[D].杨凌:西北农林科技大学,2008.
[9]李勤凡,王建华,刘志滨,等.萃取法提取甘肃棘豆中的苦马豆素研究初报[J].中国农学通报,2005,21(5):143-145.
[10]李锡杰,张伟,杨鸣琦,等.金龟子绿僵菌中苦马豆素的分离与鉴定[J].西北农业学报,2010,19(2):35-39.
[11]Cook D,Gardner D R,Grum D,etal.Swainsonine and endophyte relationships inAstragalusmollissimusandAstragaluslentiginosus[J].Jaurnal of Agricultural and Food Chemistry,2011,59(4):1281-1287.
[12]Chooprayoon S,Kuhakarn C,Tuchinda P,etal.Asymmetric total synthesis of (+)-swainsonine[J].Organic and Biomolecular Chemistry,2011,9(2):531-537.
[13]Gardner D R,Cook D.A comparison of alternative sample preparation procedures for the analysis of swainsonine using LC-MS/MS[J].Phytochemical Analysis PCA,2010,22(2):124-127.
