溶解氧对电极生物膜反硝化性能的影响
2011-03-12吕江维冯玉杰
吕江维,刘 佳,沈 宏,冯玉杰
(哈尔滨工业大学城市水资源与水环境国家重点实验室,150090哈尔滨,yujief@hit.edu.cn)
以往大多数研究均认为几乎所有的反硝化细菌都属于兼性好氧菌[1].只有在无分子氧的情况下,它们才利用硝酸盐氮(NO3--N)或亚硝酸盐氮(NO2
--N)进行呼吸.如果反应器中存在溶解氧,即使质量浓度很低,反硝化菌也会优先利用分子氧作为最终的电子受体进行呼吸,从而抑制了反硝化细菌体内硝酸盐还原酶的合成,阻碍了硝酸盐的还原[2].然而pseudomonas spp,alcaligenes faecalis及thiosphaera pantotropha等好氧反硝化细菌[3-6]的发现冲破了这种传统认识.这些细菌在有氧存在的情况下,也能将NO3-或NO2
-转化为氮气[7-10].为了解释好氧反硝化过程,Robert-son[11]提出好氧反硝化是微生物可以同时利用氧气和NO3
-的结果,他认为胞外转化和胞内同化是去除的两种机制.当氧气的质量浓度较高时,好氧反硝化细菌倾向于胞内同化.氧气质量浓度降低,则大部分NO3-在细胞外被转化.Berks[12]等人则从电子传递和硝酸盐还原酶入手研究好氧反硝化.他们指出,由于厌氧反硝化细菌需要利用硝酸盐呼吸产生的质子传动力来维持生长,厌氧反硝化与膜结合酶密切相关.但在好氧反硝化中起主要作用的是周边原生质酶.因为DO会阻止NO3-穿过原生质膜,不能够到达膜结合酶的活性中心,这就抑制了膜结合酶的活性.上述研究都是针对传统的生物反硝化过程[13-16],就电极生物膜系统[17-19]这种新型的脱氮方法而言,有关溶解氧对反硝化性能影响的研究还不够深入.Sakaibara and Araki[20]认为,当基质中含有DO和NO3-时,在以无定形碳为阳极、锈钢为阴极的电极生物膜系统中,阳极首先会使碳氧化成CO2,从而中和了反硝化过程产生的碱度;而在阴极表面,由于氧的还原电位高于氢的还原电位,只有当DO被还原殆尽,即溶解氧质量浓度在电极表面为零,才能产生氢气.也有研究认为[21],在电极生物膜反应器中,从阴极表面逸出的H2能够为生物创造厌氧环境,从而保证反硝化的进行.但是,电极生物膜系统中电极表面的电化学反应和生物化学反应是同时进行的,仅考虑电极反应过程是不完善的.本文测定了电解反应器及生物膜反应器中阴极区DO的质量浓度梯度,并考察了不同DO下电极生物膜系统的反硝化性能.
1 实验
1.1 生物膜培养
根据本实验室以往研究结果对BER系统中石墨阴极上的生物膜进行挂膜和培养.
1.2 电解-电极生物膜(ER&BER)反应系统
ER电解系统中分别以泡沫镍和不锈钢板为阳极和阴极,反应器体积为1.5 L,控制ER反应器电位,使得水在ER反应器内发生电解,产生氧气.BER生物膜系统中电极材料采用石墨,体积为2 L.ER和BER系统与培养液之间以三通阀连接.试验时,通过调节培养液和电解反应器的出口流量,控制进入BER系统的硝酸盐质量浓度和氧气的量(图1).

图1 ER&BER生物膜反应器示意图
1.3 不同溶解氧质量浓度下BER系统内DO质量浓度梯度的变化
采用连续进水方式,控制进入电解系统水的流速为3 L/d及电解系统电流为150 mA.在电解系统DO基本恒定均匀下(质量浓度保持在6.80~6.90 mg/L),打开三通阀,含有较高溶解氧的ER出水与培养液在三通阀处混合,培养液内含220 mg/L的硝酸盐,流速亦为3 L/d,混合后,BER系统进水硝酸盐氮质量浓度为110 mg/L,流速为6 L/d.BER系统的电流强度控制在20 mA.为监测BER系统内DO质量浓度变化,在BER反应器的顶端设置了8个取样口,它们距阴极的距离依次为8、14、35、56、77、98、119和150 mm.系统稳定运行后,每隔2 h在取样口取样,测定DO质量浓度(图2).为了比较电化学法(即无生物膜影响)、生物膜法(即无电化学影响)和电极生物膜法工艺中溶解氧质量浓度变化及其规律,对上述3种系统中的DO质量浓度梯度均进行了测定.
1.4 BER系统内反硝化过程中阴极区溶解氧DO的变化
为避免BER系统中阳极产生的氧气对阴极反应产生干扰,用石棉布将阴阳极隔开.BER的电流强度控制在20 mA,总的反应时间为62 h,整个反应过程中用磁力搅拌器使溶液混合均匀.ER的电流强度先后调节为0、50、150 mA,每2 h测定一次阴极区DO质量浓度、出水的-N和-N质量浓度.硝酸盐氮和亚硝酸盐氮的测定均采用标准分光光度法.

图2 系统溶解氧测定采样口示意图
2 结果和讨论
2.1 不同研究系统内DO质量浓度梯度的变化
研究表明,电解反应器、生物膜反应器和电极生物膜反应器中DO质量浓度梯度呈现不同的变化趋势(图3).在ER系统电流强度为150 mA时,经检测进入BER系统的溶解氧质量浓度保持在6.80~6.90 mg/L.在单纯电解过程中(图3 (a)),阴阳极之间DO质量浓度梯度的差值很小,反硝化进行12 h后,DO的平均值为3.54 mg/ L.但在生物膜反应系统中(图3(b)),DO下降得很快,如反应12 h后,离阴极表面8 mm处的DO质量浓度仅为 0.71 mg/L,远低于 6.80~6.90 mg/L的初始质量浓度,这一结果说明阴极表面生物膜可能存在好氧呼吸过程,致使阴极表面溶解氧质量浓度低于单纯电解过程.
与上述两种体系相比,在电极生物膜反硝化过程中,阴阳极之间的溶解氧质量浓度梯度最大(图3(c)).反应12 h后,阳极表面的DO质量浓度为3.56 mg/L,是3种研究系统中最高的,但是阴极表面的DO质量浓度仅为0.91 mg/L.在电极生物膜系统中除了生物的呼吸作用,阴极还会析出氢气.因此,上述结果应该是生物呼吸和氢气析出的共同作用结果.
2.2 进水中不同溶解氧质量浓度对电极生物膜脱氮效果的影响
调节水电解池的外加电流强度分别为0、50、150 mA,以改变进水的溶解氧质量浓度.每隔2 h测定一次BER系统内阴极区的溶解氧质量浓度和阴极出水的硝酸盐和亚硝酸盐质量浓度(图4).
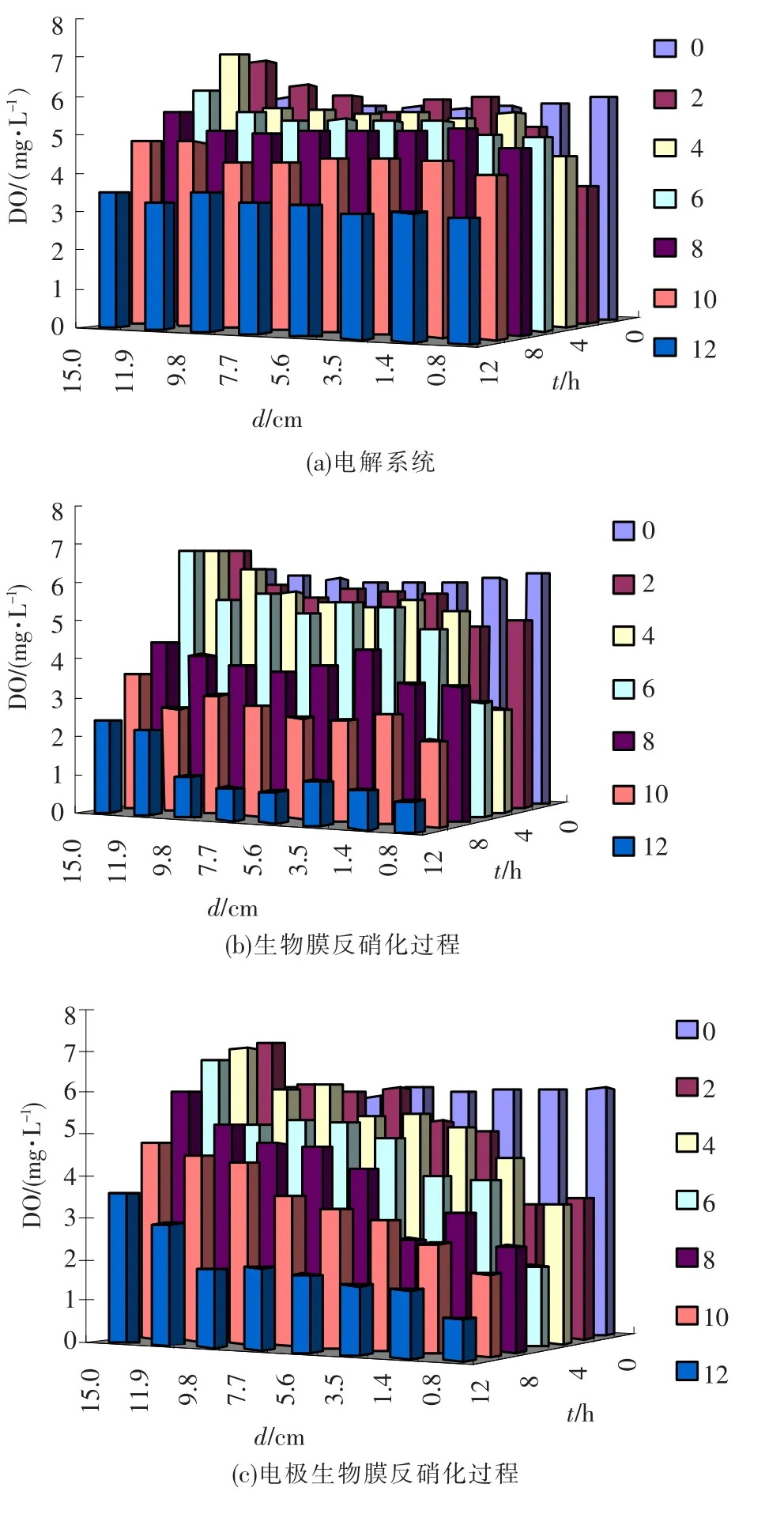
图3 不同反应时间反硝化系统中DO质量浓度梯度变化
ER系统内电流强度的增大必然会使BER系统进水的溶解氧质量浓度增加,经检测进入电极生物膜反应器的溶解氧质量浓度分别为5.54 mg/L(I=0 mA)、6.18 mg/L(I=50 mA)和6.71 mg/L(I=150 mA).由图4可以看出,电极生物膜反应器阴极区的溶解氧质量浓度也略有不同,基本上与进水中的溶解氧质量浓度变化趋势一致.但溶解氧质量浓度的变化对硝酸盐氮降解的影响并不明显,当ER系统电流为0和50 mA时,BER系统出水的硝酸盐氮质量浓度均低于3 mg/L;ER系统电流为150 mA时,BER系统出水硝酸盐氮质量浓度稍高,但也低于7 mg/L.
溶解氧质量浓度对亚硝酸盐的积累情况也有一定的影响.当充氧电流为50 mA时,亚硝酸盐氮的累积最高值为0.65 mg/L.但经接近60 h反硝化后,其质量浓度可以降到0.03 mg/L左右.但在150 mA充氧电流条件下,反应约60 h,亚硝酸盐的出水平均质量浓度为0.23 mg/L左右,比不充氧的自然条件高出0.1 mg/L.说明溶解氧的存在对亚硝酸盐的反硝化过程影响较为明显.

图4 不同供氧质量浓度下电极生物膜系统的变化
2.3 连续改变进水溶解氧质量浓度对电极生物膜脱氮的影响
反应器中硝酸盐氮的初始质量浓度为110 mg/L,使电极生物膜在不充氧的自然条件下反应,电流强度为20 mA.分别在反应进行了23 h和47 h时,将ER系统的电流强度先后变化为50 mA和150 mA,总反应时间为61 h.每隔2 h测一次阴极区的溶解氧质量浓度、出水的硝酸盐质量浓度和亚硝酸盐质量浓度.实验结果见图5.
ER系统电流强度每改变一次,都会使电解生物膜反应器阴极区的溶解氧质量浓度出现小幅度的增长(图5(a)),出水的硝酸盐氮的质量浓度也有所增加,但峰值均小于2 mg/L.但阴极区溶解氧质量浓度和出水硝酸盐氮的质量浓度很快又恢复到较低水平(图5(a)和(b)),反应55 h后,电极生物膜反应器的出水质量浓度稳定在1.0 mg/L左右.连续增加溶解氧的质量浓度对出水亚硝酸盐氮的积累影响不大,其值始终小于0.3 mg/L,远小于美国饮用水标准规定的1 mg/L.

图5 连续改变进水溶解氧质量浓度时电极生物膜系统的变化
3 溶解氧对电极生物膜上生物相变化的影响
分别在ER系统充氧电流为0 mA和150 mA条件下,对生长在生物膜上的微生物相进行透射电镜观察,结果见图6.氧之前,微生物的种类比较丰富,其中0.3~2.0 μm杆菌的数量最多.此外还生长着大量的球菌和弧形菌(图6(a)).电极生物膜系统提供额外的溶解氧后(充氧电流为150 mA),从TEM图像上观察到了一些生物相的改变(图6 (b)),虽然杆菌依然是优势菌种,但是其平均长度仅为0.5 μm.这表明在溶解氧质量浓度较高的环境下,短杆菌的生长最为旺盛.同时,溶解氧质量浓度的提高使得直径在100~200 nm的微球菌大量繁殖.而在未充氧时观察到的生长于电极生物膜上的弧菌,在充氧条件下并未观察到.

图6 电极生物膜系统生物相分析
4 结论
1)在电极生物膜反硝化系统中,电化学反应和微生物的好氧呼吸共同影响着DO的消耗,其中微生物的影响较大.
2)在BER系统中,未发现DO质量浓度变化对硝酸盐氮去除的明显影响,过高的DO质量浓度会增加亚硝酸盐氮的积累.
3)DO质量浓度变化时,TEM观察发现电极生物膜上的生物相发生一些变化.
[1] MCKENNEY D J,DRURY C F,WANG S W.Effects of oxygen on denitrification inhibition,repression,and derepression in soil columns[J].Soil Sci Soc Am J,2001,65(1):126-132.
[2] ZUMFT W G.The prokaryotes:a handbook on the biology of bacteria:ecophysiology isolation identification applications[M].2nd ed.New York:Springer-Verlag,1992:33-45.
[3] SU J J,LIU B Y,LIU C Y.Comparison of aerobic denitrification under high oxygen atmosphere by Thiosphaera pantotropha ATCC 35512 and Pseudomonas stutzeri SU2 newly isolated from the activated sludge of a piggery wastewater treatment system[J].J Appl Microbiol,2001,90(3):457-462.
[4] ROBERTSON L A,KUENEN J G.Aerobic denitrification:a controversy revived[J].Arch Microbiol,1984,139(5):351-354.
[5] TAKAYA N,CATALAN-SAKAIRI M A B,SAKAGUCHI Y,et al.Aerobic denitrifying bacteria that produce low levels of nitrous oxide[J].Applied and Environmental Microbiology,2003,69(6):3152-3157.
[6] ROBERTSON L A,KUENEN J G.Nitrogen removal from water and waste[C]//Microbiol Control of Pollution.Cambridge:Cambridge University Press,1992.
[7] GUPTA A B.Thiosphaeera pantotropha a sulphur bacterium capable of simultaneous heterotrophic nitrification and aerobic denitrification[J].Enzyme and Microbile Technology,1997,21(8):589-595.
[8] GUPTA A B,GUPTA S K.Simultaneous carbon and nitrogen removal in a mixed culture aerobic RBC biofilm[J].Wat Res,1999,33(2):555-561.
[9] KSHIRSAGAR M,GUPTA A B,GUPTA S K.Aerobic denitrification studies on activated sludge mixed with thiosphaera pantotropha[J].Environ Technol,1994,16(1):35-43.
[10] WAN Junfeng,SPERANDIO M.Possible role of denitrification on aerobic granular sludge formation in sequencing batch reactor[J].Chemosphere, 2009,75(2):220-227.
[11] ROBERTSON L A,NEIL van E W J,TORREMANS R A M,et al.Simultaneous nitrification and denitrification in aerobic chemostat cultures of thiosphaera pantotropha[J].Appl Environ Microbiol,1988,54 (11):2812-2818.
[12] BERKS B C,FERGUSON S J,MOIR J W B,et al. Enzymes and associated electron transport systems that catalyse the respiratory reduction of nitrogen oxides and oxyanions[J].Biochim Biophys Acta,1995,1232(3):97-173.
[13] KIM M,JEONG S Y,YOON S J,et al.Aerobic denitrification of pseudomonas putida AD-21 at different C/N ratios[J].Journal of Bioscience and Bioengineering,2008,106(5):498-502.
[14] HUANG H K,TSENG S K.Nitrate reduction by citrobacter diversus under aerobic environment[J]. Appl Microbiol Biotechnol,2001,55(1):90-94.
[15] VANDENBOHEDE A,LOUWYCK A,LEBBE L.I-dentification and reliability of microbial aerobic respiration and denitrification kinetics using a singlewell push-pull field test[J].Journal of Contaminant Hydrology,2008,95(1/2):42-56.
[16] BAEK S H,YIN C R,LEE S T.Aerobic nitrate respiration by a newly isolated phenol-degrading bacterium,alcaligenes strain P5[J].Biotechnology Letters,2001,23(8):627-630.
[17] WATANABE T,KURODA M,PROSNANSKY M. Comparative study on the bio-electrochemical denitrification equipped with a multi-electrode system[J].Water Science&Technology,2005,52(10/ 11):479-485.
[18] PARK H I,KIM J S,KIM D K,et al.Nitrate-reducing bacterial community in a biofilm-electrode reactor[J].Enzyme and Microbial Technology,2006,39(3):453-458.
[19] ZHANG X N,HUANG W M,WANG X,et al.Feasibility and advantage of biofilm-electrode reactor for phenol degradation[J].Journal of Environmental Sciences-China,2009,21(9):1181-1185.
[20] SAKAKIBARA Y,ARAKI K,WATANABE T,et al.The denitrification and neutralization performance of an electrochemically activated biofilm reactor used to treat nitrate-contaminated groundwater[J].Wat Sci Tech,1997,36(1):61-68.
[21] ISLAM S,FLORA J R V,SUIDAN M T,et al.Enhancement and control of denitrification using a biofilm-electrode reactor[C]//Proceedings of the 1993 Water Environment Federation Conference. Anaheim:[s.n.],1993.
