改良法分离培养人牙周膜干细胞
2011-03-07申涛常慧君简从相杨彦春周继祥
申涛 常慧君 简从相 杨彦春 周继祥
(1.第三军医大学西南医院 口腔科,重庆 400038;2.四川省军区门诊部 口腔科,成都 610041)
改良法分离培养人牙周膜干细胞
申涛1常慧君2简从相1杨彦春1周继祥1
(1.第三军医大学西南医院 口腔科,重庆 400038;2.四川省军区门诊部 口腔科,成都 610041)
目的 改良法体外分离培养人牙周膜干细胞(PDLSC),并进行鉴定。方法 采用酶消化组织块法获得人牙周膜细胞,通过有限稀释法克隆化培养、分离得到PDLSC,用含10%FBS的α-MEM培养液培养并传代;测定克隆形成率;免疫组织化学检测角蛋白及波形蛋白表达;流式细胞术分析细胞周期及表面标志物STRO-1、CD146的表达;并进行成骨、成脂诱导实验。结果 本研究所得细胞有较强的克隆形成能力,波形蛋白染色阳性,角蛋白阴性,细胞周期分析大多细胞处于G0/G1期,STRO-1及CD146高表达,成骨、成脂诱导实验证明所得细胞有多向分化能力。结论 改良法克隆化培养可成功分离得到PDLSC,为进一步研究PDLSC奠定了基础。
人牙周膜干细胞; 鉴定; 细胞克隆
随着干细胞研究的不断深入,越来越多的组织中发现有干细胞存在。近年证实,人牙周膜组织中也存在干细胞[1],即牙周膜干细胞(periodontal ligament stem cells,PDLSC)。研究[1-3]发现:PDLSC具有较强的克隆形成能力,体外诱导可分化为成骨细胞、成脂细胞、成软骨细胞及神经元样细胞,在体内可形成牙骨质/牙周膜样结构。牙周膜组织中的干细胞数量较少,且缺乏特定的标志物,文献亦未见特殊有效的分离方法报道。本研究在既往PDLSC分离纯化方法的基础上,进行了探索和改良,利用有限稀释法克隆化培养,对人PDLSC进行分离纯化,并证实所得细胞具有干细胞特性,为PDLSC的进一步研究和应用打下基础。
1 材料和方法
1.1 实验材料
α-MEM培养液(Hyclone公司,美国),胎牛血清(Hyclone公司,美国),Ⅰ型胶原酶(Gibco公司,美国),0.25%胰蛋白酶(Hyclone公司,美国);小鼠抗人AF647-STRO-1和PE-CD146流式抗体(Biolegend公司,美国),小鼠抗人Vimentin单抗(BD公司,美国),小鼠抗人pan-Cytokeratin单抗(Santa公司,美国),Envision免疫组织化学试剂盒(Dako公司,丹麦),BSA(Sigma公司,美国);成骨及成脂诱导培养液(Cyagen公司,美国)。
1.2 人牙周膜干细胞的分离培养
1.2.1 人牙周膜细胞原代培养 取12~24岁之间因正畸或阻生而拔除的牙体牙周均健康的新鲜牙齿,用含双抗PBS反复冲洗,冠根单向刮取根中三分之一的牙周膜,修剪组织块为1mm3大小,1mg·mL-1Ⅰ型胶原酶37℃消化40min后,将组织块均匀平铺于6孔板内,上盖无菌玻片,加入少量α-MEM培养液(含10%FBS、100 U·mL-1青霉素和100μg·mL-1链霉素),放入37℃、5%CO2培养箱,每3 d换液,细胞长至孔底60%左右时,胰酶消化。
1.2.2 有限稀释法克隆化培养分离人牙周膜干细胞将消化的牙周膜细胞悬液计数,并调整细胞密度为每毫升30、10和5个,将3种密度的细胞悬液吹打均匀,种于96孔板,每孔100μL,放入37℃、5% CO2培养箱,8~12 h后镜下观察标记单个细胞孔,并补液200μL,5 d换液,待标记孔克隆长至孔底40%左右时,胰酶消化,扩大培养。
1.3 人牙周膜干细胞的鉴定
1.3.1 克隆形成实验 将消化的牙周膜细胞悬液计数,分别取200、500、800个细胞接种于3个直径10 cm培养皿中,各加入20mLα-MEM培养液(含10%FBS、100 U·mL-1青霉素和100 U·mL-1链霉素),十字摇匀,放入37℃、5%CO2培养箱,静置培养。3周后终止培养,纯甲醇固定15min,姬姆萨工作液染色20min,计数并测定克隆形成率。
1.3.2 免疫组织化学染色 取第4代PDLSC制备细胞爬片,PBS漂洗,预冷4%多聚甲醛固定20min,免疫组织化学Envision法角蛋白、波形蛋白染色,进行细胞来源鉴定,空白对照用PBS代替一抗,光镜观察。
1.3.3 流式细胞术分析 收集第4代PDLSC,加入无血清α-MEM培养基,制备单细胞悬液,调整细胞密度为每毫升3×107个,分别加入4支EP管,每管100μL,分别加入小鼠抗人STRO-1、CD146及同型对照单抗,4℃避光孵育45min,PBS漂洗,流式细胞仪检测。
收集第4代PDLSC约3×106个,制备单细胞悬液,离心后加入预冷的70%乙醇1.5mL吹打混匀,4℃过夜,离心弃乙醇,PBS洗,加入50μg·mL-1的碘化丙锭1mL,4℃染色30min,过200目尼龙筛网,流式细胞仪进行细胞周期分析。
1.3.4 多向诱导分化实验 取第4代PDLSC,制备单细胞悬液并计数,成骨诱导按每孔1×104个细胞、成脂诱导按每孔5×104个细胞接种于24孔培养板内,孔底预置无菌玻片,待48~72 h细胞贴壁长满后分别更换成骨、成脂诱导培养液,按说明书进行培养诱导。3周后吸去诱导液,10%中性甲醛固定,茜素红、油红O染色,光镜观察。
2 结果
2.1 人牙周膜干细胞的形态特征
原代培养4~12 d组织块周围开始有牙周膜细胞爬出,为长梭形或不规则形,约2~3周细胞长满孔底60%。96孔培养板克隆化培养10 d左右可出现细胞克隆,2~4周克隆可长至孔底40%以上,所得细胞即为PDLSC,形态与牙周膜细胞相似,为梭形、多角形或不规则形,体积稍小,呈漩涡状或放射状排列(图1)。

图1 PDLSC的形态特征Fig 1 Morphology of PDLSC
2.2 人牙周膜干细胞的鉴定
2.2.1 克隆形成率 3周后,镜下可见克隆形成,细胞体积小,排列紧密,克隆中心细胞密度最大,界限不清,为圆形、椭圆形或不规则状,边缘细胞为长梭形。染色后可见克隆为蓝色,计数并测得克隆形成率为13.87%,说明该细胞在体外具有较强的克隆形成能力(图2左)。
2.2.2 免疫组织化学染色 分离培养的PDLSC其波形蛋白染色阳性,角蛋白阴性,说明所得细胞为间充质来源,无上皮细胞污染(图2中、右)。
2.2.3 流式细胞术分析 流式细胞术表型分析单标STRO-1阳性率为89.94%,单标CD146阳性率为90.47%,STRO-1和CD146双标阳性率为82.10%,说明所得PDLSC表达间充质干细胞早期标志物;细胞周期分析显示G0/G1期细胞为80.04%,G2期细胞为9.53%,S期细胞为10.43%,表明PDLSC具有慢周期性的特点(图3)。
2.2.4 多向诱导分化 成骨诱导培养10 d后细胞逐渐变成方形或多角形,3周后可见矿化结节,茜素红染色阳性(图4左);成脂诱导3周后,镜下可见脂滴形成,油红O染色阳性(图4右)。
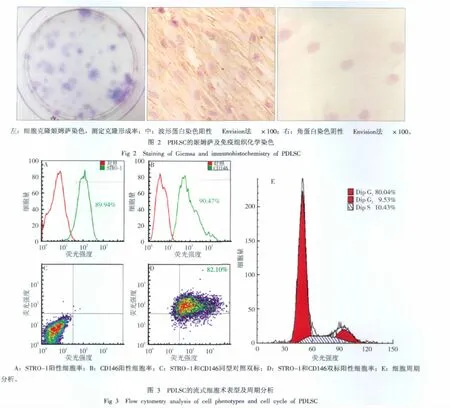

图4 PDLSC诱导3周后染色Fig 4 Staining of PDLSC after 3-week osteogenic and adipogenic induction
3 讨论
牙周膜细胞为间充质来源,且具有异质性[4],其中某些细胞具有成体干细胞的特点,在牙周组织的修复再生和功能稳定中发挥着重要作用。近来有学者利用骨髓间充质干细胞(mesenchymal stem cells,MSC)早期标志物STRO-1从牙周组织中成功分离了具有干细胞特征的细胞群,并命名为PDLSC[1-2]。研究[1-2,5-6]发现:PDLSC除了表达STRO-1以外,还表达CD146、SH2、SH3、SH4、CD105、CD44、CD29、VCAM-1、ALP、α-平滑肌动蛋白等一系列的细胞表面标志物。但由于目前尚未发现PDLSC的特异性标志物,那么这仅表明用抗STRO-1分离所得细胞群富含干细胞,里面可能还包括一些其他前体细胞[7],如果要得到高度纯化的PDLSC,必须联合使用多种抗体[8],或者选用其他分离方法,如有限稀释法。有限稀释法是采用梯度倍数稀释的原则,将细胞悬液连续倍数稀释至极低密度,然后接种于微孔培养板,培养一定时间后,微孔中可出现单个细胞克隆[9],扩大培养后可以得到性质均一的细胞群。故理论上有限稀释法克隆化培养所得PDLSC的生物学特性更均一,更利于对该细胞群的进一步研究。
本研究采用酶消化组织块法原代培养人牙周膜细胞,与其他方法相比,不仅操作简单,需要组织量少,而且有较高的成功率[10-11];使用较低浓度Ⅰ型胶原酶短时间消化,既松散了组织,利于细胞游出,也降低了酶对细胞的不良影响;使用玻片覆盖,提高了组织块的贴壁率,进而利于获得人牙周膜细胞。有限稀释法克隆化培养时,为了减少细胞计数及倍数稀释过程中的误差,设置了3种细胞接种密度,提高了单个细胞孔的出现机率;在接种12 h内完成镜下单个细胞孔的标记,避免了活性较好的细胞分裂,从而得到严格意义上的细胞克隆。本研究所得细胞免疫组织化学染色波形蛋白阳性,角蛋白阴性,说明所得细胞为间充质来源,且无上皮细胞的污染;STRO-1和CD146是鉴定PDLSC常用的2个标志物[1,6],流式细胞术分析发现二者阳性率均在90%左右,双标阳性率亦大于80%,表明其具有PDLSC的表型特征。
克隆形成能力和慢周期性是干细胞的重要特征。MSC和牙周膜细胞在极低密度培养条件下,可表现出很强的自我复制能力并形成克隆[1],这表明MSC和牙周膜细胞或者说其中的某群细胞具有很强的增殖能力,具有从一个单细胞形成克隆的潜能。Digirolamo等[12]研究得出,培养细胞在低密度条件下生长时,其自我复制的潜能可以通过克隆形成率很好地反映出来,克隆形成率越高,其增殖能力越强。本研究测得牙周膜细胞具有较高的克隆形成率,提示其中的某群细胞具有干细胞特征。但此结果与Seo等[1]、高秦等[13]有较大差异,与潘峰等[14]结果相近,这可能与细胞个体来源、分离培养方式、测定方法等差异有关。通常状况下,干细胞处于一种慢周期状态,当组织损伤修复时,它们的增殖速度可迅速提高。本研究发现PDLSC绝大部分处于G0/G1期,说明其具有慢周期性的特点。
PDLSC具有多向分化的能力,它不仅可以分化为来源组织的细胞,而且还可以横向分化为其他谱系的细胞[1-3]。PDLSC存在于体内牙周膜组织的微环境中,在周围组织细胞分泌的各种因子作用下,保持其干细胞特性不变;而在体外如何保持其未分化状态是分离培养成功的关键,也是目前体外研究的一个难点。高秦等[13]在克隆化培养过程中收集牙周膜细胞的培养上清,与基础培养基混合作为适应性培养液,以利保持PDLSC未分化状态。但由于目前干细胞分化的调节机制尚不清楚,本研究发现:不采用适应性培养液,亦可得到PDLSC,从而便于操作,减少了污染机率,并且在特定培养条件下,亦可成功将其诱导为成骨细胞和成脂细胞,证明所得PDLSC具有多向分化的能力。但是,随着体外扩增和连续传代,PDLSC这个细胞群可能会变得不均一[15],逐渐丢失一些干性,甚至老化,所以如何在体外完全保持干细胞特性还需要进一步研究。
综上所述,改良法克隆化培养可以得到纯化的PDLSC,为进一研究PDLSC奠定了基础,也为牙周组织工程获得理想的种子细胞提供了可靠的方法。
[1] Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet, 2004,364(9429):149-155.
[2] Gay IC,Chen S,MacDougall M.Isolation and characterization of multipotent human periodontal ligament stem cells[J].Orthod Craniofac Res,2007,10(3):149-160.
[3] Techawattanawisal W,Nakahama K,Komaki M,et al.Isolation of multipotent stem cells from adult rat periodontal ligament by neurosphere-forming culture system[J].Biochem Biophys Res Commun,2007,357(4):917-923.
[4] Lekic P,Rojas J,Birek C,et al.Phenotypic comparison of periodontal ligament cells in vivo and in vitro[J].J Periodontal Res, 2001,36(2):71-79.
[5] Lin NH,Menicanin D,Mrozik K,et al.Putative stem cells in regenerating human periodontium[J].J Periodontal Res,2008,43(5):514-523.
[6] Ivanovski S,Gronthos S,Shi S,et al.Stem cells in the periodontal ligament[J].Oral Dis,2006,12(4):358-363.
[7] Kramer PR,Nares S,Kramer SF,et al.Mesenchymal stem cells acquire characteristics of cells in the periodontal ligament in vitro [J].J Dent Res,2004,83(1):27-34.
[8] Gronthos S,Zannettino AC,Hay SJ,et al.Molecular and cellular characterisation of highly purified stromal stem cells derived from human bone marrow[J].J Cell Sci,2003,116(Pt 9):1827-1835.
[9] 司徒镇强,吴军正.细胞培养[M].西安:世界图书出版公司, 2007:249-251.
SITU Zhen-qiang,WU Jun-zheng.Cell culture[M].Xi’an:World Publishing Corporation,2007:249-251.
[10]彭庭莉,杨军,周继祥,等.不同张应力对体外培养的人牙周膜成纤维细胞形态和纤维型肌动蛋白改变的影响[J].第三军医大学学报,2005,27(9):898-900.
PENG Ting-li,YANG Jun,ZHOU Ji-xiang,et al.Effects of different tension stress on the shape and F-actin of human peridontal ligament fibroblast in vitro[J].Acta Academiae Medicinae Militaris Tertiae,2005,27(9):898-900.
[11]汤楚华,施生根,牛忠英,等.酶消化组织块法原代培养人牙周膜成纤维细胞的初步研究[J].中华医学杂志,2004,84(8):656-658.
TANG Chu-hua,SHI Sheng-gen,NIU Zhong-ying,et al.Primary culture of human periodontal ligament fibroblasts by explants with enzymatic digestion[J].Chin JMed,2004,84(8):656-658.
[12]Digirolamo CM,Stokes D,Colter D,et al.Propagation and senescence of human marrow stromal cells in culture:A simple colony-forming assay identifies samples with the greatest potential to propagate and differentiate[J].Br J Haematol,1999,107(2):275-281.
[13]高秦,刘宏伟,金岩,等.人牙周膜干细胞的体外分离、纯化及初步鉴定[J].实用口腔医学杂志,2006,22(1):34-37.
GAO Qin,LIU Hong-wei,JIN Yan,et al.Isolation,purification and identification of human periodontal ligament stem cells[J].J Pract Stomatol,2006,22(1):34-37.
[14]潘峰,丁寅,王光,等.人牙周膜干细胞的分离培养及生物学特性研究[J].中国美容医学,2008,17(5):697-700.
PAN Feng,DING Yin,WANG Guang,et al.Isolation,identification and bionomics of human periodontal ligament stem cells[J]. Chin J Aesth Med,2008,17(5):697-700.
[15] Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
(本文编辑 汤亚玲)
Isolation and identification of human periodontal ligament stemcells in vitro
SHEN Tao1,CHANG Hui-jun2,JIAN Cong-xiang1,YANG Yan-chun1,ZHOU Ji-xiang1.(1.Dept.of Stomatology,Southwest Hospital,The Third Military Medical University,Chongqing400038,China;2.Dept.of Stomatology,Out-patient Department of Sichuan Military Area Command,Chengdu610041,China)
ObjectiveTo isolate and identify human periodontal ligament stem cells(PDLSC)by improved methods and assess the characteristics of PDLSCex vivo.MethodsThe periodontal ligament cells were obtained from the healthy impacted third molars and teeth extracted for orthodontic purposes and used to isolate PDLSC by limiting dilution assay.PDLSC were cultured and expanded inα-MEM supplemented with 10%FBS.Colony-forming assay, immunohistochemistry,flow cytometry,osteogenic and adipogenic induction were used to identify PDLSC.Results The obtained cells had high colony-forming efficiency and were positive staining for vimentin and negative for pancytokeratin.Flow cytometry revealed that the isolated cells were positive for STRO-1 and CD146 antibodies and most were in the G0/G1phase of cell cycle.Under specific conditions,they could differentiate to the osteoblast and adipocyte lineagesin vitro.ConclusionLimiting dilution assay is an effective method to isolate PDLSC and the single-cell-derived colonies demonstrate the properties of stem cellsin vitro.
human periodontal ligament stem cells; identification; cell clone
R 781.4
A
10.3969/j.issn.1000-1182.2011.01.017
1000-1182(2011)01-0071-04
2010-05-22;
2010-07-20
国家自然科学基金资助项目(30870599)
申涛(1982—),男,河北人,硕士
周继祥,Tel:023-68754387
