利用Cre/loxP系统构建无标记的htrA基因缺失的变链菌突变株
2011-02-28张文娟于丹妮韩育植任志明
张文娟 于丹妮 韩育植 任志明
龋病是影响人类健康的三大疾病之一,其主要致病菌是变异链球菌(Streptococcus mutans,S.mu⁃tans,以下简称变链菌)。变链菌是牙菌斑生物膜的重要组成成分,在人类口腔中占有重要的生态地位。对变链菌致龋机制尤其是对其致病因子的研究一直是口腔医学领域的热点。HtrA(high tempera⁃ture requirement A)蛋白是一种热休克诱导的丝氨酸蛋白酶,它具有分子伴侣和蛋白酶的双重功能,其主要的作用是帮助细菌在高温、低pH值和氧化应激等不良环境下生长。在革兰阳性菌中,HtrA蛋白参与了许多具有致病性的表面蛋白的合成[1-2],而且HtrA蛋白已被证明是肺炎链球菌的毒力因子[3]。因此,HtrA蛋白可能在变链菌的致龋过程中发挥着重要的作用。本研究拟构建HtrA蛋白编码基因htrA缺失的变链菌突变株,为进一步明确HtrA蛋白在变链菌致龋过程中的作用机制提供实验菌株。
1 材料与方法
1.1 材料 变链菌国际标准株UA159(Ingbritt,血清C型),购自四川大学华西口腔医学中心;含卡那霉素(Km)抗性基因的质粒pUC4ΩKm2由美国马里兰大学Kevin McIver教授惠赠;质粒pCrePA由美国堪萨斯大学Indranil Biswas教授惠赠;pGEM-T-Easy TA载体和T4 DNA连接酶(Promega北京);大肠杆菌DH5α由本实验室保存;氨苄青霉素、卡那霉素、红霉素粉剂(中国药品生物制品检定所标准产品);T4 DNA聚合酶、限制性内切酶BaeⅠ和PflMⅠ(NEB公司);细菌基因组提取试剂盒、质粒小提试剂盒、小量胶回收试剂盒(Biomiga);Taq PCR Master Mix试剂盒、pfu PCR Master Mix试剂盒、DNA分子质量MarkerⅢ、Marker DL15000、MarkerⅦ(天根,北京);TSA琼脂平板、TPY液体培养基、LB培养基由本实验室配制。所有引物均由上海生工生物公司合成;DNA测序由华大基因(北京)公司完成。
1.2 方法
1.2.1 细菌培养 -20℃保存的变链菌国际标准株于常温下复苏,接种于胰蛋白胨大豆琼脂培养基(TSA)固体平板,于37℃厌氧条件下(85%N2、10%H2、5%CO2)培养24 h,形态学和生化鉴定后挑取单个菌落接种于10 mL TPY液体培养基中静置培养24 h增菌。含质粒的大肠杆菌接种于LB平板或液体培养基中于37℃恒温摇床中孵育。
1.2.2 PCR扩增目的基因 (1)采用细菌基因组提取试剂盒,按试剂盒说明提取变链菌标准株基因组DNA。使用紫外分光光度计测定所提变链菌基因组DNA的浓度和纯度,纯度用比值A260/A280表示(A为吸光度),1%琼脂糖凝胶电泳80 V,40 min检测其分子质量大小,置-20℃保存备用。(2)以变链菌基因组DNA为模板,与引物P1(5-gactagcattatttggaattttctcatc⁃gg-3)和P2(5-gaggtgagatatgaagacaacttcgttgac-3),进行PCR扩增包含整个htrA基因在内的1.9 kb的DNA片段。PCR反应条件为94℃5 min,94℃1 min,53℃1 min,72℃1 min,72℃15 min,共30个循环。以质粒pUC4ΩKm2为模板,PCR扩增Km抗性基因,引物为loxP-Km-F(5-cgATAACTTCGTATA⁃ATGTATGCTATACGAAGTTATgaggatgaagaggatgaggaggcag-3,大写字母为loxP位点)和loxP-Km-R(5-cgATAACTTCG⁃TATAGCATACATTATACGAAGTTATgctttttagacatctaaatctagg-3),PCR反应条件为94℃5 min,94℃30 s,52℃30 s,72℃1 min,72℃10 min,共30个循环。扩增产物分别用1%琼脂糖凝胶电泳鉴定,采用小量胶回收试剂盒纯化回收。
1.2.3 htrA基因片段克隆到pGEM-T-Easy TA载体 将扩增的htrA基因片段连接入pGEM-T-Easy TA克隆载体内,采用T4 DNA连接酶于4℃过夜,电转化大肠杆菌DH5α感受态细胞,将菌液涂布于氨苄青霉素(100 mg/L)抗性的LB平板上,37℃培养,过夜,挑取阳性克隆增菌后提取质粒,得到重组质粒pGEM-T-htrA,NotⅠ酶切鉴定。
1.2.4 Km抗性基因盒(loxP-Km-loxP)替换htrA基因的部分序列 采用限制性内切酶BaeⅠ、PflMⅠ双酶切重组质粒pGEM-T-htrA(该酶切位点均在htrA基因内),并采用T4 DNA聚合酶使末端平齐化,1%琼脂糖凝胶电泳,切胶,纯化回收分子质量较大的片段。采用T4 DNA连接酶于4℃过夜,将大片段与loxP-Km-loxP连接,连接产物电转化入大肠杆菌DH5α感受态细胞,将菌液涂布于氨苄青霉素和Km(50 mg/L)抗性的LB平板上,37℃过夜培养,挑取阳性菌株增菌后提取质粒,得到htrA基因缺失的同源重组载体pIB△htrA-Km,NotⅠ酶切及DNA测序鉴定。
1.2.5 带Km抗性的htrA基因缺陷株的构建 采用限制性内切酶NotⅠ酶切质粒pIB△htrA-Km,1%琼脂糖凝胶电泳,切胶纯化回收小片段,并将该小片段电击转化感受态变链菌标准株,将菌液涂布于Km(300 mg/L)抗性的TSA平板上37℃厌氧培养48 h,挑取阳性菌株于TPY培养液中增菌后提取基因组DNA,利用引物对P3(5-aataacgaaggtcaaatcagaa-3)和P4(5-atatctttagtattaagatatt-3)进行PCR鉴定,并以标准株为对照。
1.2.6 Cre重组酶介导的Km抗性基因的删除 将Cre重组酶表达质粒pCrePA电转化感受态的带Km抗性的htrA基因缺陷株,将菌液涂布于含红霉素(Em,10 mg/L)的TSA平板上,30℃过夜培养,筛选得到阳性转化株。再将阳性转化株平行接种于含Em、Km的TSA平板和只含Em的TSA平板,30℃培养48 h,筛选出Em抗性、Km敏感的菌株。将该菌株平行接种于含Em的TSA平板和不含抗生素的TSA平板,37℃过夜培养,筛选得到Em敏感的菌株。选择10个菌株,利用引物对P3/P4进行PCR分析及DNA测序鉴定,鉴定出的突变株即为无标记的htrA基因缺陷株。
2 结果
2.1 PCR产物的分子质量鉴定 本研究以变链菌国际标准株全基因组DNA为模板扩增出的包含基因htrA的DNA片段大小约为1.9 kb,Km抗性片段大小约为1.5 kb,见图1。未见非特异性扩增及拖尾现象,分子质量大小与预计大小相同。

图1 PCR扩增片段琼脂糖凝胶电泳图
2.2 重组质粒pGEM-T-htrA的酶切鉴定 采用限制性内切酶NotⅠ酶切重组质粒pGEM-T-htrA后(htrA基因克隆位点两侧均有NotⅠ酶切位点),1%琼脂糖凝胶电泳鉴定,结果可见2条各为3.0 kb和1.9 kb的条带,分别与空载体和扩增片段的预期大小一致,见图2。
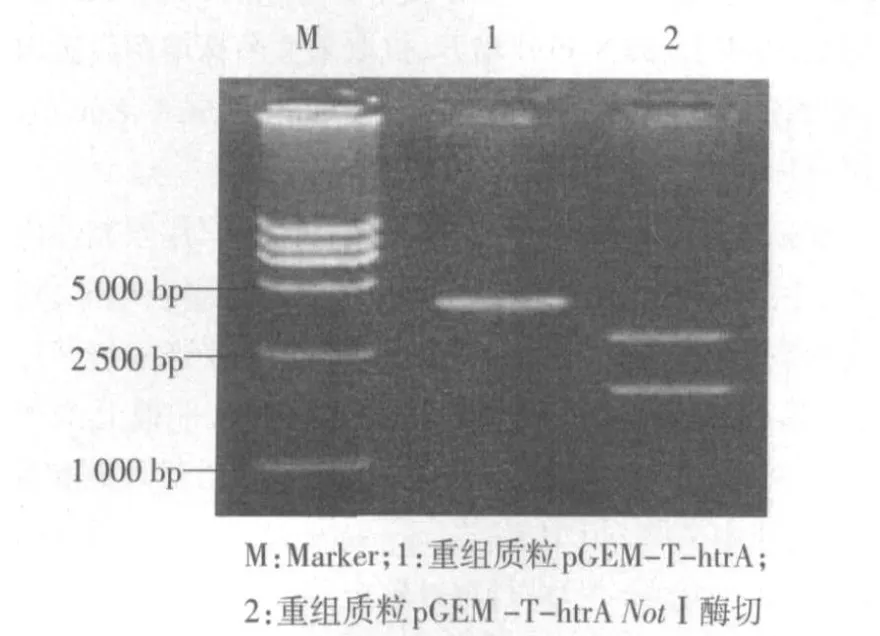
图2 pGEM-T-htrA NotⅠ酶切琼脂糖凝胶电泳图
2.3 htrA基因缺失的同源重组载体pIB△htrA-Km的鉴定 限制性内切酶BaeⅠ和PflMⅠ双酶切pGEM-T-htrA(BaeⅠ和PflMⅠ酶切位点都位于htrA基因内),得到大片段4 108 bp和小片段818 bp,见图3,大片段与loxP-Km-loxP连接转化后,含目的质粒的大肠杆菌可在含有Km的LB培养基内生长良好,证明Km基因正确表达,大片段与loxP-Km-loxP正确连接。NotⅠ酶切载体pIB△htrA-Km后,1%琼脂糖凝胶电泳可见2条带分别为2 981 bp和2 627 bp,与预期大小一致,见图4。DNA测序结果与已获得的预期序列比较,未见碱基突变的发生,说明同源重组载体构建成功。
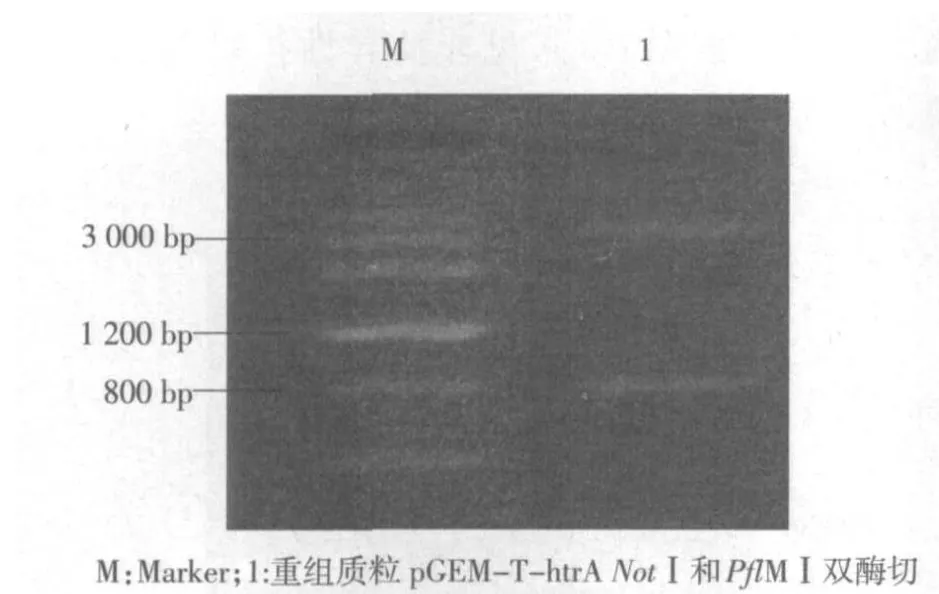
图3 pGEM-T-htrA双酶切琼脂糖凝胶电泳图
2.4 带Km抗性的htrA基因缺陷株的鉴定 质粒pIB△htrA-Km的小片段电转化变链菌标准株后,筛选出的菌株可在含Km的TSA及TPY培养基中生长较好,说明Km抗性基因正确重组到变链菌标准株的基因组中,并正确表达。PCR鉴定结果,见图5,标准株扩增片段为2 250 bp,带Km抗性的htrA基因缺陷株扩增片段为2 932 bp,条带单一清楚,分子质量大小与预期大小相符。

图4 pIB△htrA-Km NotⅠ酶切琼脂糖凝胶电泳图

图5 标准株与突变株PCR扩增片段琼脂糖凝胶电泳图
2.5 无标记的htrA基因缺陷株的鉴定 与变链菌标准株和带Km抗性的htrA基因缺陷株相比,选择的10个菌株中有2个菌株PCR扩增的条带大小为1 500 bp,与预期大小一致,见图6。DNA测序显示htrA基因部分序列已被删除,并无Km抗性基因,该位点只留有一个loxP位点。

图6 无标记突变株PCR扩增片段琼脂糖凝胶电泳图
3 讨论
变链菌要在口腔环境中生存定植,必须适应复杂多变的口腔环境。这需要多种蛋白酶的参与,其中重要的一种是HtrA蛋白。HtrA蛋白是丝氨酸蛋白酶家族成员,在细菌的耐热特性中发挥着重要的作用,当环境温度升高时,它可参与细胞质内异常蛋白的降解[1-2]。在革兰阳性菌中,HtrA蛋白在细菌的致病过程中发挥了重要作用。对肺炎链球菌的研究表明,HtrA蛋白的编码基因htrA缺失时,3种重要的毒力因子PspA、NanA和LytA的表达均显著下降[4]。在金黄色葡萄球菌中,htrA基因缺失后可影响较多致病因子的分泌和表达[5]。
在变链菌中,有7种不同的细胞外或细胞壁相关蛋白的表达皆受htrA基因的调控[6]。Biswas等[7]认为,HtrA蛋白可影响变链菌糖酵解有关的细胞外酶,从而进一步影响变链菌生物膜的形成能力,最终影响变链菌的致龋能力。为了更好地研究变链菌中HtrA蛋白的生物学功能及其致龋机制,本研究利用双交换同源重组原理,使loxP-Km-loxP替换htrA基因内的部分序列,成功构建出htrA基因缺陷株。在这种框内缺失突变株的构建中,抗性基因盒的存在可因抗性的获得而易于选择。但是,这些基因盒带有异源基因(抗性标记),如果这些标记被广泛应用于选择转化子,它们可能会产生无法预知的有害影响[8]。因此,本研究利用Cre/loxP位点特异性重组系统删除Km抗性标记。
Cre/loxP重组系统是一种有力的DNA重组工具。它来源于噬菌体P1,由Cre重组酶和loxP位点2部分组成。Cre重组酶属于位点专一性重组酶的整合酶家族。loxP位点是一种典型的回文序列结构,长34 bp,包括两侧的2个13 bp的反向重复序列和中间的8 bp的非对称间隔序列。Cre重组酶识别并结合两侧的13 bp反向重复序列并介导中间的8 bp间隔区发生重组,它不需要任何宿主辅助因子和辅助蛋白[9]。在Cre酶的介导下,当2个loxP位点位于同一个分子上且方向相同时,loxP位点之间的DNA片段可被删除,只留下一个loxP位点[10]。
本研究利用Cre/loxP系统的删除基因的原理,通过设计引物PCR扩增将2个同向的loxP位点锚定在Km抗性基因的两端,构建出Km抗性基因盒loxP-Km-loxP,为Km抗性基因的删除做好准备。另外,cre基因的表达质粒需具有2个重要的特点:(1)含有一个抗性基因作为筛选标记。(2)含有一个热敏复制子,以利于消除cre表达质粒。本研究使用质粒pCrePA,它含有Em抗性基因和热敏复制子pWV01[11],其允许、限制温度分别是30℃和37℃。pCrePA电转化变链菌后,30℃培养,Em抗性筛选出转化株,Cre重组酶表达并删除Km抗性基因;37℃培养,pCrePA不能复制,因而被消除。
最后DNA测序证明本研究成功构建出无标记的htrA基因缺失的变链菌突变株,为进一步研究htrA基因的功能,明确HtrA蛋白在变链菌致龋中的调控作用及分子机制奠定了实验基础。目前关于变链菌标准株和突变株的相关功能差异研究正在进行中。
[1]Faccio L,Fusco C,Chen A,et al.Characterization of a novel human serine protease that has extensive homology to bacterial heat shock endoprotease HtrA and is regulated by kidney ischemia[J].J Biol Chem,2000,275(4):2581-2588.
[2]Vaux DL,Silke J.Mammalian mitochondrial IAP binding proteins [J].Biochem Biophys Res Commun,2003,304(3):499-504.
[3]Hava DL,Camilli A.Large-scale identification of serotype 4 Strep⁃tococcus pneumoniae virulence factors[J].Mol Microbiol,2002,45 (5):1389-1406.
[4]黄远帅,许颂霄,朱旦,等.HtrA基因缺陷对肺炎链球菌毒力影响的研究[J].第四军医大学学报,2006,27(17):1542-1546.
[5]Rigoulay C,Entenza JM,Halpern D,et al.Comparative analysis of the roles of HtrA-like surface proteases in two virulentStaphylococ⁃cus aureusstrains[J].Infect Immun,2005,73(1):563-572.
[6]Diaz-Torres ML,Russell RR.HtrA protease and processing of extra⁃cellular proteins of Streptococcus mutans[J].FEMS Microbiol Lett, 2001,204(1):23-28.
[7]Biswas S,Biswas I.Role of HtrA in surface protein expression and biofilm formation by Streptococcus mutans[J].Infect Immun,2005, 73(10):6923-6934.
[8]Raynal A,Karray F,Tuphile K,et al.Excisable cassettes:new tools for functional analysis of Streptomyces genomes[J].Appl Environ Microbiol,2006,72(7):4839-4844.
[9]Hoess RH,Ziese M,Sternberg N.P1 site-specific recombination: nucleotide sequence of the recombining sites[J].Proc Natl Acad Sci USA,1982,79(11):3398-3402.
[10]Shimshek DR,Kim J,Hübner MR,et al.Codon-improved Cre re⁃combinase(iCre)expression in the mouse[J].Genesis,2002,32(1): 19-26.
[11]Pritzlaff CA,Chang JC,Kuo SP,et al.Genetic basis for the be⁃ta-haemolytic/cytolytic activity of group BStreptococcus[J].Mol Microbiol,2001,39(2):236-247.
