肾上腺素能受体对心肌钠钾泵的亚基特异性调节
2011-02-10郭会彩王永利
殷 健,郭会彩,王永利
(河北医科大学1.药理学教研室、2.毒理学教研室,河北石家庄 050017)
钠钾泵,即Na+,K+-ATP酶,属于P型ATP酶家族蛋白,是镶嵌在哺乳动物细胞膜上的一种蛋白质。它每水解一个ATP分子可将3个Na+转运出细胞并移入2个K+[1],从而维持细胞的离子跨膜梯度和电位差。钠钾泵在维持细胞内离子平衡、调节细胞容积和膜电位、调节氨基酸、糖类、胆汁酸、神经递质、离子等溶质的主动转运以及在能量代谢和信号传递等方面都发挥着重要作用[2]。其功能的紊乱和调节异常都会引起严重的病理生理变化。因此,维持钠钾泵功能调节的稳定就变得至关重要。钠钾泵的调节因素有很多,本文主要综述肾上腺素能受体对心肌钠钾泵的亚基特异性调节。
1 钠钾泵及肾上腺素能受体的结构特点
钠钾泵由α、β和γ三个亚单位构成[1]。α亚单位是催化亚单位,主要执行泵的功能。它由10个跨膜区(M1-M10)组成,其中M1-M2、M3-M4、M5-M6、M7-M8、M9-M10间的序列位于细胞膜外,称为膜外区。多种配体,如内源性钠钾泵抑制因子哇巴因、ATP、Na+和K+等(Fig 1),在膜外区均有结合位点。α亚单位分为α1、α2、α3和α4四种亚基,其中α1亚基被认为是“管家”亚基。钠钾泵的表达具有组织特异性和种属差异性:成年大鼠心肌主要表达α1和α2亚基,α3亚基表达消失;而豚鼠心肌则只表达α1、α2亚基。
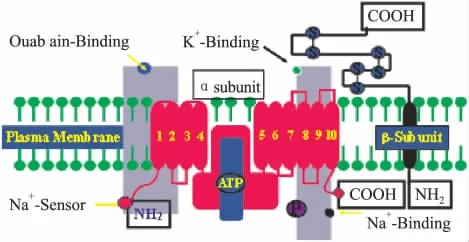
Fig 1 The structure for NKA α isoform
肾上腺素能受体是一类G蛋白偶联受体,是儿茶酚胺类(尤其是去甲肾上腺素和肾上腺素)的主要结合位点,包括α-肾上腺素能受体和β-肾上腺素能受体两类。α受体分为α1(α1a,α1b,和 α1d)和 α2(α2a,α2b,α2c,和 α2d)两种亚型[3],这些受体均含有7个跨膜多肽链,属于G蛋白超家族。不同亚型的受体和不同的G蛋白偶联:α1受体与Gp/ Gq蛋白偶联;α2受体与Gi/Go蛋白偶联。α2受体与腺苷酸环化酶的偶联是一个负性作用,可减少cAMP的形成和Ca2+流入,导致[Ca2+]降低,引起递质释放减少[3]。β-肾上腺素能受体可分为β1、β2和β33种亚型[3],均与 Gs蛋白相偶联;同时,β2亚型也可以和Gi蛋白偶联[4]。所有β肾上腺素能受体的信号转导都是通过与G蛋白相偶联进行的。
2 肾上腺素能受体对钠钾泵活性的亚基特异性调节
肾上腺素能受体的激活对钠钾泵活性的调节可分为长时程调节和短时程调节两种。去甲肾上腺素(NA)对α-肾上腺素能受体短时程激活可增加钠钾泵活性,长时程作用则可降低其活性。异丙肾上腺素(ISO)通过短时程激活β-肾上腺素能受体可降低钠钾泵活性,长时程作用增加钠钾泵活性。
2.1 短时程激活肾上腺素能受体对钠钾泵的亚基特异性调节 钠钾泵的α亚单位上存在着哇巴因的结合位点。根据此结合位点对哇巴因亲和力的不同,可将钠钾泵分为高亲和力泵(主要表达α2和α3亚基)和低亲和力泵(表达α1亚基)。
豚鼠心肌细胞上,NA在激活α1-肾上腺素能受体时以浓度依赖性的方式增加钠钾泵电流。这种钠钾泵电流的增加并不是NA改变细胞内[Na+]和细胞外[K+]的结果,而是由于α1受体与钠钾泵α2亚基相偶联后经由PKC通路对钠钾泵高亲和力泵电流进行了亚基特异性的调节,从而导致泵电流的升高。这个调节过程是[Ca2+]依赖性的[5]。β-肾上腺素能受体的激动对钠钾泵电流的影响同样依赖于细胞内[Ca2+][6-7]:在细胞内[Ca2+]较低的条件下,通过激活β受体,ISO可降低由钠钾泵α1亚基所产生的低亲和力泵电流;而在细胞内[Ca2+]较高时,激活β受体会升高泵电流。β受体的激动对泵电流的影响并不是由于ISO改变细胞内[Na+]和细胞外[K+]所致,而是由于在β受体与钠钾泵α1亚基相偶联后,ISO以亚基特异性的方式升高钠钾泵低亲和力泵电流。无论在细胞内[Ca2+]较高或较低时,β受体的激动对低亲和力泵电流的调节均与cAMP-PKA介导的级联磷酸化反应过程有关[8]。
在大鼠心肌细胞上也发现了与豚鼠心肌细胞相类似的现象:NA激活α-肾上腺素能受体升高高亲和力泵电流;ISO激活β-肾上腺素能受体降低低亲和力泵电流[12]。但是其调节机制却与豚鼠存在着差异。在短期培养的大鼠心肌细胞上,ISO对泵电流的激活并没有随着细胞内[Ca2+]的升高而增加,而是引起一个明显的减少。因此,在豚鼠心肌细胞上所提出的β受体的激活对泵电流的调节依赖于细胞内[Ca2+],这和大鼠心肌细胞上的β受体的激活调节泵电流的机制不同[9]。
至于短时程作用的调节机制,无论激活α还是β肾上腺素能受体,由于作用时间短,均不影响蛋白质的合成、降解及mRNA水平。该机制主要是通过相应钠钾泵α亚基的转位来实现对钠钾泵活性的调节。并且该过程中存在着α亚基特异性作用:β受体激活主要与钠钾泵α1亚基相偶联,使α1亚基从胞浆膜上转位至胞内部位而降低泵活性[10-12];α受体激活主要与钠钾泵α2亚基相偶联,使α2亚基从胞内转位至胞浆膜上而增加泵活性[12-13]。
2.2 长时程激活肾上腺素能受体对钠钾泵的亚基特异性调节 NA长时程作用通过与钠钾泵α2亚基相偶联可使泵活性降低,这种作用是由PKC通路介导的[5]。α-肾上腺素能受体的激活对钠钾泵的调节是通过α1受体介导的[14],这与钠钾泵α1亚基的蛋白和mRNA表达的变化有关[12-13]。
ISO长时程作用可以引起钠钾泵活性的升高,其机制涉及到钠钾泵α1亚基蛋白表达的变化[14]:α1亚基mRNA水平及蛋白含量在该过程中升高,即α1亚基蛋白合成增多引起钠钾泵活性升高[11-12]。
通过对长时程作用机制的研究表明,无论是激活α还是β肾上腺素能受体,长时程作用对钠钾泵活性的调节均会对相应α亚基的蛋白质表达及mRNA水平产生影响。该过程中也存在着α亚基特异性的调节:β受体的激活与钠钾泵α1亚基相偶联,影响 α1亚基的蛋白表达和 mRNA水平[11-12];α受体的激活与钠钾泵α2亚基相偶联,改变α2亚基的蛋白含量和mRNA水平[12-13]。
无论短时程或长时程激活α受体和β受体,均可亚基特异性调节心肌细胞钠钾泵活性。其中α受体在激活过程中与钠钾泵α2亚基偶联,调节高亲和力钠钾泵活性。β受体在激活过程中与钠钾泵α1亚基偶联,调节低亲和力钠钾泵活性。无论α或β受体,长时程激活后对钠钾泵活性的影响均与短时程激活相反。短时程激活肾上腺素能受体对钠钾泵活性的调节与钠钾泵相应α-亚基在细胞膜上的转位有关,长时程激活与钠钾泵相应α-亚基的蛋白和mRNA表达水平改变有关。
3 PKA或PKC通路介导的肾上腺素能受体对钠钾泵的调节
在各种组织中,激活PKC或PKA通路可以对钠钾泵活性进行调节[16]。其中,α-肾上腺素能受体的激活对钠钾泵的调节是由PKC通路介导[5],并与α2亚基相偶联[17];β-肾上腺素能受体的激活对钠钾泵的调节是由PKA通路介导[8],并特异性的作用于α1亚基[17]。Phospholemman(磷基纤维蛋白,FXYD1或PLM),是近年来发现的一个重要的钠钾泵调节因子,其上有PKC和PKA的磷酸化位点,并对肾上腺素能信号有响应。因此,PLM也就成为了肾上腺素能神经对钠钾泵调节过程中一个重要的调节靶点。
3.1 肾上腺素能受体通过PKA或PKC通路对钠钾泵的调节 α1-肾上腺素能受体发挥作用是通过与Gq蛋白相偶联而实现的。目前认为PKC至少存在11种亚型,α1-肾上腺素能受体很可能是通过与PKC的某种亚型相偶联而发挥对钠钾泵的调节作用。β-肾上腺素能受体激动后则是与Gs蛋白偶联并激活腺苷酸环化酶(AC),从而促进 cAMP的合成——cAMP再激活PKA,PKA通过磷酸化作用对钠钾泵进行调节,进而提高Na+和K+的交换。同时,α1受体-PKC通路和β受体-PKA通路对钠钾泵活性的调节均依赖于细胞内[Ca2+][5-7]。
3.2 PKA或PKC通路对钠钾泵的调节所涉及到的PLM磷酸化过程 PLM是一种小跨膜蛋白。它是一个重要的钠钾泵调节因子,属于FXYD基因蛋白家族[18]。PLM可与钠钾泵结合,对其功能进行调节,并介导心脏肾上腺素能受体激活过程中钠钾泵活性的变化。
心肌中,PLM是PKC和PKA磷酸化的主要靶点:PKA磷酸化PLM的位点是Ser68;而PKC磷酸化的位点包括Ser68和Ser63[19-20,23]。β-肾上腺素能受体的激活对钠钾泵活性的增加是由PKA通路介导的,该过程是由PKA磷酸化PLM触发的[22],并特异性的偶联钠钾泵 α1亚基[21]。α-肾上腺素能受体的激活对钠钾泵活性的调节是通过PKC通路介导的,该过程同样是由PLM的磷酸化引起的。不同肾上腺素能受体的激活对钠钾泵的调节存在差异,这很有可能是由于PKA或PKC磷酸化PLM上不同的位点造成的[23]。
综上所述,在α-和β-肾上腺素能受体对钠钾泵活性调节过程中,这两种受体以亚基特异性的方式,经由不同的信号转导通路对钠钾泵的活性进行调节。事实证明许多疾病(如慢性肾衰竭、充血性心力衰竭、糖尿病和癌症等)的发生、发展都与钠钾泵有着密切的关系。所以,研究钠钾泵及相关调节因子的作用机制具有重要意义。这为许多疾病(尤其是心血管疾病)的机制研究、药物治疗和新药开发,提供了一定的理论依据。
[1] Skou J C,Esmann M.The Na,K-ATPase[J].J Bioenerg Biomembr,1992,24(3):249-61.
[2] 高默杰,徐忠伟,王凤梅,等.钠钾泵抑制剂通过调节细胞周期相关蛋白的生成介导肝癌HepG2细胞周期S期阻滞与凋亡[J].中国药理学通报,2010,26(4):452-6.
[2] Gao M J,Xu Z W,Wang F M,et al.The linkage between cell cycle S phase arrest and apoptosis on human hepatocarcinoma HepG2 induced by Na+,K+-ATPase inhibitors via regulating proteins associated with cell cycle[J].Chin Pharmacol Bull,2010,26(4):452-6.
[3] 郑 恒,钱家庆.肾上腺素受体信号转导通路对心功能的调节及机制[J].国外医学(生理、病理科学与临床分册),2000,20 (4):303-5.
[3] Zheng H,Qian J Q.The regulation and mechanism of adrenoceptor signal transduction pathway on heart function[J].Foreign Med Sci (Physiol,Pathol Clin Med),2000,20(4):303-5.
[4] Chen-Izu Y,Xiao R P,Izu L T,et at.Gi-dependent localization of β2-adrenergic receptor signaling to L-type Ca2+channels[J].Biophys J,2000,79(5):2547-56.
[5] Wang Y,Gao J,Mathias R T,et al.αlpha-Adrenergic effects on Na+-K+pump current in guinea pig ventricular myocytes[J].J Physiol,1998,509(Pt1):117-28.
[6] Gao J,Mathias R T,Cohen I S,Baldo G J.Isoprenaline,Ca2+and the Na+-K+pump in guinea-pig ventricular myocytes[J].J Physiol,1992,449:689-704.
[7] Gao J,Mathias R T,Cohen I S,et al.The effects of β-stimulation of the Na/K pump current-voltage relationship in guinea pig ventricular myocytes[J].J Physiol,1996,494:697-708.
[8] Gao J,Cohen I S,Mathias R T,Baldo G J.Regulation of the βstimulation of the Na/K pump current in guinea pig ventricular myocytes by a cAMP-dependent PKA pathway[J].J Physiol,1994,477(Pt3):373-80.
[9] Stimers J R,Dobretsov M.Adrenergic stimulation of Na+/K+pump current in adult rat cardiac myocytes in short-term culture[J].J Membr Biol,1998,163:205-16.
[10]Bertorello A M,Ridge K M,Chibalin A V,et al.Isoproterenol increases Na+-K+-ATPase activity by membrane insertion of a-subunits in lung alveolar cells[J].Am J Physiol,1999,276(1Pt1): L20-7.
[11]Guo H C,Wang Y L.Short and long-term effect of isoprenaline on Na+-K+-ATPase expression in guinea pig ventricular myocytes[J].Acta Pharmacol Sin,2006,27:156.
[12]殷 健,王永利.α-和β-肾上腺素能受体激动剂对大鼠心肌细胞Na/K泵电流亚基特异性调节及其分子机制[C].第十届全国心血管药理学术会议暨2010(重庆)国际心血管疾病与药物高峰论坛论文集,2010:111.
[12]Yin J,Wang Y L.Isoform-specific regulation of α-and β-adrenoceptor agonists on Na+,K+-ATPase in adult rat cardiocytes and its mechanism[C].Tenth National Conference and the cardiovascular pharmacology 2010(Chongqing)International Forum of cardiovascular diseases and drug Proceedings,2010:111.
[13]李树民.去甲肾上腺素对豚鼠心肌钠泵活性和α亚基表达的影响[D].河北医科大学,2006.
[13]Li S M.The regulation of norepinephrine on sodium pump activity and its alpha isoforms in guinea-pig ventricular myocytes[D].Heibei Medical University,2006.
[14]Williamson A P,Kennedy R H,Seifen E,et al.Alpha 1b-adrenoceptor-mediated stimulation of Na-K pump current in adult rat ventricular myocytes[J].Am J Physiol,1993,264:H1315-8.
[15]Suzuki S,Kurosawa H,Koike K,et al.Long-term effect of a betaadrenergic agonist on Na+/K+-ATPase activity in rat lung explants[J].Nihon Kyobu Shikkan Gakkai Zasshi,1996,34(12): 1311-6.
[16]Therien A G,Blostein R.Mechanisms of sodium pump regulation[J].Am J Physiol-Cell Physiol,2000,279(3):C541-66.
[17]Gao J,Wymore R,Wymore R T,et al.Isoform-specific regulation of the sodium pump by α-and β-adrenergic agonists in guinea-pig ventricle[J].J Physiol,1999,516(Pt2):377-83.
[18] Cheung J Y,Zhang X Q,Song J,et al.Phospholemman:a novel cardiac protein[J].Clin Transl Sci,2010,3(4):189-96.
[19] Presti C F,Jones L R,Lindemann J P,et al.Isoproterenol-induced phosphorylation of a 15-kilodalton sarcolemmal protein in intact myocardium[J].J Biol Chem,1985,260:3860-7.
[20]Han F,Bossuyt J,Martin J L,et al.Role of phospholemman phosphorylation sites in mediating kinase-dependent regulation of the Na+-K+-ATPase[J].Am J Physiol Cell Physiol,2010,299(6): C1363-9.
[21]Silverman B Z,Fuller W,Eaton P,et al.Serine 68 phosphorylation of phospholemman:actue isoform-specfic activation of cardiac Na/ K ATPase[J].Cardiovasc Res,2005,65(1):93-103.
[22]Despa S,Bossuyt J,Han F,et al.Phospholemman-Phosphorylation Mediates the beta-Adrenergic effects on Na/K Pump Function in Cardiac Myocytes[J].Circ Res,2005,97:252-9.
[23]Bibert S,Roy S,Schaer D,et al.Phosphorylation of phospholemman (FXYD1)by protein kinases A and C modulates distinct Na,KATPase Isozymes[J].J Biolog Chem,2008,283:476-86.
