支气管败血波氏杆菌皮肤坏死毒素的重组表达及其生物学特性
2011-02-09薛云赵战勤裴洁王臣丁轲程相朝
薛云,赵战勤,裴洁,王臣,丁轲,程相朝
1 河南科技大学动物科技学院,洛阳 471003
2 河南科技大学医学技术与工程学院,洛阳 471003
3 湖北省动物疫病预防控制中心,武汉 430064
支 气 管 败 血 波 氏 杆 菌 (Bordetella bronchiseptica,Bb) 是一种革兰氏阴性需氧小杆菌,可广泛感染多种哺乳动物,表现为呼吸道的急慢性炎症[1]。在猪群中,Bb可引起猪发生萎缩性鼻炎(Atrophic rhinitis,AR) 和支气管肺炎,世界猪群有25%~50%受感染,已成为猪的重要传染病之一[2]。2003~2008年,笔者从全国各地3 506份有呼吸道症状的猪肺脏病料中分离到 652株 Bb,分离率高达18.6%,各省份之间没有明显差异,表明Bb在我国猪场广泛流行和致病[3]。近年来发现,Bb可从家畜等动物传染给人类,并在免疫功能缺陷或低下的人群 (如AIDS患者) 体内形成严重感染,因此引起高度关注[4]。
目前,用于预防和控制该病的疫苗主要有灭活菌苗和类毒素苗,其中类毒素苗免疫效果优于灭活菌苗,不同型菌株的类毒素具有交叉保护[4]。皮肤坏死毒素 (Dermonecrotic toxin,DNT) 是 Bb定居于宿主上呼吸道所必需的致病因子,缺失 dnt基因的 Bb突变株无法导致猪发生支气管肺炎和鼻甲骨损伤[5]。此外,DNT还通过损坏呼吸道上皮细胞而间接地促进Bb的附着作用[5-6]。DNT存在于胞浆内,不耐热,对福尔马林敏感,灭活后仍具有抗原性,可刺激机体产生抗毒素中和抗体[7]。然而,天然DNT的分泌量非常有限,不到菌体蛋白的0.8%[8],且纯化工艺复杂,因此通过提纯天然DNT来制备类毒素苗成本太高,不适合规模化生产。本研究旨在通过分子生物学方法对毒素基因进行克隆、表达和生物学活性研究,为DNT的分子致病机理和新型亚单位疫苗的研究奠定基础。
1 材料与方法
1.1 菌株、质粒、试剂和试验动物
猪源 Bb强毒菌株 HH0809 (FHA+,PRN+,DNT+)[9]、大肠杆菌 DH5α和 BL21、载体质粒pET-28a、HH0809株猪阳性血清由河南科技大学动物病原微生物实验室保存;LB培养基购自美国BD公司;LA Taq DNA聚合酶、T4 DNA连接酶、限制性内切酶等购自大连 TaKaRa公司;基因组提取试剂盒和UNIT-10柱式DNA胶回收试剂盒购自上海Sangon公司;His-band purification kit购自德国Novagen公司。天然DNT抗血清、辣根过氧化物酶标记的羊抗猪 IgG 和弗氏佐剂购自美国Sigma-Aldrich公司;新西兰大白兔、5~6日龄BALB/c乳鼠由河南科技大学实验动物中心提供。
1.2 dnt基因的克隆、序列分析及表达载体的构建
利 用 HMMTOP 软 件[10](http://www.cn. expasy.org/tools/) 对 GenBank上公布的 dnt基因(Accesion No. U59687) 编码的氨基酸序列进行跨膜性预测,为 dnt的引物设计和高效表达提供理论依据。设计3对引物 (由北京AuGCT公司合成),分别引入BamHⅠ和Hind Ⅲ酶切位点 (下划线部分),并在P2和P4中引入终止密码子 (表1)。3对引物分别扩增其N端 (dntN)、中间部分 (dntM) 和C端(dntC) 的编码区域 (图1)。按试剂盒说明书提取Bb HH0809株基因组为模板,使用引物P1/P2进行PCR,扩增dntN片段并回收产物。使用BamHⅠ与Hind Ⅲ分别对PCR产物和pET-28a载体质粒进行酶切、回收、连接构建重组质粒,命名为pET-dntN。将连接产物转化大肠杆菌DH5α,筛选阳性克隆,提取质粒,进行酶切鉴定和序列测定 (由大连 TaKaRa公司完成)。按同样的方法使用引物P3/P4和P5/P6进行PCR并构建重组质粒 pET-dntM和 pET-dntC。最后利用dnt基因含有的酶切位点SmaⅠ和ScaⅠ将dntM 和dntC片段克隆到pET-dntN上构建含有dnt整个编码区的重组质粒pET-dnt (图1)。
1.3 基因的表达、纯化和Western blotting分析
将重组质粒pET-dnt转化大肠杆菌BL21,挑取单菌落于含有卡那霉素 (终浓度为50 mg/L) 的LB培养基中,37 ℃、225 r/min摇床培养至对数生长期时 (OD600=0.6~1.0),加入0.8 mmol/L IPTG (Isopropyl-β-D-thiogalactopyranoside) 诱导表达4 h。通过 12% SDS-PAGE分析蛋白的表达特性。应用His-band purification kit试剂盒对表达产物 (命名为His6-PRN) 进行纯化。蛋白浓度通过分光光度计进行测定,纯度经SDS-PAGE电泳和Bio-Rad Quantity One program (美国Bio-Rad公司) 进行分析。对纯化的各表达产物进行Western blotting分析,一抗为天然DNT抗血清 (购自美国Sigma-Aldrich公司),二抗为辣根过氧化物酶标记的羊抗猪IgG。
1.4 乳鼠皮肤坏死试验
按文献[6]所述方法,将Bb菌株HH0809在含有15%脱纤绵羊血的鲍-姜氏平板上培养,并对其培养物进行天然DNT的提取,并按1.3所述方法进行浓度和纯度分析。将重组蛋白His6-DNT和天然DNT均调整至浓度为100 mg/L,通过颈部皮下途径分别注射 5只乳鼠 (50 μL/只)。按相同的方法将两者的灭活溶液 (经56 ℃水浴30 min) 以及无菌 PBS各注射 5只乳鼠为对照 (表 2)。观察乳鼠皮肤坏死情况至48 h。接种部位仅出现小红点判为轻微病变,接种部位出现直径大于或等于1 cm的坏死灶判为严重病变,介于两者之间的判为中度病变。

表1 实验中所用引物Table 1 PCR primers used in this study
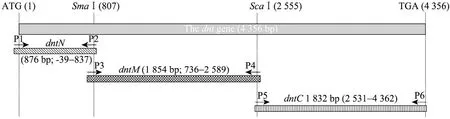
图1 dnt基因的结构及其分段克隆Fig. 1 Structure of the constructed dnt segments.

表2 重组蛋白His6-DNT的乳鼠皮肤坏死试验结果Table 2 Dermonecrotic effects of His6-DNT in the infant mouse assay
1.5 乳鼠皮肤坏死阻断试验
将表达产物His6-DNT的蛋白质溶液加入0.4%甲醛溶液,灭活 48 h,取灭活后的 His6-DNT蛋白150 µg与等体积弗氏完全佐剂均匀混合,皮下注射新西兰大白兔,分别在 3、5、7周后各加强免疫 1次 (使用弗氏不完全佐剂)。在最后一次免疫后10 d进行心脏采血,分离血清,0.22 µm滤膜过滤除菌,−20 ℃保存备用。将兔抗His6-DNT血清0.5 mL与1.4中提取的天然DNT蛋白50 µg均匀混合,37 ℃孵育30 min。然后,将孵育后的混合物按1.4所述方法分别接种5只乳鼠 (50 μL/只) 并进行观察。同时,设His6-DNT兔抗血清、天然DNT蛋白以及无菌PBS组为对照。
2 结果与分析
2.1 dnt基因的序列分析及其重组表达质粒的构建
GenBank上公布的 dnt基因 (Accession No. U59687) 编码区全长为4 356 bp,编码1 451个氨基酸,HMMTOP软件的分析结果表明,DNT的氨基酸序列存在1个跨膜区,位于约第99~118氨基酸之间,对应于 DNT信号肽序列位置[6]。ProtParam软件的分析结果表明,DNT的分子结构式为C7186H11258N2040O2092S31,理论 pI值为 6.20,脂肪系数为94.83,不稳定系数为40.75,属于不稳定型蛋白质。
本研究中,将PCR产物进行0.8%琼脂糖凝胶电泳检测,表明成功扩增了 dnt基因的 3个片段dntN、dntM和dntC,扩增的片段大小分别为876 bp、1 854 bp和1 832 bp (图2A)。酶切鉴定结果表明,构建的 3个重组质粒 pET-dntN、pET-dntM 和pET-dntC均正确 (图2B)。最后利用dnt基因含有的酶切位点SmaⅠ和ScaⅠ将dntM和dntC片段克隆到pET-dntN上构建含有dnt整个编码区4 356 bp的重组质粒pET-dnt。将pET-dnt进行BamHⅠ和Hind Ⅲ双酶切,得到大小为5 000 bp和4 356 bp左右的2条带,与预期DNA片段相符 (图2C)。测序结果进一步表明dnt基因片段在pET-28a表达载体中得到正确连接。本研究克隆的 dnt全基因序列与 GenBank公布的3个序列U59687、AB020025、E17214的核苷酸序列同源性均在99.6%以上;有6个核苷酸发生突变,最终导致4个氨基酸发生改变。
2.2 DNT的表达和Western blotting分析
SDS-PAGE结果表明 (图3),含pET-dnt重组质粒的大肠杆菌BL21在约145 kDa处有明显的表达带,以包涵体形式存在,与以前报道的该蛋白的分子量大小相符合[6]。pET-28a空载体对照没有对应的表达带。经Bio-Rad Quantity One program进行分析,重组蛋白 His6-DNT的表达量占菌体总蛋白的42.3%。提取的包涵体经过复性,并使用组氨酸融合蛋白纯化试剂盒 His-band purification kit进行纯化后,得到浓度为302.1 µg/mL、纯度为93.2%的融合蛋白His6-DNT (图3)。Western blotting分析表明,重组DNT蛋白His6-DNT能够与天然DNT的抗血清发生特异性的免疫反应,空载体对照诱导物则不能(图3)。这证实克隆基因片段得到正确表达,并具有良好的反应原性。
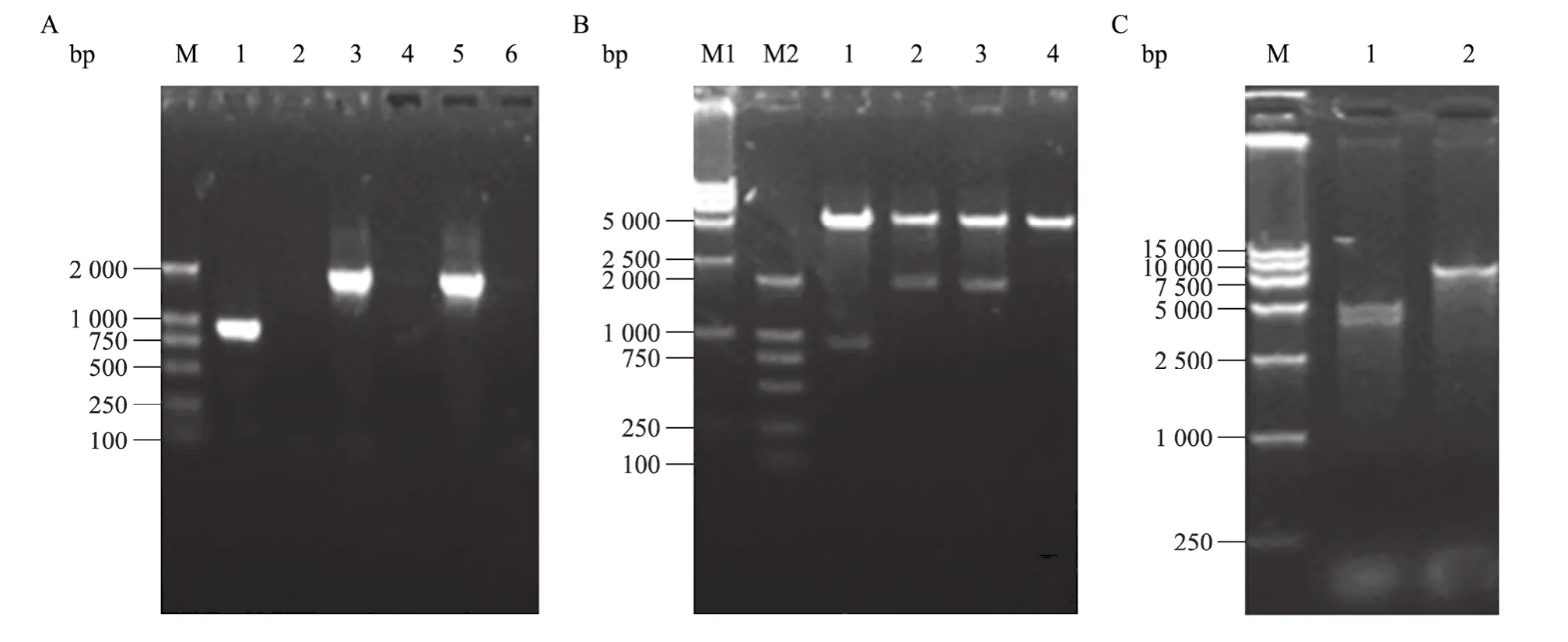
图2 dnt基因的分段扩增及其重组质粒的酶切鉴定Fig. 2 The amplification of dnt gene fragements and identification of the recombinant plasmids by enzyme digestion. (A) M: marker DL 2 000; 1, 3 and 5: PCR products of dntN, dntM, and dntC fragements; 2, 4, 6: negative control. (B) M1 and M2: marker DL 15 000 and DL 2 000; 1−4: enzyme digestion analysis of pET-dntN, pET-dntM, pET-dntC and pET-28a by BamHⅠand Hind Ⅲ , respectively. (C) M: marker DL 15 000; 1: pET-dnt digested with both BamHⅠand Hind Ⅲ; 2: pET-dnt digested with BamHⅠ.

图3 表达产物的SDS-PAGE和Western blotting结果Fig. 3 SDS-PAGE and Western blotting analysis of the recombinant His6-DNT proteins. M: protein marker; 1 and 2: cell pellets and supernatants of Escherichia coli BL21 harboring pET-DNT plasmid; 3 and 4: crude lysates of BL21 harboring pET-DNT or pET-28a plasmid; 5: purified His6-DNT; 6 and 7: Western blotting of the purified His6-DNT and the PBS control with anti-DNT. His6-DNT proteins are indicated by the arrow.
2.3 His6-DNT的乳鼠皮肤坏死试验
乳鼠皮肤坏死试验结果表明 (表 2),表达蛋白His6-DNT在48 h内可以使5~6日龄乳鼠发生中度的皮肤坏死病变,天然毒素DNT则可使乳鼠全部发生严重病变。天然DNT和表达蛋白His6-DNT经56 ℃水浴30 min灭活后则完全丧失了使乳鼠皮肤发生坏死的能力 (图4)。注射无菌PBS的1组乳鼠也未出现任何皮肤坏死病变。这些试验结果表明,虽然重组蛋白His6-DNT低于天然DNT的毒素活性,但仍具有导致乳鼠皮肤坏死的生物学毒性作用。
2.4 乳鼠皮肤坏死阻断试验
结果表明,天然DNT能导致乳鼠发生严重的皮肤坏死病变 (图 5B)。但是,天然 DNT蛋白与His6-DNT兔抗血清混合孵育后,完全丧失了导致乳鼠皮肤坏死的能力,注射的5只乳鼠均没有出现明显病变 (图5A)。这表明天然DNT与His6-DNT的兔抗血清发生了中和反应从而丧失了导致乳鼠皮肤坏死的生物学毒性作用。这也进一步证明,重组蛋白不仅具有Western blotting试验中所显现的良好反应原性,也具有较强的免疫原性。
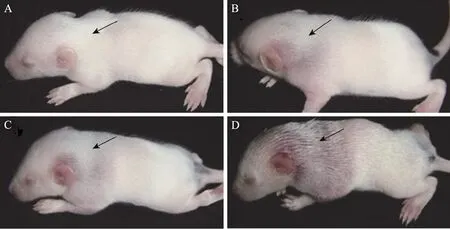
图4 重组蛋白His6-DNT能导致乳鼠皮肤坏死Fig. 4 Dermonecrotic effect of His6-DNT in the infant mice. (A) Inactived His6-DNT could not cause lesions (arrow). (B) Natural DNT could cause severe lesions. (C and D) His6-DNT could cause lesions. Lesion was showed after being wetted with PBS.
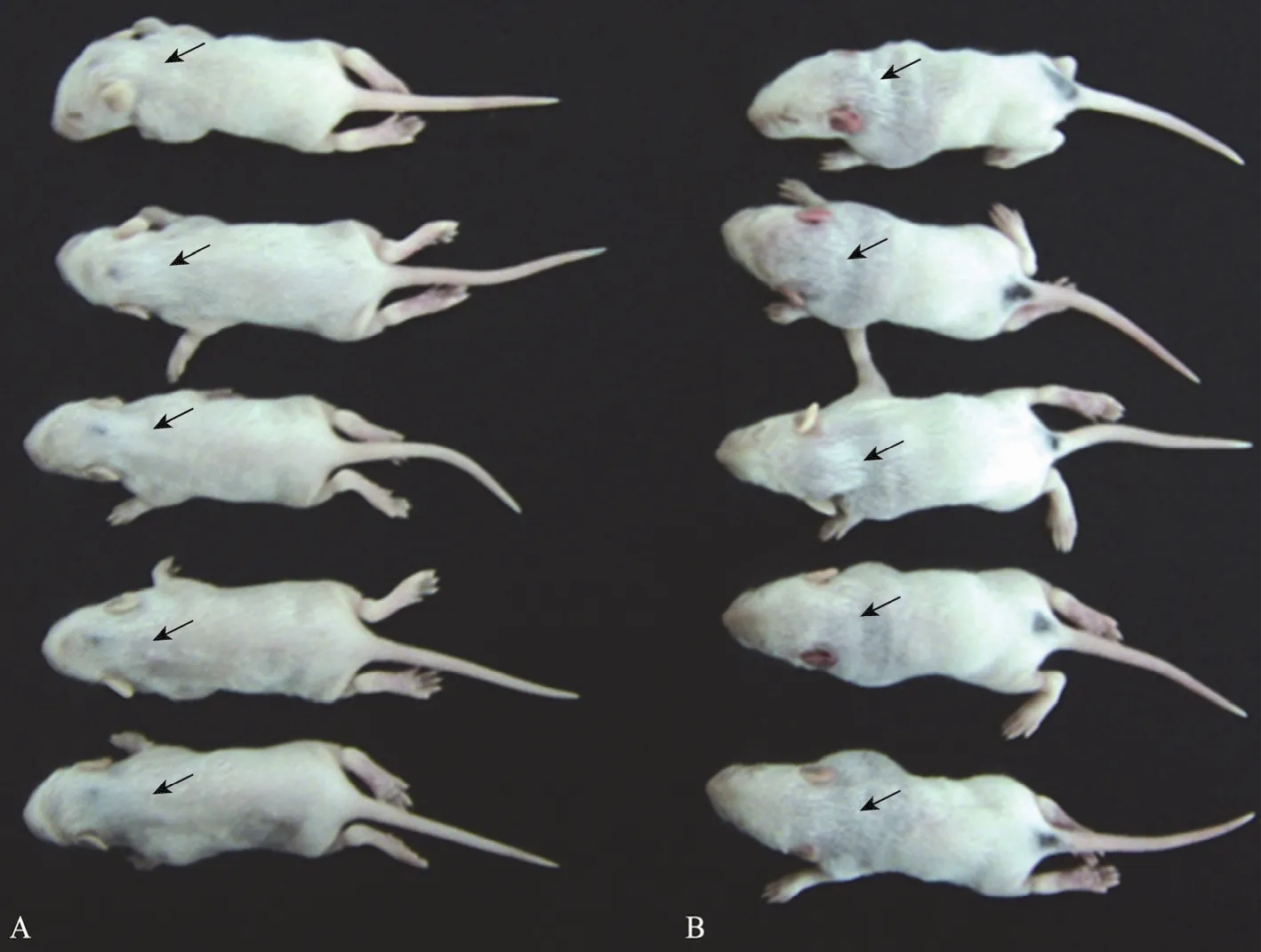
图5 DNT的乳鼠皮肤坏死阻断试验结果Fig. 5 Inhibition of dermonecrotic effect of DNT in the infant mouse assay. (A) Natural DNT neutralized with rabbit anti-His6-DNT could not cause dermonecrotic effect (arrow). (B) Natural DNT could cause severe dermonecrotic effect (arrow).
3 讨论
Bb的dnt基因全长4 356 bp,国外学者均使用酶切基因组后杂交的方法获取 dnt基因,尚未使用PCR方法。考虑到本研究若选用普通的 DNA聚合酶进行扩增,很难保证片段的保真度,故改用LA Taq DNA聚合酶扩增长片段,但扩增比较困难。最后采用分段扩增的方法,分三段扩增 dnt基因,再利用序列中的2个酶切位点SmaⅠ和ScaⅠ与载体的多克隆位点进行拼接,最终获得4 356 bp的dnt全基因片段。序列分析表明,该dnt基因与GenBank上所报道的 3个dnt基因序列具有高度的同源性,无插入和缺失突变。
本研究是国内首次在大肠杆菌中成功地用原核表达系统融合表达了 Bb完整的 dnt基因。SDS-PAGE结果表明,重组质粒pET-dnt在大肠杆菌 BL21中诱导表达的产物 His6-DNT约占整个蛋白的 42.3%,表达量大且易于纯化。而天然 DNT毒素在 Bb的表达量仅占 0.8%,且难于纯化[8]。Western blotting检测结果显示,该重组蛋白具有良好的免疫学活性,这为研制开发基因工程疫苗提供了可靠的试验基础。dnt基因的高效表达为进一步研究 DNT毒素蛋白的结构特点、理化特性打下了基础,而且对于毒素作用机制以及致病机理的研究提供了试验材料。
乳鼠皮肤坏死试验结果显示,虽然重组His6-DNT低于天然DNT毒素的生物学毒性,但仍然能够导致乳鼠发生中等程度的皮肤坏死。重组蛋白以包涵体形式存在是其活性降低的一个主要原因,即使经过变性、复性处理,活性只能部分恢复。这些因素都会影响表达产物 His6-DNT的生物学活性。在乳鼠皮肤坏死阻断试验中,His6-DNT的兔抗血清能够中和天然 DNT使其失去针对乳鼠的生物学毒性作用。这表明重组蛋白也具有良好的免疫原性。同时也预示着,重组 DNT抗原不仅可用于主动免疫预防,也可通过制备抗血清用于波氏菌病的治疗。
REFERENCES
[1] United States Department of Agriculture. Part II: reference of swine health and health management in the United States. CO: National Animal Health Monitoring System, Fort Collins. 2000: 112−128.
[2] Straw BE, Zimmerman JJ, D’Allaire S, et al. Diseases of Swine. 9th ed. Ames, IA: Wiley-Blackwell, 2006.
[3] Zhao ZQ, Wang C, Xue Y, et al. The occurrence of Bordetella bronchiseptica in pigs with clinical respiratory disease. Vet J, 2011 188(3): 337−340.
[4] Mattoo S, Cherry JD. Molecular pathogenesis, epidemiology, and clinical manifestations of respiratory infections due to Bordetella pertussis and other Bordetella subspecies. Clin Microbiol Rev, 2005, 18(2): 326−382.
[5] Brockmeier SL, Register KB, Magyar T, et al. Role of the dermonecrotic toxin of Bordetella bronchiseptica in the pathogenesis of respiratory disease in swine. Infect Immun, 2002, 70(2): 481−490.
[6] Pullinger GD, Adams TE, Mullan PB, et al. Cloning, expression, and molecular characterization of the dermonecrotic toxin gene of Bordetella spp. Infect Immun, 1996, 64(10): 4163−4171.
[7] Chen PY. Diseases of Animals. 5th ed. Beijing: Chinese Agriculture Press, 2008: 209−269.陈溥言. 兽医传染病学. 5版. 北京: 中国农业出版社, 2008: 209−269.
[8] Horiguchi Y, Nakai T, Kume K. Purification and characterization of Bordetella bronchiseptica dermonecrotic toxin. Microb Pathog, 1989, 6(5): 361−368
[9] Zhao ZQ, Pei J, Xue Y, et al. Isolation, identification and characterization for Bordetella bronchiseptica from diseased pigs. Sci Agri Sin, 2008, 41(12): 4209−4217.赵战勤, 裴洁, 薛云, 等. 猪源支气管败血波氏杆菌的分离鉴定及生物学特性研究. 中国农业科学, 2008, 41(12): 4209−4217.
[10] Tusnády GE, Simon I. The HMMTOP transmembrane topology prediction server. Bioinformatics, 2001, 17(9): 849−850.
