Runx 2在牙釉质形成中的作用研究
2011-02-02何永云梁广智刘晓影高玉光
何永云,梁广智,刘晓影,孙 岩,高玉光
(山东潍坊医学院口腔医学研究所,山东潍坊 261053)
Runx 2在牙釉质形成中的作用研究
何永云,梁广智,刘晓影,孙 岩,高玉光
(山东潍坊医学院口腔医学研究所,山东潍坊 261053)
目的:研究小鼠成釉细胞中Runx 2对釉成熟蛋白(Amelotin,AMTN)、成釉蛋白(Ameloblastin,AMBN)、牙成釉细胞相关蛋白(odontogenic ameloblast-asssociated protein,ODAM)基因表达的调控作用,为研究Runx 2在牙釉质形成中的作用奠定基础。方法:通过RT-PCR法从小鼠成釉细胞中克隆得到Runx 2全长基因,测序正确后将其亚克隆至pcDNA3.1-hisA载体中;构建针对小鼠Runx 2的siRNA表达框架,将反应质粒pcdna-3.1-HisA-Runx2及针对Runx2的特异性小分子干扰RNA(siRNA)分别转染小鼠成釉细胞,用RT-PCR方法检测Runx 2,AMTN,AMBN以及ODAM的mRNA水平。结果:转染的小分子干扰RNA(siRNA)对Runx 2 mRNA的表达有显著性抑制作用,Runx 2基因沉默可显著抑制AMTN和AMBN的mRNA表达水平;Runx 2基因过表达可显著上调AMTN和AMBN的mRNA表达水平。Runx 2基因的表达变化对ODAM的mRNA表达水平则无显著性调控作用。结论:Runx 2通过调控AMTN和AMBN的表达水平,在牙釉质形成过程中发挥作用。
核心结合因子;釉成熟蛋白;成釉蛋白;牙成釉细胞相关蛋白;RT-PCR
[牙体牙髓牙周病学杂志,2011,21(2):62]
[Chinese Journal of Conservativedentistry,2011,21(2):62]
Runx 2称为核心结合因子,又名Cbfal,在成骨细胞的分化中起着关键的作用,最近研究[1]显示它也参与了牙齿发育的信号网络调控,Runx基因敲除小鼠可以导致牙胚钟状期发育不全,从而使新生小鼠牙齿特异性细胞的分化受阻,导致牙本质异常和牙釉质缺失。国内外许多研究发现,在动物牙齿发育中cbfal的表达有时空特异性[2-3]。然而,迄今为止在人牙胚研究领域尚未发现进一步的报道。近来发现cbfal共有3种同形异构体,他们均在牙胚中有表达[4]。本研究在小鼠成釉细胞中沉默及过表达 cbfal后,采用实时定量 PCR检测AMTN、AMBN和ODAM的表达水平,确定cbfal对牙釉质基质蛋白的调控作用,为进一步研究其在成牙细胞分化和牙齿硬组织形成中的作用机制提供理论依据。
1 材料和方法
1.1 主要材料和仪器
小鼠成釉细胞系(ALC,日本秋田大学Sugiyama[5]教授惠赠);RNAiso Plus(Total RNA 提取试剂)、PrimeScript® RT reagent Kit(Perfect Real Time)、T4dNA连接酶(TaKaRa公司);凝胶回收试剂盒及小量质粒提取试剂盒(上海生物工程有限公司);Taq plus(QIAGEN公司,美国),BamHⅠ、XbaⅠ及 HindⅢ(NEB公司,美国);pcDNA 3.1-HisA载体、pMD18-T simple 载体及 LipofectamineTM2000(Promega公司);SiRNA Transfection Reagent、SiRNA Transfection Medium(Santa Cruz公司),DNA Marker#sm0331(Fermentas公司);SYBRgreen PCR Master Mix(Roche公司);IQ5TMPCR 仪(Bio-Rad公司)。
1.2 方法
1.2.1 小鼠Runx 2基因的克隆及重组表达载体的构建
以传至第3代的小鼠成釉细胞提取的总RNA为模板,用Oligo(dT)进行逆转录反应合成cDNA第1条链,用上下游引物进行扩增。通过GenBank检索小鼠Runx 2基因序列,根据引物设计原则,采用Primer 5.0软件进行引物设计。上游引物P1为:5'-AAgGATCC ACATGCGTATTCCTGTAGATC-3',含BamHⅠ的酶切位点;下游引物 P2为:5'-AA TCTAGA ATATGGCCGCCAAACAGACT-3',含 XbaⅠ的酶切位点。PCR扩增Runx 2 cDNA为1 545 bp,将产物进行BamHⅠ和XbaⅠ双酶切并割胶回收,与经相同酶切的pcDNA3.1-HisA空载体连接并转化到大肠杆菌DH5α感受态细胞,挑单菌落培养抽提质粒进行酶切鉴定,鉴定正确后送TaKaRa公司测序进一步验证,测序正确即为构建好的真核表达重组载体 pcDNA3.1-HisA-Runx 2。
1.2.2 双链siRNA的制备
根据Elbashir等[6]提出的原则设计一对靶向Runx2基因的特异性双链 siRNA(siRNA-Runx 2),由TaKaRa公司合成,SDS-PAGE纯化。合成一对无关siRNA作为阴性对照。
1.2.3 引物设计及PCR反应
根据引物设计原则,采用Primer 5.0软件设计Runx 2、AMTN 、AMBN、ODAM 以及gAPDH 的引物,PCR引物、扩增片段的长度及反应条件(表1)。

表1 不同PCR反应引物、扩增片段的长度及反应条件
1.2.4 细胞培养、重组质粒和双链siRNA的瞬时转染
成釉细胞用含100 mL/L小牛血清的DMEM培养基在含50 mL/L CO2、饱和湿度、37℃的培养箱中培养。6孔板铺板,每孔2×106/mL,待细胞融合至70%~80%时按照TransFastTMTransfectionReagent操作说明书进行空质粒pcDNA3.1/myc-hisA 和 重 组 表 达 载 体pcDNA3.1-HisA-Runx 2 的转染,每个样本 3 个复孔。转染36 h后,按RNAiso Plus试剂说明书抽提细胞总RNA,紫外分光光度计测RNA浓度和纯度,取1 μg进行反转录。
1.2.5 免疫组织化学检测Runx 2表达
取出生后5d小鼠下颌切牙甲醛固定,乙二胺四乙酸(EDTA)低温脱矿后制作组织蜡块,组织切片经常规脱蜡入水,抗原修复后50 mL/L过氧化氢液或甲醇去除内源性过氧化物酶活性,50 mL/L羊血清封闭非特异结合蛋白,滴加1∶50稀释的一抗兔抗鼠Runx 2,4℃孵育过夜;1∶200 HRP标记的羊抗兔抗体室温结合2 h;加DAB显色,经苏木素复染、脱水、透明及封片后,显微镜下观察结果。阴性对照用PBS代替一抗。
1.2.6 RT-PCR 检测 Runx 2、AMTN、AMBN 及ODAM mRNA表达
以逆转录的cDNA为模板进行实时定量PCR,反应条件如表1所示。RT-PCR产物以CT值作为分析依据。因为pcDNA3.1-HisA∶Runx 2及siRNA对内源性基因GAPDH无影响,故以GAPDH作为内对照用以标准化样本。CT值由荧光PCR仪在扩增过程中自动读出。所得CT值结果进行2-△△CT分析[7],ΔΔCt= 实验组目的基因CT-管家基因CT-对照组目的基因CT-管家基因CT。2-△△CT示实验组目的基因的表达相对于对照组的变化倍数,以计算Runx 2在成釉细胞中过表达及沉默后AMTN、AMBN及ODAM mRNA的表达相对变化。
1.3 统计分析
应用SPSS 13.0统计软件进行统计分析,组间比较用配对t检验,检验水准α=0.05。
2 结果
2.1 小鼠Runx 2基因的克隆及重组表达载体的构建
以小鼠成釉细胞 cDNA为模板,P1、P2为引物,扩增出约1 545 bp的片段,大小同GenBank中报道的小鼠Runx 2 cDNA序列长度相符。构建的pcDNA3.1-HisA-Runx 2 经BamHⅠ和 HindⅢ双酶切后得到一大片段和一697 bp小片段,DNA测序结果经BLAST显示结果与预期一致(图1)。
2.2 小片段Runx 2、AMTN、AMBN 及ODAM 表达水平检测
在体外培养的成釉细胞中RT-PCR检测到Runx2、AMTN、AMBN及ODAM分别约为123 bp、132 bp、174 bp和110 bp的条带,连接到T载体中测序分别为Runx 2、AMTN、AMBN及ODAM基因(图2)。
2.3 Runx 2在小鼠下颌切牙成釉细胞中的表达
用抗Runx 2抗体进行5d龄小鼠的下颌骨免疫组化染色在成釉细胞胞核中见阳性表达,余为阴性(图3)。
2.4 重组质粒 pcDNA3.1-HisA-Runx 2及siRNA-Runx 2 转染后 Runx 2、AMBN、AMTN 及ODAM mRNA表达变化
通过对所得CT值结果进行2-△△CT分析,成釉细胞中转染Runx2 siRNA 24 h后Runx2 mRNA表达水平下降约60%,差异有显著性,说明Runx2基因的沉默效果较好。AMBN、AMTN及ODAM在转染Runx 2 siRNA组表达水平显著下降,而转染pcDNA3.1 hisA-Runx 2组表达水平显著上升。两组比较均有统计学意义(P<0.05)(图4)。
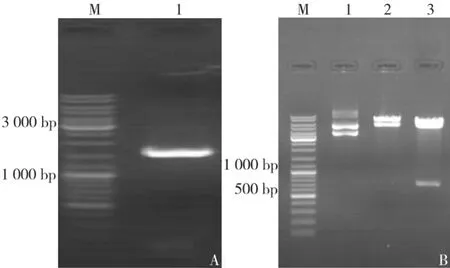
图1 RT-PCR扩增及酶切鉴定电泳结果
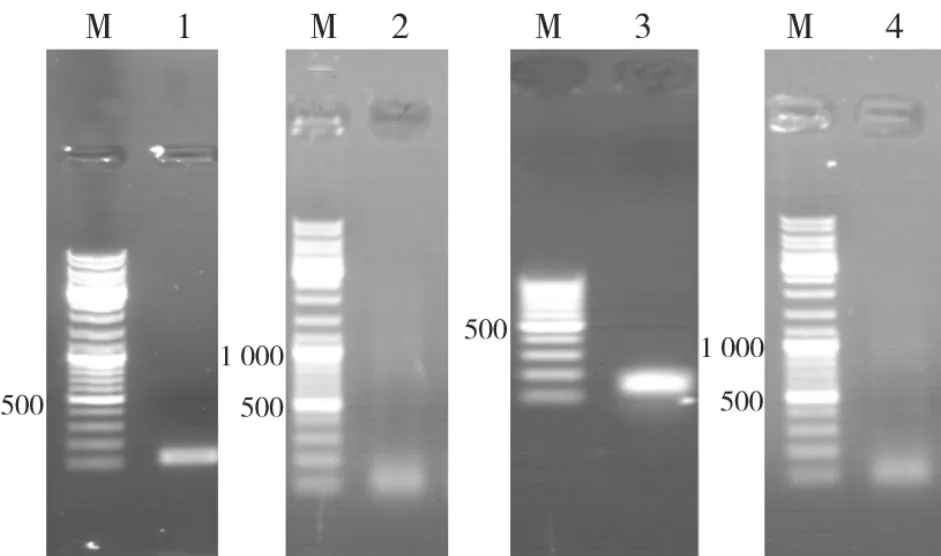
图 2 Runx 2、amelotin、ameloblastin、ODAM在体外成釉细胞的表达

图3 5d龄小鼠切牙牙胚免疫组化结果
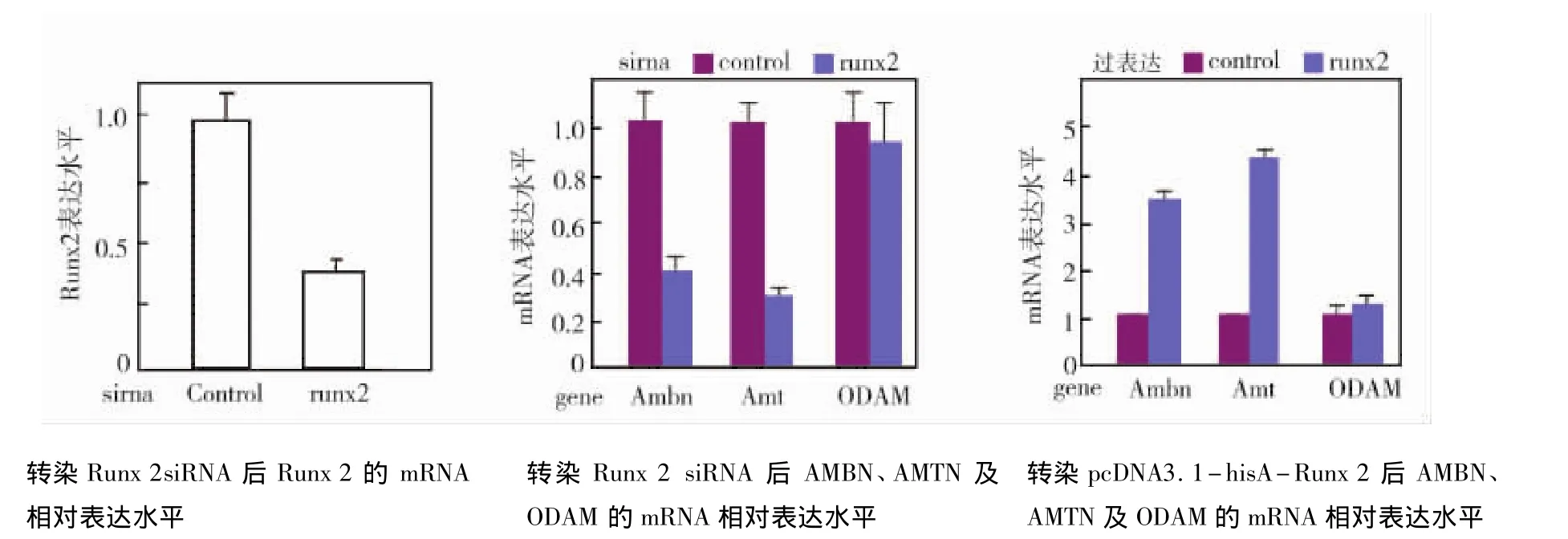
图4 Real-time PCR检测Runx 2及AMBN,AMTN,ODAM mRNA表达变化
3 讨论
近年来,关于调控牙齿发育的分子机制方面的研究已经取得了很大的进步。在确立的与牙齿发育有关的转录因子中,Runx 2/cbfal是备受关注的一种。Runx 2是Runt相关转录因子家族成员,研究发现Runx 2作为成骨细胞分化的早期转录以及成熟的成骨细胞中基因表达的调控因子,在成骨过程中发挥着重要作用[8]。还有研究发现,Runx 2基因敲除小鼠中出现了牙齿器官发育不良的现象,这些牙齿器官缺乏明显的成牙本质细胞和成釉细胞的分化,无正常的牙本质和釉质基质[1]。国内外学者进行免疫组化和原位杂交实验结果表明,在鼠的牙胚中包括牙上皮细胞、牙滤泡细胞、成骨细胞、成釉细胞和成牙本质细胞等,均有过CbfaI的mRNA和蛋白的表达,而且表达有时空特异性[3,9],这都提示 Runx 2 参与了牙胚的发育,它可能与细胞的分化和硬组织的形成有关。D'Souza等通过RT-PCR、原位杂交和基因敲除等试验揭示:在牙齿发育过程中,Runx 2通过调控上皮与间充质的相互作用来控制牙齿形态的发生和成釉器的组织分化[1]。AMTN和AMBN为成釉细胞分泌的牙釉质基质蛋白,其基因定位于人4号染色体q臂[10],而常染色体遗传性牙釉质发育不全(Amelogenesis Imperfects,AI)也定位于此[11]。目前已有研究表明这两种蛋白与牙釉质发育和矿化都有关系,其成分、结构和功能的改变与牙釉质发育不全的发生密切相关[11]。ODAM是成釉细胞于成熟期高表达的细胞外基质蛋白,该蛋白表达起始于成釉细胞的分泌阶段,延伸至成釉细胞的成熟期[12-13]。相关的研究证实[12]:ODAM在大鼠切牙牙釉质矿化和成熟过程中高表达,并且ODAM基因的过表达和缺失会引起基质金属蛋白20和釉丛蛋白表达的上升或下降,可引起小鼠牙齿的釉质发育异常。
国内外许多研究证实Runx 2可能与牙体硬组织的形成有关,然而,对于Runx 2对牙体硬组织形成的基因调控机制的研究却甚少。本实验构建了Runx 2的真核表达载体,并设计针对Runx 2的特异性小分子干扰RNA(siRNA)。分别将其转入小鼠成釉细胞中,通过RT-PCR检测Runx 2、AMTN、AMBN及ODAM mRNA的表达变化。结果显示,当Runx 2表达上调时,AMTN和AMBN mRNA的表达也上调,实验组与对照组的表达差异有统计学意义,但实验组与对照组ODAM mRNA的表达差异无统计学意义。当转染Runx 2-siRNA后,Runx 2沉默效果明显,实时定量PCR检测到AMTN和AMBN mRNA表达下调,实验组与对照组的差别有显著统计学意义,实验组与对照组ODAM mRNA的表达差异无统计学意义。本研究初步证实Runx 2通过调控AMTN及AMBN mRNA的表达参与牙体硬组织的发育,这为进一步研究Runx 2在牙釉质形成中的作用奠定了基础,对于牙釉质疾病的预防及治疗有潜在的指导作用。
[1]D'Souza RN,Aberg T,Gaikwad J,et al.Cbfa1 is required for epithelial-mesenchymal interactions regulating toothdevelopment in mice[J].Development,1999,126(13):2911-2920.
[2]Bronckers AL,Engelse MA,Cavender A,et al.Cell specific patterns of Cbfal mRNA and protein expression in postnatal murinedental tissues[J].Mechdev,2001,101(1 -2):255 -258.
[3]余擎,肖明振,朱庆林,等.核心结合因子a1在小鼠牙齿发育过程中的表达[J].牙体牙髓牙周病学杂志,2003,13(9):517-519.
[4]Chen S,Gu TT,Sreenath T,et al.Spatial expression of Cbfal/Runx2 isoforms in teeth and characterization of binding sites in thedSPPgene[J].Connect Tissue Res,2002,43(2-3):338 -344.
[5]Nakata A,Kameda T,Nagai H,et al.Establishment and characterization of a spontaneously immortalized mouse ameloblastlineage cell line[J].Biochem Biophys Res Commun,2003,308(4):834-839.
[6]Elbashir SM,Harboth J,Kendeckel W,et al.Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells[J].Nature,2001,411(6836):494 -498.
[7]Kenneth JL,ThomasdS.Analysis of relativegene expressiondata using real-time quantitative PCR and the 2-△△CTmethod[J].Methods,2001,25(4):402 -408.
[8]Aberg T,Cavender A,Gaikwad JS,et al.Phenotypic changes indentition of Runx 2 homozygote-null mutant mice[J].J Histochem Cytochem,2004,52(1):131 -139.
[9]Bronckers AL,Engelse MA,Cavender A,et al.Cell-specific patterns of Cbfal mRNA and protein expression in postnatal murinedental tissues[J].Mechdev,2001,101(1 -2):255 -258.
[10]Huq NL,Cross KJ,Ung M,et al.Reynolds.A review of protein structure andgene organisation for proteins associated with minerallised tissue and calcium phosphate stabilisation encoded on human chromosome4[J].Arch Oral Biol,2005,50(7):599-609.
[11]Ozdemird,Hart PS,Firatli E,et al.Phenotype of ENAM mutations isdosage-dependent[J].Jdent Res,2005,84(11):1036-1041.
[12]Park JC,Park JT,Son HH,et al.The amyloid protein APin is highly expressedduring enamel mineralization and maturation in rat incisors[J].Eur J Oral Sci,2007,115(2):153 -160.
[13]Moffatt P,Smith CE,St-Arnaud R,et al.Characterization of Apin,a secreted protein highly expressed in tooth-associated epithelia[J].J Cell Biochem,2008,103(3):941-956.
Effect of Runx 2 indevelopingdental enamel
HE Yong-yun,LIANGguang-zhi,LIU Xiao-ying,SUN Yan,GAO Yu-guang
(Institute of Stomotalogy,School of Stomotalogy,Weifang Medical University,Weifang 261053,China)
AIM:To investigate the regulating effects of Runx 2 on the expression of Amelotin(AMTN),Ameloblastin(AMBN)and odontogenic ameloblast-asssociated protein(ODAM)in ameloblasts.METHODS:A full length cDNA of Runx 2 was cloned from mouse ameloblast-lineage cell(ALC)by RT-PCR,and then it was subcloned into the pcDNA3.1-HisA plasmid after sequence analysis.One specificdicer siRNA targeted to Runx 2 mRNA wasdesigned and sythesized.The recombinant plasmid pcDNA3.1-HisA-Runx2 and the siRNA for Runx2 mRNA was transfected into ALC respectively.Quantitative real-time PCR was performed to measure the expression of Runx 2,AMTN,AMBN and ODAMgene.RESULTS:The siRNA-Runx2 elicited a high level ofgene silence in ALC.siRNA for Runx 2 effectively inhibited the expression of AMTN and AMBN.Runx2 overexpression by pcDNA3.1-HisA-Runx 2 plasmid transfection resulted in a significant higher mRNA level of AMTN and AMBN,but exerted no significant effect on the expression of ODAM.CONCLUSION:Runx 2 may play an important role indevelopingdental enamel by regulating the expression of AMTN and AMBN.
Runx 2;amelotin;ameloblastin;odontogenic ameloblast-asssociated protein,ODAM;RT-PCR
R780.2
A
1005-2593(2011)02-0062-05
2010-10-08;
2010-12-16
国家自然科学基金资助项目(36072316)
山东省自然科学基金资助项目(Y2006C106)
山东省教育厅基金资助项目(J08LH65)
何永云(1984-),女,汉族,山东省日照人。硕士生(导师:高玉光),研究方向:牙釉质发育
高玉光,E -mail:yuguanggao@wfmc.edu.cn
·短篇报道·
