涎腺腺样囊性癌VEGF和NOS的表达及其相关性*
2011-01-24李晓光于肖鹏李腾宇王旭霞王延秀
李晓光 于肖鹏 秦 艳 李腾宇 王旭霞 王延秀
(1.泰山医学院附属泰山医院,山东 泰安 271000; 2.泰安市第一人民医院,山东 泰安 271000;3.青岛大学医学院口腔系,山东 青岛 266071; 4.山东大学口腔医学院,山东 济南 250012)
血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管生成过程中的关键因子,其过度表达与肿瘤生长、侵袭及转移关系密切[1]。研究[2]发现,催化一氧化氮(nitric oxide,NO)生成的关键酶——一氧化氮合酶(nitric oxide synthase,NOS)活性的增高与肿瘤血管生成关系密切。本研究检测了涎腺腺样囊性癌VEGF、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的表达,以探讨VEGF、iNOS和eNOS在涎腺腺样囊性癌的表达及其相关性;研究NO和 VEGF的相互作用及在促肿瘤生长中的作用机制。
1 材料与方法
1.1临床资料及切片制备 32例涎腺腺样囊性癌组织均取自我院1984~2010年手术切除标本蜡块,患者年龄38~71岁,男11例,女21例。颈部淋巴结转移与否以术后病理检查结果为准。所有病人术前均未接受化疗或放疗,根据TNM国际统一分期法(UICC)进行临床分期,Ⅰ+Ⅱ 期23例, Ⅲ+Ⅳ期9例。 组织学分型为管状型6例,筛孔型15例,实体型11例。其中大涎腺17例(腮腺7例,颌下腺5例,舌下腺5例),小涎腺15例。蜡块制备5 μm厚连续切片,分别用抗VEGF单克隆抗体和 iNOS、eNOS多克隆抗体进行免疫组织化学染色,并做常规HE染色。
1.2免疫组织化学染色 第一抗体VEGF、iNOS、eNOS均为武汉博士德公司提供,3,3-二氨基苯联胺(DAB)为Sigma公司产品,染色方法参照试剂盒说明按SABC法进行。分别用1.5%正常兔血清和0.01 mol/L PBS液取代第一抗体作为替代对照和空白对照。用己证实 VEGF、iNOS、eNOS染色阳性的乳腺癌切片作阳性对照。
1.3VEGF、iNOS和eNOS的判断标准 肿瘤细胞内出现棕黄色颗粒为阳性,选择每张切片组织和细胞形态保持完整的组织区域进行免疫组化染色判断。根据纪小龙等[3]提供的免疫组化阳性判断标准,结合全国免疫组化技术与诊断标准化专题研讨会精神,按肿瘤细胞着色强度及阳性细胞比例,以10%以上细胞呈弱、中等强度阳性反应为标准,分为阳性及阴性。
1.4统计学处理 应用SPSS13.0软件进行数据处理, VEGF、iNOS、eNOS蛋白表达间的关系用χ2检验。P≤0.05具有统计学意义。
2 结 果
2.1涎腺腺样囊性癌VEGF、iNOS和eNOS的表达 32例涎腺腺样囊性癌组织中,有20例(62.5%)表达VEGF, VEGF阳性物质主要位于癌细胞的胞膜或胞浆(图1),而且肿瘤组织的周边细胞染色要强于中心组织。变性坏死癌组织周边VEGF染色较强。部分肿瘤血管内皮细胞及新生小血管内皮也呈阳性。有22例(68.75%)表达iNOS,阳性颗粒主要见于癌细胞胞浆内,为棕黄色,大多数为均匀着色,有的表现为小颗粒状(图2)。有25例(78.13%)表达eNOS,棕黄色癌细胞胞浆着色(图3)。
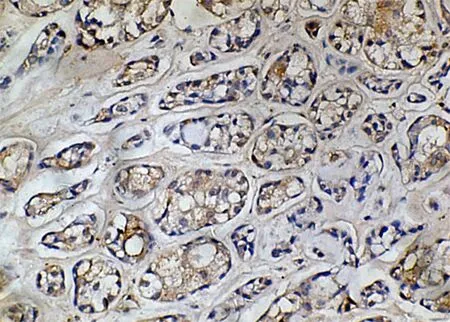
图1 VEGF阳性细胞浆内含有棕色颗粒(×400)
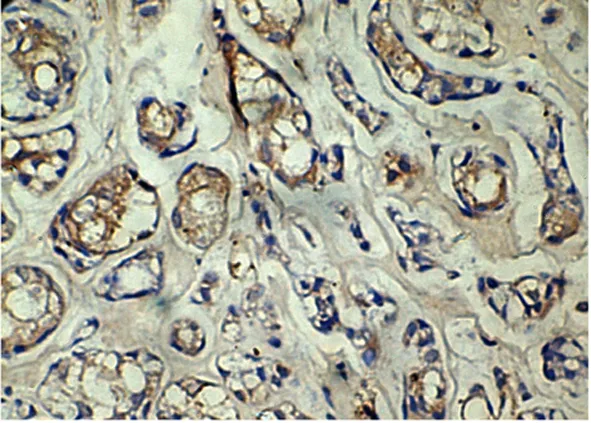
图2 iNOS阳性细胞浆内含有棕色颗粒(×400)

图3 eNOS阳性细胞浆内含有棕色颗粒(×400)
2.2涎腺腺样囊性癌VEGF、iNOS和eNOS表达的相关性 VEGF表达与iNOS表达具有明显的相关性(P<0.05,表 1), VEGF表达与eNOS表达无明显的相关性(P>0.05,表2)。
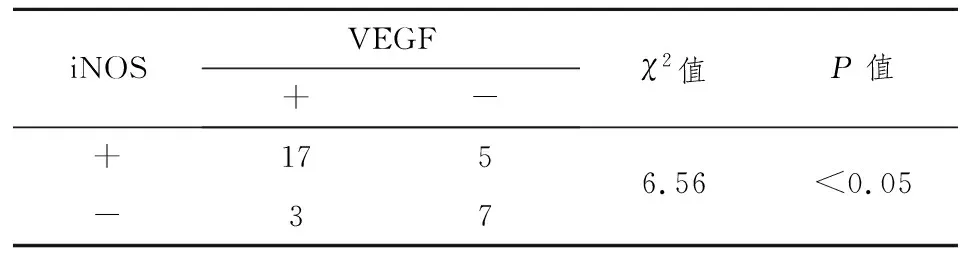
表1 涎腺腺样囊性癌组织VEGF表达与iNOS表达的关系

表2 涎腺腺样囊性癌组织VEGF表达与eNOS表达的关系
3 讨 论
VEGF是血管生成的关键因子,其表达与肿瘤生长、侵袭及转移关系密切[1]。近年的研究[2]指出NO作为重要的血管扩张剂,可刺激VEGF产生并参与VEGF促血管生成过程中的每一步骤。本研究中32例涎腺腺样囊性癌组织有20例(62.5%)表达VEGF,主要是癌细胞胞浆表达,VEGF表达具有明显的异质性,染色强度较高的肿瘤细胞多位于浸润前缘。肿瘤间质中也有散在分布的少数VEGF阳性的成纤维细胞。肿瘤血管内皮细胞也有部分表达VEGF,与癌巢较远的血管则无VEGF表达,说明肿瘤细胞分泌的 VEGF通过旁分泌方式作用于血管内皮细胞。
VEGF通过以下作用促进肿瘤的发生发展:①直接刺激内皮细胞分化增殖和迁移,加快基底膜降解,这不仅有利于血管生成,还有利于癌细胞脱落进入血管或向邻近纤维蛋白和结缔组织基质扩散,为肿瘤的浸润、转移创造条件。②增强血管通透性。③参与免疫系统的调节,使肿瘤细胞逃避免疫系统的监视。④诱发恶性腹水。⑤有研究[4]显示 VEGF通过 VEGFR-2来维持内皮细胞的存活,VEGFR-2的抗体可促进内皮细胞凋亡。
许多肿瘤组织中 NOS的表达增加,提示 NOS的异常表达以及NOS的生成可能与这些肿瘤的发生发展有关[5]。本研究中表达iNOS的涎腺腺样囊性癌有22例(68.75﹪),阳性颗粒主要见于癌细胞胞浆内,肿瘤间质中有部分巨噬细胞、肥大细胞也呈阳性。表达eNOS的有25例(78.13%)。NO可在肿瘤早期通过介导DNA损伤来参与复杂的癌症形成过程,还可通过刺激肿瘤细胞的侵袭性、诱导血管生成和调节免疫系统来促进肿瘤的生长、侵袭和转移[6]。有报道NOS活性的增高与肿瘤血管生成关系密切[2],肿瘤血管生成与肿瘤组织局部NO浓度、肿瘤类型和肿瘤细胞对NO的敏感性有关。高NO产量的肿瘤细胞死亡,而产生少量NO或存在于低水平NO环境中的瘤细胞以及对NO杀伤作用不敏感的瘤细胞生存下来[6]。 Gallo等[7]对头颈部肿瘤及以往对口腔癌[8-9]的研究结果亦提示NOS(eNOS和iNOS)的表达与肿瘤血管生成及肿瘤发展密切相关。
NO促血管生成的作用机制尚不清楚,但研究表明,NO主要在 VEGF调节的血管生成过程中发挥作用。有报道肿瘤细胞生成的 VEGF可增加内皮细胞生成NO[10-11],可增加内皮细胞NOS的活性[12]。VEGF与内皮细胞表面的受体结合后,激活c-Src酪氨酸激酶,通过细胞内钙调蛋白及磷酸肌醇激酶途径增强 NOS的表达,刺激产生 NO。NO又可增加VEGF的合成[13-14]。有研究[15]认为 NO通过增强VEGF基因启动子的活性来增加VEGF表达。另有报道认为NO在VEGF促血管内皮细胞增殖和迁移中起重要作用[16-17],而且NO还参与VEGF的促血管通透性的作用[18]。
综上所述,本研究结果显示iNOS的表达与VEGF的表达有关。体外实验表明,iNOS具有致突变性及诱发癌变的活性;体内实验亦表明由NO生成的亚硝胺对口腔肠道肿瘤的形成起一定作用。另有研究显示iNOS调节抗VEGF活性的血管生成抑制因子的表达,提示有必要对NOS和VEGF的相互作用机制进一步研究,探讨NO在VEGF促血管生成过程中所起的作用,从而提供更多有关肿瘤血管生成的生物学信息。
[1] Lee JC, Chow NH, Wang ST, et al. Prognostic value of vascular endothelial growth factor expression in colorectal cancer patients[J]. Eur J Cancer, 2000, 36(6): 748-753.
[2] Mattern J, Koomagi R, Volm M. Coexpression of VEGF and bFGF in human epidermoid lung carcinoma is associated with increased vessel density[J]. Anticancer Res, 1997, 17: 2249-2252.
[3] 纪小龙,施作霖.诊断免疫组织化学[M].北京:军事医学科学出版社,1997:25.
[4] Bruns CJ, Liu W, Davis DW, et al. Vascular endothelial growth factor is an in vivo survival factor for tumor endothelium in a murine model of colorectal carcinoma liver metastasis[J]. Cancer, 2000, 89(3): 488-499.
[5] Ambs S, Merriam WG, Ogunfusika MO, et al. p53 and vascular endothelial growth factor regulate tumor growth of NOS2-expressing human carcinoma cells[J]. Nat-Med, 1998, 4(12): 1371-1376.
[6] Wink DA, Vodovotz Y, Laval J, et al. The multifaceted roles of nitric oxide in cancer[J]. Carcinogenesis, 1998, 19(5): 711-721.
[7] Gallo O, Masini E, Morbidelli L, et al. Role of nitric oxide in angiogenesis and tumor progression in head and neck cancer[J]. J Nat Cancer Inst, 1998, 90:587-596.
[8] 李晓光,王延秀,高静,等.VEGF和NOS在口腔鳞癌组织中的表达[J].口腔颌面外科杂志,2004,14(3):203-207.
[9] 李晓光,李宁毅,王延秀,等.口腔鳞癌VEGF和NOS的表达与癌细胞增殖关系的研究[J].中华口腔医学杂志,2004,39(3):226.
[10] Jozkowicz A, Pankiewicz J, Pulak J, et al. Nitric oxide mediates the mitogenic effects of insulin and vascular endothelial growth factor but not of leptin in endothelial cells[J]. Acta Biochim Pol, 1999, 46(3): 703-715.
[11] Scalia R, Booth G, Lefer DJ. Vascular endothelial growth factor attenuates leukocyte-endothelium interaction during acute endothelial dysfunction: essential role of endothdium-derived nitric oxide[J]. FASEB J, 1999, 13(9): 1039-1046.
[12] Hood JD, Meininger CJ, Ziche M, et al. VEGF upregulates ecNOS message, protein and NO production in human endothelial cells[J]. Am J Physiol, 1998, 274:H1054-1058.
[13] Dulak J, Jozkowicz A, Dembinska-Kiec A, et al. Nitric oxide induces the synthesis of vascular endothelial growth factor by rat vascular smooth musde cells[J]. Arterioscler Thromb Vasc Biol, 2000, 20(3): 659-666.
[14] Kubo H, Fujiwara T, Jussila L. Involvement of vascular endothelial growth factor receptor-3 in maintainance of integrity of endothelial cell lining during tumor angiogenesis [J]. Blood,2000, 96(2): 546-553.
[15] Konopha TE, Barker JE, Bamford TL, et al. Nitric oxide synthase Ⅱ gene disruption: implications for tumor growth and vascular endothelial growth factor production [J]. Cancer Res,2001, 61 (7): 3182-3187.
[16] Kimura H, Weisz A, Kurashima Y, et al. Hypoxia response element of the human vascular endothelial growth factor gene mediates transcriptional regulation by nitric oxide: control of hypoxia-inducible factor-1 activity by nitric oxide[J]. Blood,2000, 95(1): 189-197.
[17] Eroglu A, Demirci S, Ayyildiz A, et al. Serum concentrations of vascular endothelial growth factor and nitrite as an estimate of in vivo nitric oxide in patients with gastric cancer[J]. Br J Cancer, 1999, 80(10): 1630-1664.
[18] Vriese AS, Tilton RG, Elger M, et al. Antibodies against vascular endothelial growth factor improve early renal dysfunction in experimental diabetes[J]. J Am Soc Nephrol, 2001, 12(5):993-1000.
