双波长比例法测定单细胞活性氧探析
2011-01-15赵成瑞崔香丽吴博威山西医科大学汾阳学院生理教研室汾阳0300山西医科大学生理学系通讯作者Tel0358733mailzhaochengruizcr63com
赵成瑞, 崔香丽, 吴博威 (山西医科大学汾阳学院生理教研室, 汾阳 0300;山西医科大学生理学系;通讯作者,Tel:0358 -733,E-mail:zhaochengruizcr@63.com)
双波长比例法测定单细胞活性氧探析
赵成瑞1*, 崔香丽2, 吴博威2(1山西医科大学汾阳学院生理教研室, 汾阳 032200;2山西医科大学生理学系;*通讯作者,Tel:0358 -7231312,E-mail:zhaochengruizcr@163.com)
目的 建立双波长比例法测定单细胞活性氧的方法。 方法 ①酶法急性分离成年大鼠心室肌细胞,用离子影像系统测定荧光信号,确定荧光强度值变化相反的两个激发光波长。②BPS-4装置灌流心肌细胞,模拟心肌缺血/再灌注模型及再灌注时应用还原型谷胱甘肽,用双波长比例法测定细胞内活性氧含量变化,验证此法。 结果 ①荧光强度值最大和最小的激发光波长分别是:480 nm和420 nm,以F480/F420的比值表示活性氧的含量。②心室肌细胞在模拟缺血期和恢复再灌注期的相对F480/F420分别为缺血前的(115.27±4.52)%和(116.99±3.99)%,在再灌注期给予GSH,则活性氧含量降为缺血前的(101.14±3.20)%。 结论 双波长比例法可用于测定细胞内活性氧。
活性氧; 缺血再灌注; 还原型谷胱甘肽
活性氧是化学性质较活泼的含氧代谢物质,反应性强、寿命短,难检测[1,2],因此研究其检测方法尤为重要。生物学、医学最先研究活性氧的方法有脉冲射解、顺磁共振和自旋搜集技术,利用化学荧光指示剂二氯二氢荧光素乙酸酯(2',7'-dichlorofluorescin diacetate,DCFH-DA),设定激发波长为 480 nm左右,发射波长为510 nm,用测得的DCF荧光信号来间接反映活性氧含量,是一种单波长法[3-6]。这些方法所需仪器昂贵,不适于普及,且所测结果受染料导入细胞内的浓度、细胞厚度、光褪色和染料漏出胞外等因素影响而不准确,特建立双波长比例法,利用离子影像系统,测定细胞内的活性氧。
1 材料与方法
1.1 试剂及主要仪器 胶原酶P、化学荧光染料DCFH-DA、二甲基亚砜、牛磺酸、L-谷氨酸、还原型谷胱甘肽、N-2-羟乙基哌嗪-N'-2-乙烷磺酸、乙二醇(2-氨基乙醚)四乙酸为Sigma公司产品;其余均为国产分析纯试剂。离子影像分析系统为德国Tillphotonics公司产品;BPS-4灌流装置为美国Ala Scientific Instruments Inc公司产品;倒置荧光显微镜为德国Zeiss公司产品。
1.2 动物来源 Wistar大鼠,体重280-300 g,雌雄不拘,由山西医科大学实验动物中心提供。
1.3 方法
1.3.1 确定荧光强度值变化相反的两个波长 酶法急性分离单个大鼠心室肌细胞。复钙、负载染料DCFH-DA、选取结构良好的细胞用10 mmol/L的双氧水进行灌流。设置激发光波长从340 nm到580 nm,以20 nm波长的间隔递增,对细胞进行扫描,记录荧光光谱曲线及每个波长下的荧光强度值,发射光波长固定为510 nm,确定荧光强度值变化相反的两个波长。
1.3.2 心肌细胞内活性氧含量的测定 酶法急性分离单个大鼠心室肌细胞。复钙、负载染料DCFHDA、选取结构良好的细胞进行实验。设置激发光波长分别为480 nm和420 nm,系统发射光的波长定为510 nm。离子影像系统依次采集激发光为480 nm和420 nm的成对系列图像,并从同一对系列图像计算出的荧光比值F480/F420,细胞内活性氧水平以F480/F420表示。并计算出相对于正常(缺血前)的相对荧光密度,以表示细胞内活性氧的变化,结果以相对荧光密度表示(100%)。
1.3.3 心肌细胞模拟缺血再灌注模型的建立 利用BPS-4装置对心肌细胞进行灌流。在对心肌细胞进行灌流以前,盛有缺血台式液的容器被封闭,并通过特制旁口持续充以100%的氮气40 min。心肌细胞模拟缺血:将心肌细胞置于特制灌流槽内,用模拟缺血台氏液,对心肌细胞进行灌流,并通过灌流槽特制侧孔在灌流槽的上方持续充以100%氮气,在灌流槽上方置以载玻片,使灌流槽形成一密闭腔。心肌细胞模拟再灌注:灌以正常台氏液,停止充氮气,并开放灌流槽。在实验中监测灌流液氧分压,以模拟缺血后氧分压为55-60 mmHg为模型成功。
1.3.4 心肌细胞再灌注时抗氧化剂的应用 心肌细胞模拟缺血后,利用BPS-4装置对心肌细胞以含有0.8 mmol/L还原型谷胱甘肽(GSH)的台氏液进行灌流。
1.3.5 实验分组 心肌细胞被随机分为3组:正常台氏液灌注组(control group):心肌细胞给予30 min正常台氏液灌注;模拟缺血/再灌注组(I/R group):心肌细胞先给予2 min正常台氏液灌注,之后给予20 min模拟缺血和8 min模拟再灌注;抗氧化剂保护组(GSH group):心肌细胞先给予2 min正常台氏液灌注,之后给予20 min模拟缺血和8 min的含GSH的台氏液再灌注。
1.4 统计学分析所有数据均以¯x±s表示。采用SPSS10.0统计软件对数据进行分析,两组间比较用t检验,以P<0.05认为差异有统计学意义。
2 结果
2.1 通过对选取细胞进行实验后记录的荧光光谱曲线,以及每个激发光波长下的荧光强度值进行分析发现,荧光信号强度值变化相反的两个激发光波长分别是480 nm和420 nm,在480 nm时荧光信号强度值最大,在420 nm时荧光信号强度值最小(见图1),并且在实验的细胞所得结果都一致和稳定。所以确定这两个波长作为用双波长比例测量法测定单细胞活性氧的两个激发光波长,以F480/F420的形式表示细胞内的活性氧。
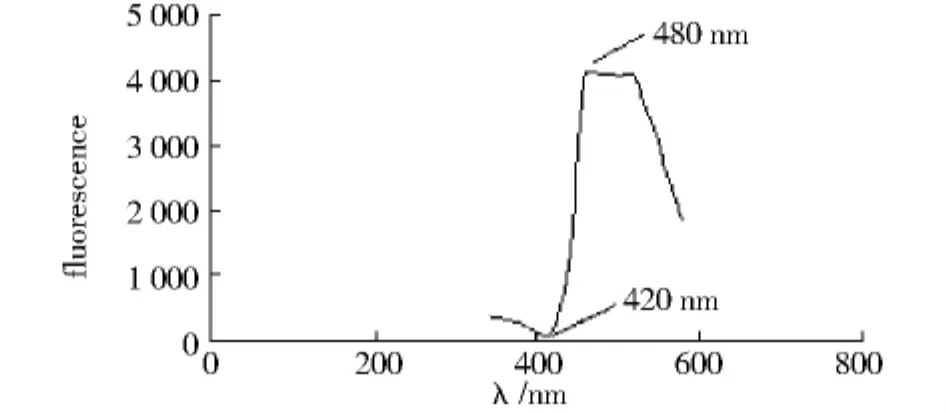
图1 各个激发光波长下的荧光强度值Fig 1 The fluorescence intensities at different excitation wavelengths
2.2 正常台氏液灌注时,细胞内荧光强度比值(F480/F420)相对稳定(见图2);模拟缺血后,细胞荧光强度比值迅速增加,在缺血末20 min时相对荧光密度为(115.27±4.52)%;再灌注后,心肌细胞的荧光强度比值在2 min内出现高峰,之后轻度降低维持在相对较高的水平,相对荧光密度为(116.99±3.99)%(见表1,图3);若再灌注时加入 0.8 mmol/L还原型谷胱甘肽,细胞荧光强度比值迅速下降,相对荧光密度为(101.14 ±3.20)%(见表1,图4)。

图2 正常台式液灌注组心肌细胞内荧光强度比值Fig 2 The fluorescence intensities of intracellular ROS in cardiomyocytes in control group

表1 模拟缺血再灌注与用GSH心肌细胞相对荧光密度比较(%)Tab 1 Comparison of relative fluorescene intensities of intracellular ROS in cardiomyocytesin I/R group and GSH group (%)
与 control组比较,△P <0.05;与 I/R 组比较,#P <0.05

图3 模拟缺血再灌注组心肌细胞内荧光强度比值Fig 3 The fluorescence intensities of intracellular ROS in cardiomyocytes in I/R group
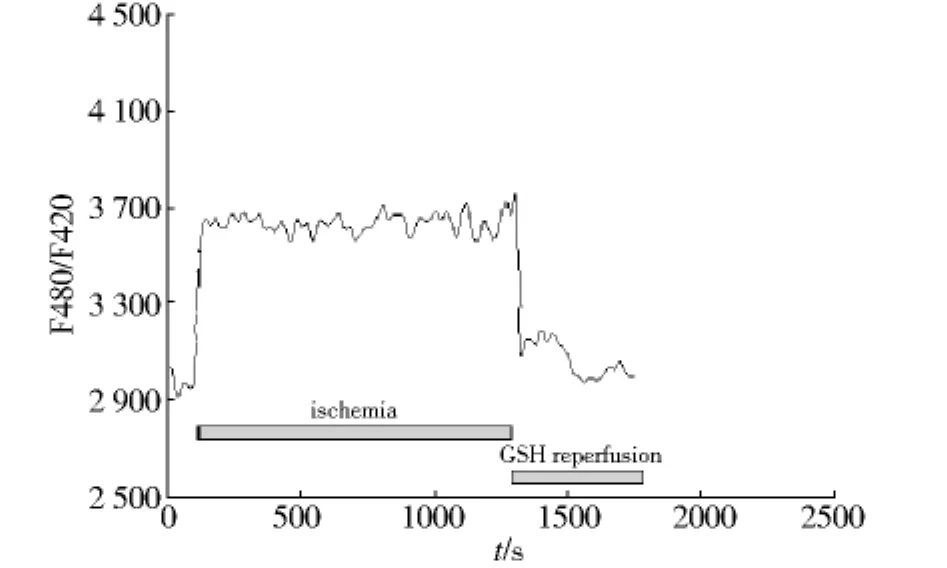
图4 模拟缺血后用GSH组心肌细胞内荧光强度比值Fig 4 The fluorescence intensities of intracellular ROS in cardiomyocytes in GSH group
3 讨论
利用离子影像系统建立双波长比例法测定心肌细胞内的活性氧。在实验中发现,激发光波长为480 nm时,所得到的DCF荧光信号强度值最大,这与目前已知的用激光共聚焦扫描显微镜、流式细胞仪等仪器使用480 nm的激发光波长测定细胞内的活性氧相一致[7,8]。实验中检测到的420 nm的激发光波长时所得的荧光信号强度值最小,所以确定这两个激发光波长,建立双波长比例测量法。模拟缺血再灌注模型,用此法检测细胞内活性氧的变化,与已知的缺血再灌注发生中活性氧的变化情况进行对比,验证此法的可行性[9]。
双波长比例测量法检测细胞内的活性氧,缺血期心肌细胞内活性氧含量升高,在再灌注刚开始2 min内,活性氧含量迅速升高,产生一个峰值,后下降,但是仍然保持较高水平,和缺血期间没有明显差异。再灌注时,加还原型谷胱甘肽后心肌细胞内的活性氧含量明显下降至接近于正常水平,与电子自旋共振技术直接测定活性氧的结果是一致的[10],说明了这种方法可以用来检测心肌细胞内的活性氧。
双波长比例法具有以下明显优于单波长法的优点:不受染料导入细胞内的浓度、细胞厚度、光褪色和染料漏出胞外等影响,所测结果以比值的形式来表示,消除了背景荧光强度的干扰,更加准确。这是一种简便、易行的测定方法,建立后将有助于活性氧在有关研究领域的开展。当然这种方法还只是处于一种初步建立阶段,更多的实验工作、检测指标正在进一步的完成中。
[1] Frank J,Pompella A,Biesalski HK.Histochemical visualization of oxidant stress[J].Free Radic Biol Med,2000,29(11):1096 -1105.
[2] Greeberg ER,Baron JA,Tosteson TD,et al.A clinical trial of antioxidant vitamins to prevent colorectal adenoma[J].NEJM,1994,331:141 -147.
[3] Duranteau J,Chandel NS,Schumacker PT.Intracellular signaling by reactive oxygen species during hypoxia in cardiomyocytes[J].Biol Chem,1998,273:11619 -11624.
[4] Kehrer JP,Paraidathathu T.The use of fluorescent probes to assess oxidative processes in isolated-perfused rat heart tissue[J].Free Radic Res Commun,1992,16:217 -225.
[5] Khalid MA,Ashraf M.Direct detection of endogenous hydroxyl radical production in cultured adult cardiomyocytes during anoxia and reoxygenation.Is the hydroxyl really the most damaging radical species[J].Circ Res,1993,72:725 - 376.
[6] Sarvazyan N.Visualization of doxorubicin-induced oxidative stress in isolated cardiac myocytes[J].Heart Circ Physiol,1996,271:H2079-H2085.
[7] Fu Y,Ji LL.Chronic ginseng consumption attenuates age-associated oxidative stress in rats[J].J Nutr,2003,133:3603 -3609.
[8] Carter WO,Narayanan PK,Robinson JP.Intracellular hydrogen peroxide and superoxide anion detection in endothelial cells[J].Leukoc Biol,1994,55(2):253 - 258.
[9] Moens AL,Claeys MJ,Timmermans JP,et al.Myocardial ischemia/reperfusion injury,a clinical view on a complex pathophysiological process[J].Cardiology,2005,100:179 - 190.
[10] 金惠铭,王建枝.病理生理学[M].6版.人民卫生出版社,2004:202-203.
Double wavelengths ratio in detection of the concentrations of reactive oxygen species
ZHAO Cheng-rui1*,CUI Xiang-li2,WU Bo-wei2(1Dept of Physiology,Fenyang College of Shanxi Medical University,Fenyang 032200,China;2Dept of Physiology,Shanxi Medical University;*Corresponding author,Tel:0358-7231312,E-mail:zhaochengruizcr@163.com)
ObjectiveTo establish the double wavelengths ratio for detecting the concentrations of reactive oxygen species(ROS)in single cell.Methods①Adult rat cardiomyocytes were isolated by enzymatic dissociation.Fluorescence signals of the single cell were recorded by the ion imaging system for finding the two excitation wavelengths which made the biggest and the smallest fluorescence signal intensities.②Cardiomyocytes were perfused with BPS-4 to imitate the ischemia/reperfusion model.Some cardiomyocytes were reperfused with GSH.The intracellular ROS concentrations were measured.Results①The values of the fluorescence intensity at 480 nm and 420 nm were the biggest and smallest,respectively.F480/F420 was used to represent the intracellular ROS concentrations.②At mimic ischemia and reperfusion stages,intracellular ROS fluorescence intensities(F480/F420)increased progressively to(115.27 ±4.52)%and(116.99 ±3.99)%of pre-ischemia respectively.When GSH was used in reperfusion,ROS fluorescence intensity decreased quickly to(101.14 ±3.20)%of pre-ischemia.ConclusionDouble wavelengths ratio could be used to detect intracellular ROS.
reactive oxygen species;ischemia reperfusion;reduced glutathione
O657
A
1007 -6611(2011)01 -0007 -03
10.3969/J.ISSN.1007 -6611.2011.01.002
赵成瑞,女,1980-02生,硕士,助教,E-mail:zhaochengruizcr@163.com.
2010-11-01]
