4-氯喹唑啉类化合物的合成
2011-01-14戴佳亮洪一鸣何小飞沈振陆莫卫民
戴佳亮 洪一鸣 熊 杰 何小飞 沈振陆 莫卫民
(浙江工业大学化学工程与材料学院,浙江 杭州 310014)
N-取代-4-氨基喹唑啉类化合物具有广泛的生理活性,现已成为新药开发创制的研究热点之一。例如,6,7,8-三甲氧基-N-芳基-4-氨基喹唑啉衍生物对PC3、A431、Bcap-37和GC823等肿瘤细胞有抑制作用的[1];5-取代-4-苯胺喹唑啉衍生物是erbB2受体酪氨酸激酶的有效抑制剂[2];N上吡唑环取代的4-氨基喹唑啉衍生物,作为Aurora B激酶抑制剂有活性[3];国内宋宝安课题组也合成了一些具有生物活性的N-取代-4-氨基喹唑啉类化合物[4-6]。近年来,一些具N-取代-4-氨基喹唑啉结构的药物,例如:吉非替尼(Gefitinib),埃罗替尼(Erlotinib),二甲苯磺酸拉帕替尼(Lapatinib ditosylate),卡纽替尼二盐酸盐(Canertinib dihydrochloride)等都已陆续上市[7]。
N-取代-4-氨基喹唑啉类化合物的合成方法通常是以4-氯喹唑啉类化合物和胺类化合物为原料,在碱性或酸性条件下经SNAr取代反应得到。我们还研究了Pd2(dba)3/Xantphos/Na2CO3条件下4-氯喹唑啉类化合物和3-氨基-1H-吡唑化合物经选择性C-N成键合成新型N-取代-4-氨基喹唑啉类化合物的反应[8]。因此,4-氯喹唑啉类化合物的合成是研究N-取代-4-氨基喹唑啉衍生物的一个重要内容。
1 实验部分
1.1 仪器和试剂
本文用的试剂若无特别说明,均为市售CP或AR级,不经特别处理,直接使用。美国Aglient公司6210 LC/TOF和美国Thermo公司DECX-60000 LCQ Deca XP质谱仪;德国Bruker公司Bruker DRX 500核磁共振仪;四川大学科仪厂XRL-1显微熔点测定仪;美国Varian公司ProStar高效液相色谱。
1.2 合成路线
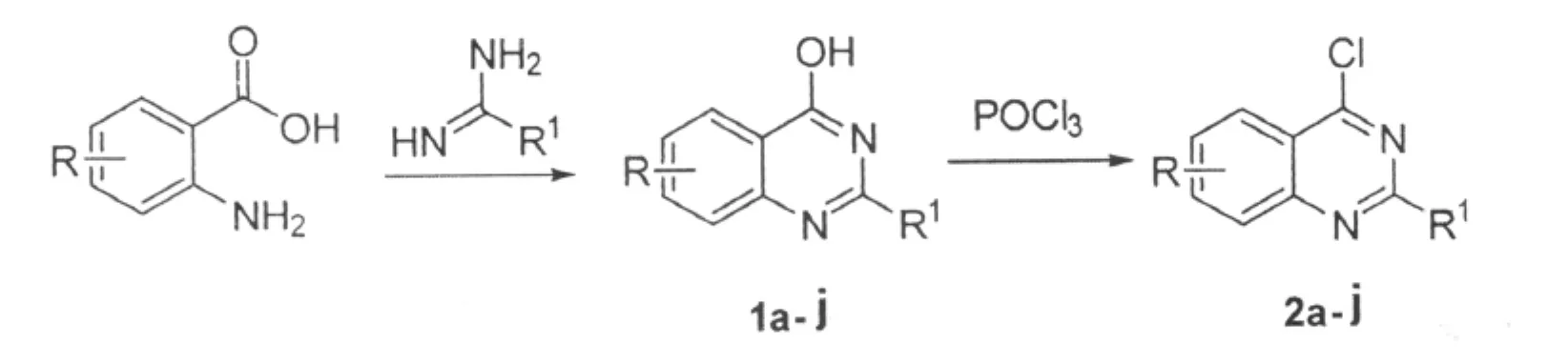
1.3 实验步骤
0.1mol邻氨基苯甲酸类化合物,0.2mol醋酸甲脒或醋酸乙脒,100mL异戊醇投入250mL三口烧瓶中,回流8h,冷却,过滤得到白色固体,即为喹唑啉-4(3H)-酮类化合物1,分离收率见表1。
100mL三口烧瓶中投入8mmol化合物1,20mL POCl3,数滴(i-Pr)2NEt,回流2.5h,减压蒸馏除去多余的POCl3,冷却,在冰浴条件下加入80mL CH2Cl2溶解反应产物,然后把CH2Cl2溶液慢慢倾入100mL 1mol/L的冰盐酸中,再用100mL 1mol/L的冰盐酸洗涤反应瓶,合并两部分溶液,振荡分层,有机层用无水硫酸钠干燥,过滤,滤液用无水K2CO3搅拌至pH值为中性,过滤,减压浓缩,过柱得到产物2,分离收率见表1。
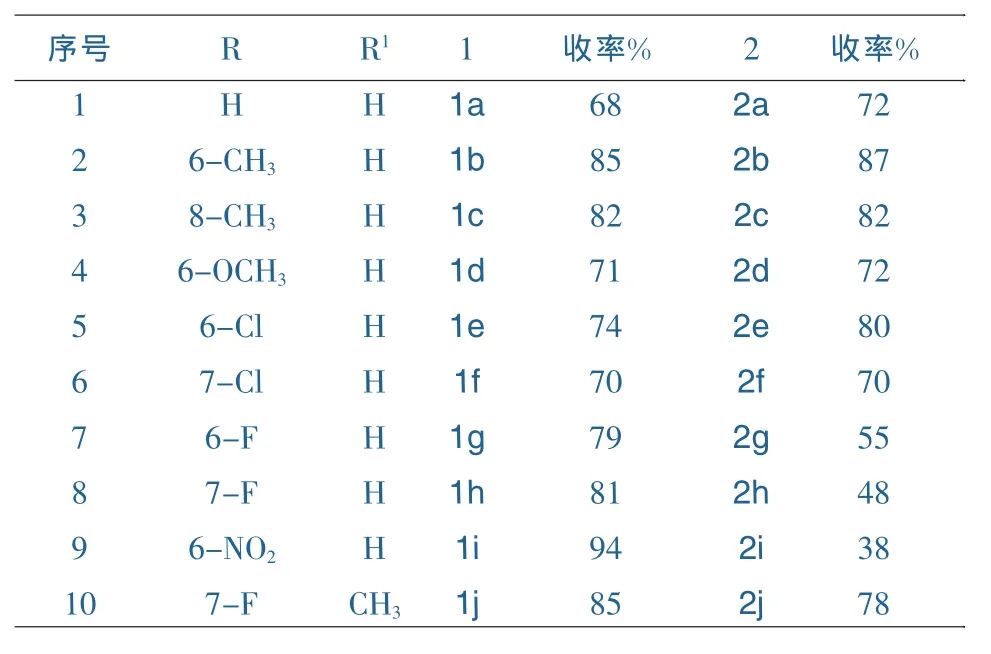
表1 中间体1和产物2的分离收率
2 结果与讨论
2.1 产物鉴定
1a,白色固体,mp=198℃~200℃;1H NMR(DMSO-d6),δ7.51~7.54(m,1H),7.67(d,J=8Hz,1H),7.80~7.84(m,1H),8.09(s,1H),8.12~8.13(m,1H),12.24(br,s,1H);MS(ESI),(m/z),146.0[M+H+]。
1b,白色固体,mp=258℃~259℃;1H NMR(DMSO-d6),δ2.44(s,3H),7.57(d,1H,J=8.5Hz),7.63~7.65(m,1H),7.92(m,1H),8.02(s,1H),12.07(br,s,1H);MS(ESI),(m/z),161.1[M+H+]。
1c,白色固体,mp=249℃~251℃;1H NMR(DMSO-d6),δ2.50(s,3H),7.39~7.42(m,1H),7.68(d,1H,J=7.5Hz),7.97(d,1H,J=7.5Hz),8.12(s,1H),12.20(br,s,1H);MS(ESI),(m/z),161.1[M+H+]。
1d,白色固体,mp=242℃~243℃;1H NMR(DMSO-d6),δ3.87(s,3H),7.41~7.43(m,1H),7.51(d,1H,J=3Hz),7.62(d,1H,J=9Hz),7.98(s,1H),12.19(br,s,1H);MS(ESI),(m/z),177.1[M+H+]。
1e,白色固体,mp=262℃~264℃;1H NMR(DMSO-d6),δ7.71(d,1H,J=7Hz),7.84~7.86(m,1H),7.06(d,1H,J=2.5Hz),8.14(s,1H),12.44(br,s,1H);MS(ESI),(m/z),181.2[M+H+]。
1f,白色固体,mp=249℃~250℃;1H NMR(DMSO-d6),δ7.56~7.58(m,1H),7.74(d,1H,J=2Hz),8.12(d,1H,J=8.5Hz),8.15(s,1H),12.42(br,s,1H);MS(ESI),(m/z),181.5[M+H+]。
1g,白色固体,mp=238℃~240℃;1H NMR(DMSO-d6),δ7.69~7.81(m,3H),8.10(s,1H),12.38(br,s,1H);MS(ESI),(m/z),164.9[M+H+]。
1h,白色固体,mp=234℃~244℃;1H NMR(DMSO-d6),δ7.38~7.42(m,1H),7.45~7.47(m,1H),8.16(s,1H),8.17-8.20(m,1H),12.43(br,s,1H);MS(ESI),(m/z),165.1[M+H+]。
1i,棕色固体,mp=282℃~283℃;1H NMR(DMSO-d6),δ7.87(d,1H,J=9Hz),8.32(s,1H),8.12(d,1H,J=8.5Hz),8.54~8.56(m,1H),8.81(d,1H,J=3Hz),12.76(br,s,1H);MS(ESI),(m/z),192.0[M+H+]。
1j,白色固体,mp=246℃~248℃;1H NMR(DMSO-d6),δ2.352(s,3H),7.296~7.363(m,2H),8.113~8.143(m,1H),12.310(br,s,1H);MS(ESI),(m/z),178.0[M+H+]。
2a,白色固体,mp=73℃~74℃;1H NMR(CDCl3),δ7.73~7.76(m,1H),7.96~8.00(m,1H),8.07~8.09(d,1H,J=8.5Hz),8.27~8.28(m,1H),9.06(s,1H);13C NMR(CDCl3),δ124.00,125.78,128.76,129.05,134.91,151.06,153.65,162.46;MS(APCI),(m/z),165.0[M+H+]。
2b,白色固体,mp=83℃~84℃;1H NMR(DMSO-d6),δ2.59(s,3H),7.95~8.02(m,3H),9.04(s,1H);13C NMR(DMSO),δ21.75,123.49,124.30,128.55,138.17,140.52,149.59,153.35,161.02;MS(APCI),(m/z),179.0[M+H+]。
2c,白色固体,mp=112℃~113℃;1H NMR(CDCl3),δ2.78(s,3H),7.59~7.624(m,1H),7.79~7.80(d,1H,J=7Hz),8.10~8.12(d,1H,J=6.5Hz),9.06(s,1H);13C NMR(CDCl3),δ17.52,123.51,124.01,128.55,134.85,137.40,150.27,152.63,162.62;MS(APCI),(m/z),179.0[M+H+]。
2d,白色固体,mp=89℃~90℃;1H NMR(CDCl3),δ4.01(s,3H),7.43~7.44(d,1H,J=2.5Hz),7.58~7.61(m,1H),7.96~7.98(d,1H,J=9Hz),8.94(s,1H);13C NMR(CDCl3),δ56.03,102.63,125.16,128.10,130.33,147.32,151.71,159.55,160.55;MS(APCI),(m/z),195.0[M+H+]。
2e,白色固体,mp=141℃~142℃;1H NMR(CDCl3),δ7.91~7.92(d,1H,J=9Hz),8.03~8.05(d,1H,J=9Hz),8.27(s,1H),9.06(s,1H);13C NMR(CDCl3),δ124.64,124.67,130.53,135.03,135.98,149.55,153.85,161.46;MS(APCI),(m/z),199.0[M+H+]。
2f,白色固体,mp=113℃~114℃;1H NMR(CDCl3),δ7.68~7.71(m,1H),8.08(d,1H,J=2Hz),8.2~8.23(d,1H,J=9Hz),9.05(s,1H);13C NMR(CDCl3),δ122.47,127.21,127.87,130.22,141.48,151.55,154.70,162.39;MS(APCI),(m/z),199.0[M+H+]。
2g,白色固体,mp=116℃~117℃;1H NMR(CDCl3),δ7.73~7.77(m,1H),7.89~7.99(m,1H),8.10~8.13(m,1H),9.05(s,1H);13C NMR(CDCl3),δ109.57,109.77,125.00,125.08,125.44,125.65,131.82,131.89,148.34,153,27,53.29,161.92,161.97,160.47,162.48;MS(APCI),(m/z),183.0[M+H+]。
2h,白色固体,mp=76℃~78℃;1H NMR(CDCl3),δ7.50~7.54(m,1H),7.70~7.72(m,1H),8.31~8.34(m,1H),9.04(s,1H);13C NMR(CDCl3),δ112.78,112.95,119.53,119.94,121.21,128.74,128.83,152.75,152.86,154.72,162.19,165.20,167.26;MS(APCI),(m/z),183.0[M+H+]。
2i,黄色固体,mp=105℃~106℃;1H NMR(CDCl3),δ8.26~8.28(d,1H,J=9Hz),8.74~8.76(m,1H),9.22(d,1H,J=3.5Hz),9.225(s,1H);13C NMR(CDCl3),δ122.41,123.12,128.84,129.16,145.53,149.46,152.84,160.41;MS(APCI),(m/z),210.0[M+H+]。
2j,白色固体,mp=81℃~82℃;1H NMR(CDCl3),δ2.85(s,3H),7.40~7.44(m,1H),7.59~7.60(m,1H),8.25~8.28(m,1H);13C NMR(CDCl3),δ26.07,112.05,112.21,118.37,118.57,119.00,128.58,128.67,153.15,153.26,161.81,164.84,165.32,167.37;MS(APCI),(m/z),197.0[M+H+]。
2.2 氯化反应
中间体喹唑啉-4(3H)-酮类化合物1的氯化通常是以POCl3或POCl3/PCl5为氯化试剂进行。由于氯化产物4-氯喹唑啉类化合物对水较为敏感,容易水解,因此,后处理方式对产物的收率影响很大。采用本文的后处理方式,可较大限度地抑制产物的水解,获得较高的收率。本文的氯化反应收率与一般文献报道的收率相比有较大幅度的提高,例如,本文中产物2e的氯化反应收率为80%,而文献报道的收率仅为15%左右[6]。
3 结论
以邻氨基苯甲酸类化合物和醋酸甲脒或醋酸乙脒为原料,经环合反应能以较高收率得到喹唑啉-4(3H)-酮类化合物,再以POCl3为氯化试剂进行氯化,得到可用于合成N-取代-4-氨基喹唑啉类化合物的重要中间体4-氯喹唑啉类化合物。氯化反应中采用本文所述的后处理方法,能有效提高产物的收率。
[1]Liu G,Hu D Y,Jin L H,et al.Synthesis and bioactivities of 6,7,8-trimethoxy-N-aryl-4-aminoquinazoline derivatives[J].Bioorg.Med.Chem.Lett.,2007,15:6608-6617.
[2]Mortlock A A,Foote K M,Heron N M,et al.Discovery,Synthesis,and in vivo activity of a new class of pyrazoloquinazolines as selective inhibitors of Aurora B kinase[J].J.Med.Chem.,2007,50:2213-2224.
[3]Barlaam B,Ballard P,Bradbury R H,et al.A new series of neutral 5-substituted 4-anilinoquinazolines as potent,orally active inhibitors of erbB2 receptor tyrosine kinase[J].Bioorg.Med.Chem.Lett.,2008,18:674-678.
[4]张培权,宋宝安,杨松,等.6-氟-4-(N-芳基)-胺基喹唑啉类化合物的微波合成及生物活性研究[J].有机化学,2006,26:1275-1278.
[5]刘刚,宋宝安,桑维钧,等.N-取代芳环-4-生物活性研究[J].有机化学,2004,24:1296-1299.
[6]杨松,刘刚,宋宝安,等.4-(N-取代芳基)氨基喹唑啉类化合物的合成及抗磷酸化活性研究[J].有机化学,2006,26:1429-1433.
[7]Barker A J,Gibson K H,Grundy W,et al.Studies leading to the identification of ZD1839(IressaTM):An orally active,selective epidermal growth factor receptor tyrosine kinase inhibitor targeted to the treatment of cancer[J].Bioorg.Med.Chem.Lett.,2001,11:1911-1914.
[8]Shen Z L,Hong Y M,He X F,et al.Switching the chemoselectivity in the amination of 4-chloroquinazolines with aminopyrazoles[J].Org.Lett.,2010,12:552-555.
