绵羊FGF5基因编码蛋白的生物信息学分析
2011-01-11刘伍限贾斌石国庆
刘伍限,贾斌,石国庆,2
(1石河子大学动物科技学院,石河子832003;2新疆农垦科学院,石河子832000)
利用生物信息学分析基因和蛋白质的序列模式,不仅可以对基因的分子进化和相似性进行研究,也可以进一步研究基因编码蛋白的结构与功能之间的关系。
本实验将克隆获得的绵羊FGF5基因,借助生物信息学手段,对其编码蛋白进行了蛋白理化特性、氨基酸序列以及二级结构预测,以期为进一步研究FGF5基因的结构、表达与调控及生物学功能奠定基础。
1 材料与方法
1.1 实验材料
Taq DNA聚合酶和pMDTM18-T Vector购自TaKaRa公司,dNTP(s),PCR引物由北京擎科生物技术有限公司合成,DL2000DNA Ladder购自天根公司,感受态大肠杆菌BL21(DE3)购自美国Novagen公司,大肠杆菌DH5α为本实验室保存。其他试剂均为国产分析纯。
1.2 方法
1.2.1 引物的设计和PCR扩增
参照牛FGF5基因(NM_001078011),并运用软件Primer 2.0在其保守性区域设计引物,上游引物为 5′-ATGAGCTTGTCCTTCCTCCT-3′,下 游 引物为5′-TTAACCAAAGCGAAACTTGA-3′,引物送于北京擎科生物技术有限公司合成。以绵羊皮肤组织cDNA为模板进行PCR扩增,克隆得到目的基因。PCR扩增程序如下:94℃预变性5min,94℃变性30s,60℃复性30s,72℃延伸30s,35个循环,最后72℃延伸10min。
1.2.2 FGF5基因的克隆和测序
将PCR产物在2%的琼脂糖凝胶中电泳并回收,PCR扩增产物经纯化连接到pMD18-T载体上,转化到大肠杆菌DH5a,酶切鉴定后由北京擎科生物技术有限公司进行测序。将测序结果提交网站比对,以检测是否为需要的序列。
1.2.3 序列分析
利用Vector NTI Suite 8中ORF finder确定其完整编码区(CDS)获得其正确氨基酸编码序列;运用蛋白在线分析工具及软件对该蛋白进行各级结构及特征分析:采用 ProtParam(http://au.expasy.org/cgi-bin/protparam)程序,预测 FGF5蛋白分子质量、等电点等理化性质;采用SOSUI(http://bp.nuap.nagoya-u.ac.jp/sosuil/)程序,分析 FGF5蛋白的可溶性;采用DNAMAN软件,分析FGF5蛋白的亲(疏)水性,并预测其亲水性高的区域;采用MotifScan(http://myhits.isb-sib.ch/cgi-bin/motif_scan)程序,预测蛋白的翻译后修饰位点;采用TMH-MM2.0服务器对蛋白进行跨膜分析;利用SignalP 3.0系统预测FGF5蛋白的信号肽序列;通过TargetP 1.1和PSORTⅡprediction在线软件进行绵羊FGF5蛋白的细胞定位分析;采用HNN软件 (http://npsa-pbil.ibcp.fr/cgi-bin/npsa-automat.pl),分析FGF5蛋白的二级结构;通过Gene Runner软件和DNAMAN软件,分析FGF5蛋白潜在的抗原表位,预测其免疫原性。
当然,简约的课堂,不仅是学情了解、教学目标、教学主线、教学结构、教学方法、教学评价上的简约,还包括了简练的教学语言、精致的教学练习、简易的教学手段、适当的媒介应用等。简约不是简单的删减,是“豪华落尽见真淳,铅华洗却见本色”的浓缩,是“三言两语是精华,一枝一叶总关情”。课堂的高效理应从简约开始!
2 结果与分析
2.1 绵羊FGF5基因cDNA的克隆
根据牛的同源保守区域,并运用Primer 2.0在其同源性高的区域设计引物,以绵羊皮肤cDNA为模板进行PCR扩增,得到1条813bp的目的条带(图1),经克隆、酶切鉴定和测序、BLAST比对确定为绵羊FGF5基因cDNA序列。
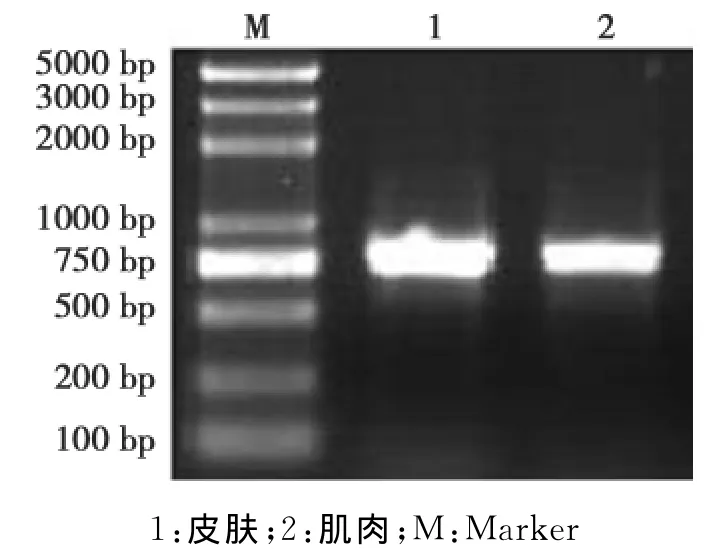
图1 绵羊FGF5基因片段的克隆Fig.1Cloning of FGF5gene in sheep
2.2 FGF5蛋白质理化性质
绵羊FGF5基因所编码的蛋白由270个氨基酸组成(图2),其氨基酸组成中亮氨酸的含量高达14.8%,远高于其它氨基酸的含量。其分子质量单位为29.584 7ku,分子式为C1315H2085N389O378S6,等电点理论值为10.59,含有4个半胱氨酸,假设形成2个二硫键,则其在水溶液中摩尔消光系数为25565M-1cm-1,0.1%浓度(1g/L)的 Abs为0.864,当二硫键全部打开时,对应值分别为25440M-1cm-1和0.860。成熟蛋白N端为蛋氨酸时,预测半衰期值哺乳动物网状细胞体外表达当中为30h,酵母和大肠杆菌体内表达分别大于20h和10h。在溶液当中不稳定指数为56.83,高于阈值40,为不稳定蛋白。

图2 FGF5基因预测的氨基酸序列Fig.2The predicted amino acid sequence of FGF5gene
2.3 FGF5蛋白的可溶性和亲(疏)水性
FGF5蛋白的平均亲水性系数为-0.55,为可溶性蛋白。采用DNAMAN软件分析,FGF5蛋白具有多个亲水性高的区域(图3)。

图3 FGF5蛋白的亲/疏水性Fig.3Hydrophilic and hydrophobic profile of the protein of FGF5
2.4 FGF5翻译后修饰和结构特征序列
通过翻译后修饰位点分析,理论推测该蛋白含有7个翻译后修饰位点,分别为:1个酰胺化位点(86~89位氨基酸)、1个 ASN-糖基化位点(112~115位氨基酸)、1个环磷酸腺苷和环磷酸鸟苷依赖性蛋白激酶磷酸化位点(47~50位氨基酸)、4个酪蛋白激酶Ⅱ磷酸化位点(74~77位氨基酸,121~124位氨基酸,186~189位氨基酸,234~237位氨基酸)、5个豆蔻酰化位点(42~47位氨基酸,70~75位氨基酸,91~96位氨基酸,113~118位氨基酸,137~142位氨基酸)、9个蛋白激酶C磷酸化位点(37~39位氨基酸,45~47位氨基酸,86~88位氨基酸,140~142位氨基酸,147~149位氨基酸,155~157位氨基酸,183~185位氨基酸,186~188位氨基酸,260~262位氨基酸)、1个酪氨酸激酶磷酸化位点(167~173位氨基酸)。
2.5 绵羊FGF5蛋白的跨膜分析
TMH-MM2.0服务器对绵羊FGF5蛋白跨膜区的预测结果如图4所示,显示存在2个跨膜区,表明绵羊FGF5编码蛋白是跨膜蛋白。

图4 TMHMM 2.0服务器对绵羊FGF5蛋白跨膜区的预测Fig.4Prediction of transmembrane domains(arrows indicated)of FGF5protein by using TMHMM 2.0server
2.6 FGF5蛋白的信号肽分析
经SignalP 3.0预测FGF5蛋白的信号肽序列,结果见图5。由图5可知,绵羊FGF5蛋白前20个氨基酸组成一段信号肽,信号肽裂解点位于第20位氨基酸Ala与第21位氨基酸Gln之间。

图5 绵羊FGF5蛋白的信号肽分析Fig.5Analysis of the signal peptide in sheep FGF5
2.7 绵羊FGF5蛋白的细胞定位分析
利用TargetP 1.1和PSORTⅡprediction分析绵羊FGF5蛋白的细胞定位,结果(表1)表明,绵羊FGF5蛋白主要集中在分泌途径上,线粒体中很少,说明该蛋白应属于分泌型蛋白。绵羊FGF5蛋白主要分布在细胞内部,包括内质网、高尔基体,只有少数分布在细胞外。

表1 绵羊FGF5蛋白亚细胞定位分析Tab.1Predicts the subcellular location of sheep FGF5
2.8 FGF5蛋白的二级结构
预测FGF5蛋白的二级结构由270个氨基酸组成,其中70个氨基酸(占25.93%)可能形成α螺旋(蓝色),23个氨基酸(8.52%)可能形成延伸链(红色),177个氨基酸(占65.56%)可能形成无规卷曲(紫色),没有形成β折叠片。由此可知该蛋白质主要以α螺旋及无规则卷曲为主。

图6 FGF5蛋白二级结构预测Fig.6secondary structure prediction of the FGF5protein
2.9 绵羊FGF5蛋白抗原表位
抗原表位是指能与抗体特异性结合的、位于抗原分子表面具有特殊结构的化学基团,也称为抗原决定簇。杰弗森-沃夫(Jameson-Wolf)抗原指数是GeneRunner软件联合运用 Hoop-Woods、Karplus、Emini、Chou-Fasman和 Robson-Garnier方法,结合表面概率、链柔韧性、亲水性及二级结构的信息,预测蛋白的抗原表位。绵羊FGF5蛋白的抗原表位预测结果见图7。
用DNAMAN软件对FGF5蛋白的氨基酸序列中潜在的抗原表位作进一步分析,显示有11个潜在抗原表位(表2)。

图7 FGF5蛋白的抗原表位分析Fig.7Analysis of the antigenic index of FGF5protein
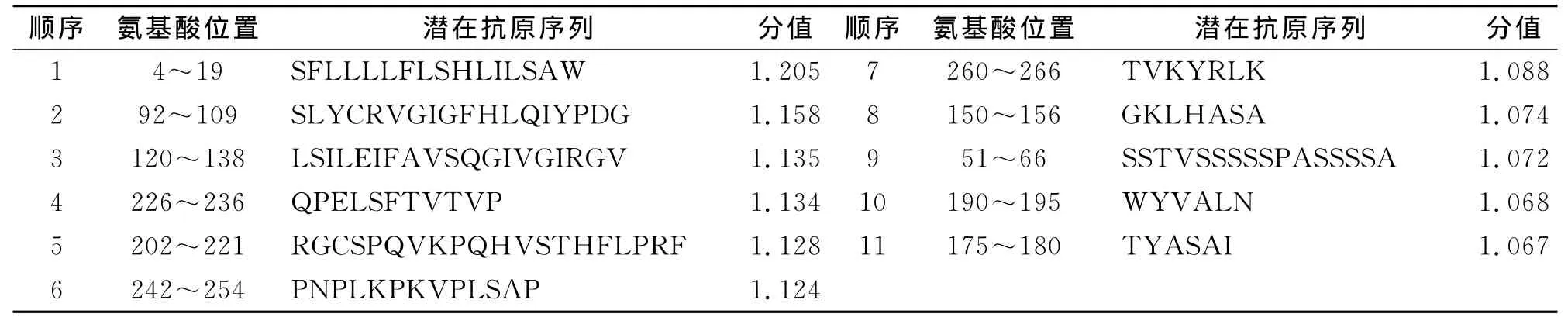
表2 FGF5氨基酸序列中11个潜在抗原表位Tab.2 11potential epitopes of amino acid sequence of FGF5
3 讨论
生物信息学作为近年来发展迅速的一门生物学科,已经广泛应用在预测蛋白质结构和功能以及确定蛋白质生物学特性等研究领域。本文通过运用蛋白在线分析工具及软件等生物信息学手段根据绵羊FGF5基因序列预测蛋白质可能的结构[8]和抗原表位[9]。研究发现绵羊FGF5基因CDS序列全长为813bp,编码蛋白由270个氨基酸组成,前面20位氨基酸序列是一段信号肽,这与高爱琴等[10]对山羊FGF5蛋白的分析相似,这也是FGF家族的共同特性,说明FGF5蛋白的N末端具有典型的信号序列分泌蛋白,其通过信号肽引导从蛋白合成部位移到细胞膜壁,最后分泌到胞外。以此推测FGF5基因是以旁分泌形式作用于靶细胞。
预测蛋白序列中跨膜螺旋的位置是当前生物信息学中重要的研究课题,因为通过对膜蛋白跨膜结构的预测能为该蛋白的功能研究提供重要线索。分析发现绵羊FGF5基因编码蛋白存在2个可能的跨膜区,这就为配体的特异性结合提供了受体的分子基础,其具体生物学功能有待进一步研究。通常,转角和无规则卷曲区域决定蛋白质的功能,转角及无规则卷曲等二级结构是比较松散的结构,易于发生扭曲、盘旋并展示在蛋白的表面,该区域常含B细胞的优势抗原表位[11]。绵羊FGF5蛋白二级结构分析显示以α螺旋和无规则卷曲结构为主,指示该蛋白属混合型蛋白[12],该区域抗原指数较高,该区段的抗原表位应该是优势抗原表位所在,通过DNAMAN软件分析我们得知该蛋白具有11个抗原表位。而抗原表位是蛋白质抗原性的基础,我们可以根据分析结果正确详细地绘制蛋白质抗原表位的图谱,为下一步研究抗体可变区的功能、提高抗体的亲和力、设计抗原和抗体提供理论基础。
目前对FGF5蛋白的结构研究还比较少,本实验在成功克隆FGF5基因CDS片段的基础上,对绵羊FGF5蛋白进行了理化性质、信号态、跨膜结构、细胞亚结构、二级结构以及抗原表位等进行了预测分析,这就为进一步阐明FGF5基因在细胞内的生物学调控机制提供了线索。
[1]Pennycuik P R,Raphael K A.The angora locus(go)in the mouse:hair morphology,duration of growth cycle and site of action[J].J Clin Invest,1999,104(7):855-864.
[2]Hebert J M,Rosenquist T,Gotz J.FGF5as a regulator of the hair growth cycle:evidence from targeted and spontaneous mutations[J].Cell,1994,78:1017-1025.
[3]Suzuki S,Kato T,Takimoto H.Localization of rat FGF5 protein in skin macrophage-like cells and FGF5Sprotein in hair follicle:possible involvement of two FGF5gene products in hair grotwh cycle regulation[J].J Invest Dermatol,1998,111(6):963-972.
[4]Ito C,Saitoh Y,Fujita Y.Decapeptide with fibroblast growth factor(FGF)-5partial sequence inhibits hair growth suppressing activity of FGF5[J].J Cell Physiol,2003,197(2):272-283.
[5]Suzuki S,Ota Y,Ozawa K.Dual-mode regulation of hair growth cycle by two FGF5gene products[J].J Invest Dermatol,2000,114(3):456-463.
[6]高爱琴,李宁,赵兴波,等.不同绵羊品种FGF5基因的多态性分析[J].畜牧兽医学报,2006,37(4):326-330.
[7]Pennycuik P R,Raphael K A.The angora locus(go)in the mouse:hair morphology,duration of growth cycle and site of action[J].Journal of Clinical Investigation,1999,104(7):855-864.
[8]郝柏林,张淑誉.生物信息学手册[M].上海:上海科学技术出版社,2002:250-256.
[9]Korber B,LaBute M,Yusim K.Immunoinformatics comes of age[J].Plos Computational Biology,2006,2(6):484-92.
[10]高爱琴,李 宁,李金泉,等.山羊FGF5基因cDNA分子克隆及序列分析[J].内蒙古大学学报,2006,37(2):180-184.
[11]Blythe M,Flower D.Benchmarking B cell epitope prediction:underperformance of existing methods[J].Protein Sci,2005,14:1246-1248.
[12]Skolnick J,Fetrow J S.From genes to protein structure and function:novel applications of computational approaches in the genomic era[J].Trends in Biotechnology,2000,18(1):34-39.
