杀菌剂对不同生长状态下生物黏泥的作用效果
2011-01-03赵朝成
刘 芳,夏 璐,常 新,杨 飞,赵朝成
(中国石油大学化学工程学院,山东青岛 266555)
杀菌剂对不同生长状态下生物黏泥的作用效果
刘 芳,夏 璐,常 新,杨 飞,赵朝成
(中国石油大学化学工程学院,山东青岛 266555)
在不同状态下培养生物黏泥,考察生物黏泥的生长特性和ClO2对不同类型生物黏泥的杀菌过程,确定ClO2有效杀菌时间和杀菌质量浓度。结果表明:当培养液中营养配比分别为 ρ(CODCr) ∶ρ(N) ∶ρ(P)=50 ∶10 ∶1、100 ∶10 ∶1和150 ∶10 ∶1时,生物黏泥的湿重和胞外聚合物的含量增加;当培养状态为 ρ(CODCr) ∶ρ(N) ∶ρ(P)=100 ∶10 ∶1时,生物黏泥的脱氢酶活性含量最大;当培养液中碳源质量浓度增加时,ClO2作用的有效时间随之延长,分别为1、1.5、1.75 h,ClO2有效杀菌质量浓度也随之增大,分别为0.5、1.5和2 mg/L。
生物黏泥;二氧化氯;杀菌效果;营养配比
石油炼化企业循环水系统中宜于生物黏泥的繁殖[1]。生物黏泥会影响循环水系统管道金属表面的电化学性质,引起结垢腐蚀加剧、传热效率降低、管道堵塞等问题[2-5]。目前普遍采用投加杀菌剂控制生物黏泥,即利用杀菌剂直接破坏微生物的生命过程和细胞核物质而杀死菌体,使系统中微生物的生长速度减慢。然而,杀菌剂投加量较难控制[6-7],国外也尚未建立针对杀菌剂的选择和使用方面的标准量化方法[8]。笔者在不同状态下培养生物黏泥,考察杀菌剂对于不同类型生物黏泥的杀菌过程,确定杀菌剂有效杀菌时间和杀菌质量浓度。
1 实验方法
1.1 生物黏泥的培养
实验装置为RCC-Ⅱ型旋转腐蚀挂片实验仪,采用标准不锈钢挂片(AISI 304,50 mm×25 mm×2 mm),在挂片上培养生物黏泥。采用定时排水浓缩法培养生物黏泥[9]。投入菌种后控制水温为(35±1)℃,每隔12 h换水排掉悬浮态细菌,以避免悬浮态细菌对附着态细菌生长的影响,再按要求加入培养液,以保证挂片表面的附着态细菌摄取充足养分,获得良好生长条件而大量繁殖。重复上述操作,直到生物黏泥长到稳定附着期。实验用菌种取自中石化青岛炼化公司循环冷却水系统凉水塔下面的集水池。
在模拟循环水系统中,营养液用葡萄糖作碳源,硫酸铵((NH4)2SO4)作氮源,以磷酸氢二钠(Na2HPO4)作磷源,用自来水配制培养液,以补充微量元素如镁、铁、锌等。在模拟循环水系统中,有机碳源质量浓度的变化对生物黏泥生长特性影响最为显著[10]。因此,本实验在培养不同营养水平下的生物黏泥时,仅改变碳源的质量浓度,根据GB50050-2007工业循环冷却水处理设计规范中对于间冷开式系统循环冷却水水质指标的要求,氨氮和磷的质量浓度分别定为10和1 mg/L。配制了3种不同营养水平的培养液,分别是贫营养培养液(ρ(CODCr)∶ρ(N) ∶ρ(P)=50 ∶10 ∶1),中营养培养液(ρ(CODCr) ∶ρ(N)∶ρ(P)=100 ∶10 ∶1)以及富营养培养液(ρ(CODCr) ∶ρ(N) ∶ρ(P)=150 ∶10 ∶1)。
1.2 生物黏泥湿重的测定
生物黏泥的生成量用黏泥湿重来表征,即当生物黏泥生长至稳定期后将挂片取出,用滤纸吸去挂片上过量水分,记录湿重值。为减少实验误差,在测定每一个时间点的黏泥湿重时均取用了6个挂片,以其平均值来表示此时间点的黏泥湿重。挂片上单位面积的黏泥生成量计算式为:

式中,m为某一时间点的黏泥生成量,mg/cm2;mi为某一时间点的挂片总湿重,mg;m0为挂片的初始湿重,mg;每个挂片的表面积为28 cm2。
1.3 胞外聚合物(EPS)含量的测定
采用甲醛-氢氧化钠法提取胞外聚合物[11]。为保证多糖和蛋白质不变性,在提取当天测定。多糖的测定方法为蒽酮-硫酸法[12],在测定多糖前用氯仿-正丁醇法去除蛋白质,多糖质量浓度以μg/cm2计。蛋白质的测定用 Bradford法(考马斯亮蓝法)[13],蛋白质质量浓度以 μg/cm2计。以多糖和蛋白质的含量之和表示EPS的含量。
1.4 脱氢酶活性的测定
采用三苯基四氮唑氯化物(TTC)比色法测定脱氢酶活性(DHA)[14],以单位质量基质每2 h内产生三苯基甲肼(TF)的质量计算(单位为10-6/h)。
1.5 生物黏泥杀菌效果的表征
脂类物质是所有细胞中生物膜的主要成分,在细胞死亡后将很快被分解,它在细胞中干质量的含量约为50 μmol/g,90% ~98%的细胞膜脂类以脂磷的形式存在,脂磷在细胞死亡后很快被分解,磷脂中的磷含量很容易用比色法测定,是一种可以用来表示活菌总数的较为理想的指标[15]。因此利用测定生物黏泥中脂磷含量的变化表征生物黏泥中活菌总数。脂磷的测定方法见文献[16]。
1.6 杀菌剂的选择
根据实际应用情况,选取应用较为广泛的氧化型杀菌剂稳定性二氧化氯(固态粉末,使用前配制母液)。在不同营养条件下培养的微生物黏泥,至稳定附着期后,将之与杀菌剂作用。
2 结果分析
2.1 不同培养状态下生物黏泥性能
当培养状态 ρ(CODCr)∶ρ(N)∶ρ(P)不同比值时,生长至稳定期的生物黏泥的主要性能见表1。当培养液中碳源质量浓度增大时,生物黏泥的湿重和EPS的含量随之增加。研究表明,系统中的微生物一旦完成初期附着过程,会在适宜的环境中迅速生长繁殖[17],且生成的黏泥量主要受附着态微生物生长状况的影响[18]。随着微生物繁殖数量的不断增多,系统中的营养水平成为微生物进一步繁殖的限制因素[19],水体中可利用的营养物质量浓度越高,附着态微生物的增殖量越大,进入平衡稳定期后生成的黏泥量越多。
在不同培养状态下,生物黏泥的脱氢酶活性存在较大差异。当 ρ(CODCr) ∶ρ(N) ∶ρ(P)=100 ∶10 ∶1时,生物黏泥的 DHA含量最大。实验中,在 ρ(CODCr) ∶ρ(N) ∶ρ(P)=50 ∶10 ∶1下挂片上附着的黏泥量最少,活性微生物数量最少,导致测得的DHA最低。在 ρ(CODCr) ∶ρ(N) ∶ρ(P)=100 ∶10 ∶1下,有机底物质量浓度的提高,使得活性微生物数量相对增加,DHA 明显升高。而在 ρ(CODCr) ∶ρ(N) ∶ρ(P)=150∶10∶1下,虽然生成的生物黏泥量继续增多,但是脱氢酶活性却有所降低,这主要是由于此时大量繁殖的微生物导致挂片上黏泥厚度不断增大(图1),营养物质及氧气的传质助力增大,导致黏泥内部出现厌氧环境,内层的好氧微生物由于在新陈代谢过程中缺乏必要的氢受体而逐渐死亡。研究[20]表明:当载体表面生长的生物膜厚度增加到一定程度后,生物膜靠近载体表面的部分即惰性生物层的微生物由于难以获得充足的养分和溶解氧,活性降低,基本不参与生化反应;包裹于惰性层外的活性生物层则具有较强的活性,有机底物的降解主要依靠该层中的微生物。由此可见,在培养状态为 ρ(CODCr) ∶ρ(N) ∶ρ(P)=150 ∶10 ∶1时,黏泥生长速率过快,厚度过大反而导致其DHA降低。
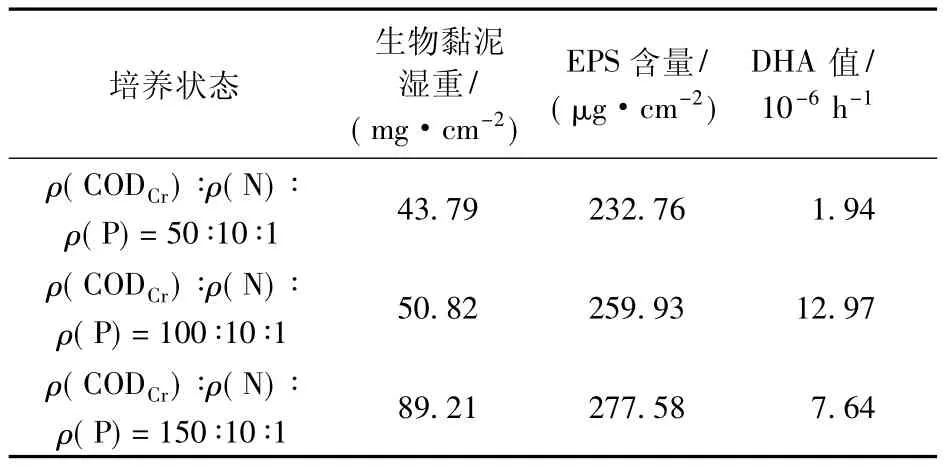
表1 不同培养状态下生物黏泥的主要性能Table 1 Properties of biofouling at different growth conditions
图1为培养状态不同时,生长至稳定期的生物黏泥的外观。不同状态培养至生长稳定期的生物黏泥在颜色、表观密度等方面都有所不同。可以看出:当培养液营养配比为 ρ(CODCr) ∶ρ(N) ∶ρ(P)=50 ∶10∶1时,形成的生物黏泥颜色较浅,结构疏松;ρ(CODCr) ∶ρ(N) ∶ρ(P)=150 ∶10 ∶1时,形成的生物黏泥颜色较深(呈黄色),结构致密而紧凑;ρ(CODCr)∶ρ(N) ∶ρ(P)=100 ∶10 ∶1时所形成的生物黏泥的颜色和致密程度都介于两者之间。

图1 生物黏泥挂片外观Fig.1 Appearance of biofouling on hanging pieces
2.2 ClO2有效杀菌时间的确定
不同生长状态下生物黏泥中脂磷含量在ClO2作用下随时间的变化曲线见图2。
图2表明,生物黏泥的生长状态不同,脂磷含量变化过程中达到最低点的时间不同,说明ClO2作用的有效时间不同。当培养状态分别为ρ(CODCr)∶ρ(N) ∶ρ(P)=50 ∶10 ∶1、100 ∶5 ∶1和150 ∶5 ∶1时,ClO2作用的有效时间分别为1、1.5和1.75 h,此时脂磷含量的降低率(即杀菌率)分别为78%、87%和84%。此外,当脂磷含量达到最低点后,随着时间的延续又呈上升的态势。原因主要可能有两方面∶一是由于ClO2有效作用质量浓度随时间的变化逐渐降低,减弱了杀菌效果,导致挂片上微生物数量增加,从而脂磷含量后续上升;二是培养液中有机物在微生物的表面形成一层保护层,妨碍杀菌剂与微生物的接触,或延迟杀菌剂的作用,以致于微生物逐渐对药物产生适应性[21],从而使微生物的数量增加,导致脂磷含量上升。
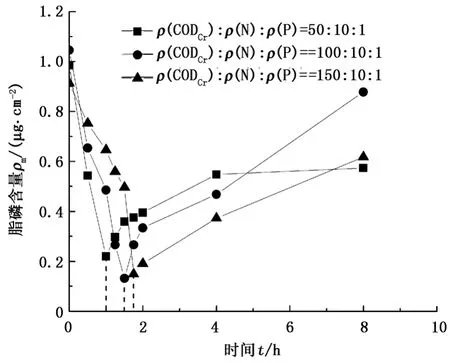
图2 不同培养状态下生物黏泥中脂磷含量随时间的变化曲线Fig.2 Content of biofouling fat phosphorus at different nutrient levels with different time
2.3 ClO2有效杀菌质量浓度的确定
向培养至稳定期的生物黏泥中分别投加不同质量浓度的ClO2,分别作用1、1.5和1.75 h后,测定不同质量浓度ClO2作用下的生物黏泥脂磷含量及杀菌率,结果见图3。
由图3看出,当ClO2质量浓度增大时,脂磷含量呈降低趋势,杀菌率逐步升高,这可从ClO2杀菌机制进行解释。ClO2外层键域存在一个未成对的活泼自由电子,属于活泼自由基,具有很强的氧化作用,能释放出新生态的氧及次氯酸分子,是一种强氧化剂。它对微生物的细胞壁有较好的吸附和透过性,可以有效地氧化细胞内含巯基的酶,快速控制微生物蛋白质的合成,使蛋白质中氨基酸氧化分解,破坏微生物的酶系统,起到抑制细菌生长和杀灭的作用[22]。当ClO2质量浓度越大时,其释放出的新生态氧及次氯酸分子越多,对微生物酶系统的破坏作用越强,即杀灭微生物的效果越好。
4.2 品种选择 临沭地瓜种植主要以鲜食品种为主,种植面积最大的品种为苏薯8号(俗称小花叶);其他品种有来福一号、红香蕉、小黄瓤、济薯26、烟薯25等。
在生物黏泥培养状态为 ρ(CODCr) ∶ρ(N) ∶ρ(P)=50∶10∶1条件下:当 ClO2质量浓度低于 0.5 mg/L时,随着ClO2质量浓度的增加,脂磷含量迅速降低,杀菌率迅速提高;当ClO2质量浓度高于0.5 mg/L时,脂磷含量随杀菌剂质量浓度的增大变化趋势变缓。当ClO2质量浓度达到0.5 mg/L时,脂磷含量降低至0.22 μg/cm2,杀菌率达76%;当杀菌剂质量浓度为2.0 mg/L时,脂磷含量达到最低,杀菌率达82%。杀菌率虽然提高了6%,但是ClO2质量浓度提高4倍,因此从杀菌效果和降低成本两方面综合考虑,当生物黏泥培养状态为 ρ(CODCr)∶ρ(N)∶ρ(P)=50∶10∶1时,ClO2的有效杀菌质量浓度为 0.5 mg/L。
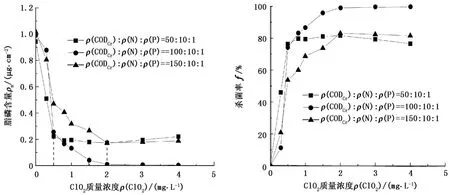
图3 不同培养状态下生物黏泥脂磷含量、杀菌率随ClO2质量浓度的变化曲线Fig.3 Content of biofouling fat phosphorus,content of sterilization rate at different nutrient levels with different ClO2concentration
单位面积挂片上生物黏泥脂磷含量随ClO2质量浓度的增加逐渐降低,杀菌率逐渐升高,当ClO2质量浓度高于1.5 mg/L时脂磷含量变化趋于平缓;当ClO2质量浓度达到1.5 mg/L时,杀菌率达96%,此时已达到良好的杀菌效果。因此,当生物黏泥培养状态为 ρ(CODCr) ∶ρ(N) ∶ρ(P)=100 ∶10 ∶1时,ClO2的有效杀菌质量浓度为1.5 mg/L。
单位面积挂片上生物黏泥脂磷含量随ClO2质量浓度的增加逐渐降低,杀菌率逐渐升高,当杀菌剂质量浓度高于2.0 mg/L时脂磷含量变化趋于平缓。当ClO2质量浓度达到2.0 mg/L时,杀菌率达83%,此时已达到较好的杀菌效果。因此,当生物黏泥培养状态为 ρ(CODCr) ∶ρ(N) ∶ρ(P)=150 ∶10 ∶1时,ClO2的有效杀菌质量浓度为2.0 mg/L。
2.4 ClO2对不同培养状态下生物黏泥的杀菌效果
3种生物黏泥培养状态下ClO2的有效杀菌时间和有效杀菌质量浓度如表2所示。
由表2看出,随着生物黏泥培养液中碳源质量浓度的升高,ClO2有效杀菌时间延长,有效杀菌质量浓度增大。文献[23-24]表明,微生物新陈代谢过程中产生的胞外聚合物(EPS)是聚合性生物黏泥的主要组成部分,而生物黏泥中的细菌由于包裹在大量的胞外聚合物及无机颗粒混合物质之内,且得益于累积黏泥的垂直空间结构[25],所以对外界杀菌剂有一定的抵抗能力。表1表明,随着生物黏泥培养液中碳源质量浓度的升高,生物黏泥中EPS的含量增加,所以生物黏泥中微生物抵御ClO2的能力提高。另外,研究[26-27]表明,模拟循环冷却水中碳源质量浓度的差异,导致了生物黏泥的理化性质发生变化。生物黏泥的湿重和脱氢酶活性也随培养液中碳源质量浓度的升高而增加(表1)。所以,在实际循环冷却水系统中,循环冷却水水质或补充水水质发生变化时,会导致其中生物黏泥的性质发生变化,从而导致杀菌剂的使用量和应用模式应随之进行调整,以便达到最优的杀菌效果。
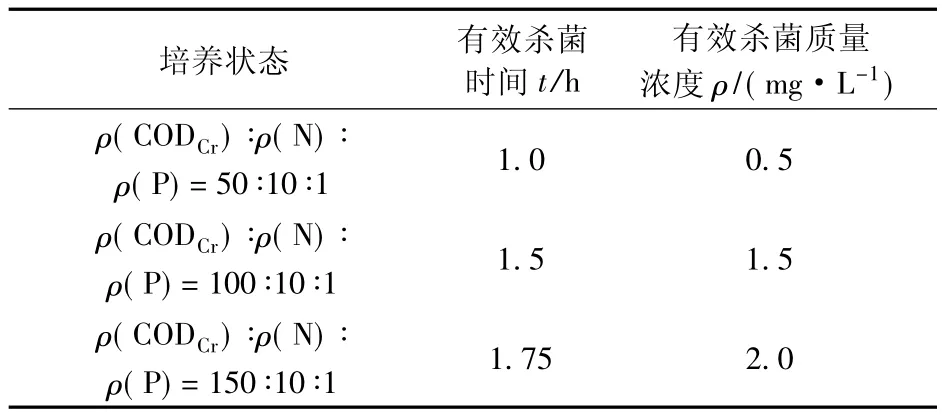
表2 ClO2对不同培养状态下生物黏泥的有效杀菌时间及有效杀菌质量浓度Table 2 Effect of ClO2concentration on biofouling effective sterilization time and bactericidal concentration at different nutrients levels
3 结论
(1) 当培养状态分别为 ρ(CODCr) ∶ρ(N) ∶ρ(P)=50∶10 ∶1、100 ∶10 ∶1和150 ∶10 ∶1时,生物黏泥的湿重和 EPS的含量随之增加,而在 ρ(CODCr)∶ρ(N)∶ρ(P)=100∶10∶1时,生物黏泥的 DHA 含量最大,为12.97×10-6h-1。
(2)当培养状态为 ρ(CODCr) ∶ρ(N) ∶ρ(P)=50 ∶10∶1时,形成的生物黏泥颜色较浅,结构疏松;培养状态为 ρ(CODCr) ∶ρ(N) ∶ρ(P)=150 ∶10 ∶1时,形成的生物黏泥颜色较深(呈黄色),结构致密而紧凑;培养状态为 ρ(CODCr) ∶ρ(N) ∶ρ(P)=100 ∶10 ∶1时,所形成的生物黏泥的颜色和致密程度都介于两者之间。
(3)生物黏泥的生长状态不同,脂磷含量变化过程中达到最低点的时间不同,说明ClO2作用的有效时间不同。当培养状态分别为ρ(CODCr)∶ρ(N)∶ρ(P)=50 ∶10 ∶1、100 ∶5 ∶1和150 ∶5 ∶1时,ClO2作用的有效时间分别为1、1.5和1.75 h,此时脂磷含量的降低率(即杀菌率)分别为78%、87%和84%。
(4)当培养状态分别为 ρ(CODCr) ∶ρ(N) ∶ρ(P)=50∶10 ∶1、100 ∶5 ∶1和150 ∶5 ∶1时,ClO2作用的有效质量浓度分别为0.5、1.5和2.0 mg/L,此时脂磷含量的降低率(即杀菌率)分别为76%、96%和83%。
[1]MEESTERS K P H,VAN GROENESTIJN J W,GERRITSE J.Biofouling reduction in recirculating cooling systems through biofiltration of process water[J].Water Research,2003,37(3):525-532.
[2]ROE F L,LEWANDOWSKI Z,FUNK T.Simulating microbiologically influenced corrosion by depositing extracellular biopolymer on mild steel surfaces[J].Corrosion,1996,52(10):744-52.
[3]CARPENTIER B,CERF O.Biofilms and their consequences,with particular reference to hygiene in the food industry[J].Journal of Applied Bacteriology,1993,75:499-511.
[4]MORTENSEN K P,CONLEY S N.Film fill fouling in counterflow cooling towers:mechanisms and design [J].Cooling Technology Institute Journal,1994,15:10-25.
[5]LEE W N,CHANG I S,HWANG B K,et al.Changes in biofilm architecture with addition of membrane fouling reducer in a membrane bioreactor[J].Process Biochemistry,2007,42(4):655-661.
[6]GRANT D,BOTT T.Biocide dosing strategies for biofilm control[J].Heat Transfer Engineering,2005,26(1):44-50.
[7]LAOPAIBOON L,HALL S J,SMITH R N.The effect of an aldehyde biocide on the performance and characteristics of laboratory-scale rotating biological contactors[J].Journal of Biotechnology,2003,102(1):73-82.
[8]SIMÕES M,SIMÕES L C,VIEIRA M J.Species association increases biofilm resistance to chemical and mechanical treatments[J].Water Research,2009,43(1):229-237.
[9]马汉泽,谢可蓉,吴承立,等.利用微生物快速挂膜技术治理糖果废水的研究[J].环境工程,2000,18(1):10-11.MA Han-ze,XIE Ke-rong,WU Cheng-li,et al.Study of disposing of candy wastewater with high speed raising microbiofilmtechonology[J].Environmental Engineering,2000,18(1):10-11.
[10]张桂芝,刘芳,赵朝成,等.循环冷却水中营养物水平与生物黏泥生长特性的相关性研究[J].化工进展,2009,28(11):2052-2057.
ZHANG Gui-zhi,LIU Fang,ZHAO Chao-cheng,et al.Relationship between nutrition substance concentration and biofouling growth characteristics in recirculating cooling water system[J].Chemical Industry and Engineering Progress,2009,28(11):2052-2057.
[11]罗曦,雷中方,张振亚,等.好氧/厌氧污泥胞外聚合物(EPS)的提取方法研究[J].环境科学学报,2005,25(12):1624-1629.
LUO Xi,LEI Zhong-fang,ZHANG Zhen-ya,et al.Study on the extraction of extracellular polymeric substances(EPS)from aerobic/anaerobic sludges[J].Acta Scientiae Circumstantia,2005,25(12):1624-1629.
[12]易剑平,毕雅静,宋秀荣,等.蒽酮-硫酸法测定枸杞多糖质量分数的研究[J].北京工业大学学报,2005,31(6):641-646.
YI Jian-ping,BI Ya-jing,SONG Xiu-rong,et al.Investigation on anthrone-H2SO4methodology of determination of polysaccharides in lycium barbarum[J].Journal of Beijing University of Technology,2005,31(6):641-646.
[13]李宁.几种蛋白质测定方法的比较[J].山西农业大学学报:自然科学版,2006,26(2):132-134.
LI Ning.The comparison on various methods for determing different proteins[J].Journal of Shanxi Agricultural University(Natural Science Edition),2006,26(2):132-134.
[14]周春生,尹军.TTC-脱氢酶活性检测方法的研究[J].环境科学学报,1996,16(4):400-405.
ZHOU Chun-sheng,YIN Jun.A method for measurement of ttc-dehydrogenase activity[J].Acta Scientiae Circumstantiae,1996,16(4):400-405.
[15]于鑫,张晓键,王占生.饮用水生物处理中生物量的脂磷法测定[J].给水排水,2002,28(5):1-5.
YU Xin,ZHANG Xiao-jian,WANG Zhan-sheng.Biomass examination by lipid-P method for drinking water bio-treatment[J].Water and Wastewater Engineering,2002,28(5):1-5.
[16]刘云根,王海峰.物化法测量管道生物膜生物量的实验研究[J].污染防治技术,2009,22(3):23-26.
LIU Yun-gen,WANG Hai-feng.Experimental study on the bio-film biomass measurement by physic-chemical method[J].Pollution Control Technology,2009,22(3):23-26.
[17]CHARACKLIS W G,MARSHALL K C.Biofilms[M].New York:John Wiley and Sons,1990:3-16.
[18]BOTT T R,MILLER P C.Mechanisms of biofilm formation on aluminium tubes[J].Journal of Chemical Technology& Biotechnology,1983,33B:177-184.
[19]FLEMMING H C,GRIEBE T,SCHAULE G.Antifouling strategies in technical systems-a short review [J].Water Science and Technology,1996,34:517-524.
[20]HUANG J C,LIU Y C.Relationship between oxygen flux and biofilm performance[J].Water Science and Technology,1993,7:153-158.
[21]赵旭娜,张高勇,丁进亚,等.季铵盐类阳离子表面活性剂的生物效应[J].中国消毒学杂志,2006,23(1):68-70.
ZHAO Xu-na,ZHANG Gao-yong,DING Jin-ya,et al.The effects of quaternary ammonium cationic surfactants[J].Chinese Journal of Disinfection,2006,23(1):68-70.
[22]邹华生,刘国翊.二氧化氯在炼油循环水中的杀菌除泥作用[J].华南理工大学学报:自然科学版,2002,30(12):97-100.
ZOU Hua-sheng,LIU Guo-yu.Sterilization and filth prevention of chloride dioxide used in circulating water treatment in oil refinery[J].Journal of South China U-niversity of Technology(Natural Science Edition),2002,30(12):97-100.
[23]LI X Y,YANG S F.Influence of loosely bound extracellular polymeric substances(EPS)on the flocculation,sedimentation and dewaterability ofactivated sludge[J].Water Research,2007,41(5):1022-1030.
[24]GUIBAUD G,COMTE S,BORDAS F,et al.Comparison of the complexation potential of extracellular polymeric substances(EPS),extracted from activated sludges and produced by pure bacteria strains,for cadmium,lead and nickel[J].Chemosphere,2005,59(5):629-638.
[25]CLOETE T E.Resistance mechanisms of bacteria to antimicrobial compounds[J].International Biodeterioration and Biodegradation,2003,51:277-282.
[26]刘芳,侯衍美,赵朝成,等.水质对生物黏泥胞外聚合物成分的影响[J].中国石油大学学报:自然科学版,2009,33(4):165-170.
LIU Fang,HOU Yan-mei,ZHAO Chao-cheng,et al.Effects of cooling water polymeric quality on compositions of extracellular substances in biofouling[J].Journal of China University of Petroleum(Edition of Natural Science),2009,33(4):165-170.
[27]刘芳,侯衍美,赵朝成,等.循环冷却水系统中生物黏泥形成的水质影响因素[J].中国石油大学学报:自然科学版,2009,33(2):149-154.
LIU Fang,HOU Yan-mei,ZHAO Chao-cheng,et al.Influences of water quality on biofouling forming in circulating cooling water system[J].Journal of China University of Petroleum (Edition of Natural Science),2009,33(2):149-154.
Effect of biocide on biofouling formation at different growth conditions
LIU Fang,XIA Lu,CHANG Xin,YANG Fei,ZHAO Chao-cheng
(College of Chemical Engineering in China University of Petroleum,Qingdao 266555,China)
The growth characteristics of biofouling at different cultivating conditions were investigated.Then,the antibacterial effect of chlorine dioxide on biofouling at different cultivating conditions was investigated,and the effective antibacterial time and concentration of chlorine dioxide were obtained.The results show that the wet weight and extra-cellular polymeric substances of biofouling increase when nutritive proportions are ρ(CODCr) ∶ρ(N) ∶ρ(P)=50 ∶10 ∶1,100 ∶10 ∶1 and 150 ∶10 ∶1,respectively.However,dehydrogenase activity(DHA)of biofouling is the biggest at ρ(CODCr) ∶ρ(N) ∶ρ(P)=100 ∶10 ∶1.The effective antibacterial time chlorine dioxide acting increases with the mass concentration of carbon increasing,which is 1,1.5 and 1.75 h,respectively.In addition,effective antibacterial concentration of chlorine dioxide also increases,which is 0.5,1.5 and 2 mg/L,respectively.
biofouling;chlorine dioxide;antibacterial effect;nutritive proportion
TQ 085
A >
10.3969/j.issn.1673-5005.2011.05.030
1673-5005(2011)05-0157-06
2011-04-20
国家自然科学基金项目(20707040,21077133);污染控制与资源化研究国家重点实验室开放课题(PCRRF08002);中央高校基本科研业务费专项基金
刘芳(1976-),女(汉族),山东济宁人,副教授,博士,研究方向为水污染控制与资源化利用。
(编辑 刘为清)
