运动疲劳大鼠心肌细胞L-型钙通道生物物理特性的研究
2011-01-02费明旋张守伟
姜 山,韩 勇,费明旋,张守伟
运动疲劳大鼠心肌细胞L-型钙通道生物物理特性的研究
姜 山,韩 勇,费明旋,张守伟
目的:研究运动疲劳对大鼠心肌细胞L-型钙通道电流及生物物理学特性的影响,证明L-型钙通道直接参与到运动疲劳导致的细胞内钙浓度变化中。方法:48只大鼠雌雄不拘,随机分成对照组和运动疲劳组。采用连续15天游泳耐力训练方法建立运动疲劳大鼠模型;应用膜片钳技术检测运动疲劳对大鼠心肌细胞L-型钙通道电流的影响。结果:1)运动疲劳大鼠全细胞L-型钙电流峰值(IpeakCaL)显著增加:全细胞IpeakCaL电流从-470± 11.73 pA变化到-819.90±10.78 pA,n=8,P<0.05,运动性疲劳组较对照组增幅74.60%;2)膜片钳技术检测L-型钙电流的激活和失活通道动力学特性:运动疲劳模型组大鼠心肌细胞的L-型钙电流的失活曲线右移,而激活曲线与对照组相比没有变化。结论:运动疲劳引起大鼠L-型钙通道特性改变,使得钙电流增强,导致心肌细胞内钙平衡调节紊乱。
L-型钙通道;激活失活曲线;运动性疲劳;心室肌细胞;鼠;动物实验
运动性疲劳指机体在生理过程中不能继续在特定水平上进行或整个机体不能维持预定的运动强度[2]。运动性疲劳产生机制方面的研究,是当前体育科学中面对的重要课题,虽对此进行了广泛而深入的研究,但导致运动疲劳的生理机制是一个极其复杂的问题,对于运动疲劳产生的原因以及其中的相关机制的研究仍存在许多争议,并且存在许多假说[4],如中枢神经疲劳学说、能量衰竭学说、神经-肌肉疲劳学说、代谢产物堆积学说、氧自由基-脂质过氧化学说、钙离子代谢紊乱学说、体温调节失衡学说等等,其中,离子代谢紊乱机制在运动性疲劳中的研究越来越受到人们的重视,而钙离子平衡紊乱的研究最为重要。此外,运动性疲劳对心脏功能的影响虽有所研究,但其影响作用及机制仍然不清楚,尤其是在分子、细胞水平上对心肌细胞内钙离子稳态变化的研究没有报道。
因此,本研究拟通过膜片钳技术探索运动疲劳对心肌细胞L-型钙通道电流及生物物理学特性激活失活曲线的影响,探索运动疲劳与钙通道的关系,证明L-型钙通道直接参与到运动疲劳导致的细胞内钙浓度变化中,导致心肌细胞发生钙超载,造成心肌损伤。
1 材料与方法
1.1 实验动物
W istar大鼠48只(购自吉林大学基础医学院实验动物中心),体重220 g±25 g,雌雄不拘,随机分为运动疲劳组和对照组,每组24只,自由摄食,饲养环境温度19℃± 4℃,相对湿度(50±10)%。
1.2 仪器设备与试剂
仪器设备:L-型钙通道离子电流测定使用膜片钳系统(德国进口HEKA公司EPC-10)。
试剂:胶原酶Ⅱ型,美国Sigma公司;牛血清白蛋白,博越生物公司;尼莫地平,美国Sigma公司。标准溶液:Kraft Bruhe液;L-型钙通道电极内液;L-型钙通道细胞外液。
1.3 实验方法
1.3.1 运动疲劳模型的制备
对大鼠进行15天游泳力竭训练,实验水深40 cm±5 cm,水温30℃±2℃,前10天每天1次,每次3 h训练,后5天每天2次,每次3 h训练。力竭阶段标准为大鼠沉入水底并且3 s内无力返回水面,此时及时捞起,休息2 min后继续游泳,并完成规定的训练时间。运动疲劳模型制备如下:每12只大鼠为1组,编号,第1天开始将编号为1的大鼠放入水池中进行游泳训练,第2天放入1号及2号大鼠,第3天放入1、2、3号大鼠,依次类推,到第12天加入编号为12的大鼠,共同游泳训练至规定天数,该组大鼠疲劳模型建立完毕后,进行下一组疲劳模型建立实验。
1.3.2 取样
相应编号的大鼠在其第15天的游泳训练近结束时,当大鼠出现沉入水底无力返回水面即力竭状态下,立即取出该运动疲劳大鼠模型,不予任何休息恢复,即刻颈部脱臼处死,迅速开胸取心,采用Langendorff离体灌流分离心肌细胞。
1.3.3 大鼠心室肌细胞分离
采用Langendorff法离体灌流心脏[3],大鼠颈部脱臼处死,迅速开胸取出心脏,置于4℃含Ca2+台氏液清洗修剪,经主动脉将心脏悬挂于Langendorff离体灌流装置上,由主动脉进行逆向灌流,灌流液保持37℃、通入95%O2+5% CO2混合气体。首先用含钙台式液灌流心脏复跳,泵出心腔内残留血液,更换为无钙台氏液灌流至心脏停止跳动,用含0.16 mg/m lⅡ型胶原酶和0.16 mg/ml牛血清白蛋白的无钙台氏液60 m l反复灌流心脏至心肌消化完全。消化结束后,剪下心室,在KB液(g/L:KOH 3.928,L-谷氨酸7.357,KCl 2.982,牛磺酸2.503,KH2PO42.722, MgCl2·6H2O 0.601,葡萄糖1.981,HEPES 2.383, EGTA 0.19,KOH调p H值至7.4)中剪块、吹打,镜检含80%以上单个杆状细胞后,置于KB液中4℃保存。
1.3.4 全细胞Ca2+通道电流的记录
方法[3]将分离得到的心肌细胞滴加到细胞浴槽中,静置至细胞贴壁,用细胞外液(g/L:Tris-Cl 21.43, CsCl 0.909,MgCl2·6H2O 0.203,HEPES 2.383,葡萄糖1.981,CaCl20.221,Tris-OH调p H值至7.4)灌流。拉制玻璃电极(入水电阻2~5 MΩ),充灌电极内液(g/L:CsOH 16.49,aspartate 14.64,CsCl 3.367,MgCl2·6H2O 0.2, Mg-ATP 2.535,EGTA 3.8,HEPES 2.383,CsOH调节p H值至7.2)。玻璃电极与细胞膜接触后,给予一个微弱负压吸引形成1~5 GΩ的高电阻封接,再一次给予短暂迅速负压,吸破细胞膜,形成全细胞记录模式(Whole cell mode)。给予钳制电压-50 mV,命令电压从-50 mV阶跃到+50 mV,步进电压10 mV,刺激脉冲持续300 ms,诱发L-型Ca2+通道电流,通过膜片钳放大器模/数(A/D)转换通道转成数字信号,Pulse软件采集,Pulsefit分析。
1.4 数据统计
实验数据使用SPSS统计软件处理,结果以均数±标准差表示,统计学分析采用样本均数t检验进行各组间数值比较。
2 结果与分析
2.1 运动性疲劳大鼠心肌细胞L型-钙通道的ICaL电流的变化
采用膜片钳技术测定大鼠心肌细胞L型-钙通道电流,形成全细胞记录模式后,电压钳模式下,钳制电压-50 mV,使用系列阶跃电压(-50 mV~50 mV)诱导出L-型钙电流,-30 mV开始出现内向电流,在10 mV达到最大峰电流,该电流可被尼莫地平(钙通道阻断剂,5μmol/L)抑制。
运动疲劳大鼠组ICaL峰电流显著增强。全细胞ICaL峰电流比对照组增加74.60%(从-470±11.73 pA/p F变化到-819.90±10.78 pA/p F,n=8,P<0.05)。
2.2 运动性疲劳对大鼠心肌细胞L型-钙通道稳态激活动力学特征的影响
采用膜片钳技术测定大鼠心肌细胞L型-钙通道动力学特性,形成全细胞记录模式后,电压钳模式下,钳制电压-50 mV,给以10 mV步阶去极化至50 mV系列去极化脉冲,根据得到电流电压关系曲线,由Boltzman方程拟合得到稳态激活曲线。运动疲劳组大鼠L型-钙与对照组相比激活曲线无显著变化。

图1 运动疲劳对大鼠心肌细胞ICaL的影响图Fig 1. Effect of exercise-induced fatigue on whole cell L-type calcium current in rats.

图2 运动性疲劳大鼠心肌细胞钙通道稳态激活动力学特征曲线图Fig 2. Dynamic properties of activation curve of the exercise-induced fatigue rats.
2.3 运动性疲劳对大鼠心肌细胞L型-钙通道稳态失活动力学特征的影响
采用膜片钳技术测定大鼠心肌细胞L型-钙通道动力学特性,形成全细胞记录模式后,电压钳模式下,采用双脉冲刺激法,钳制电压-50 mV,从-60 mV以10 mV步阶去极化至30 mV,持续时间1 500 ms,在每次条件脉冲后紧跟一个持续250 ms的固定的去极化至0 mV脉冲,然后回到钳制电压,将记录到的ICaL经Boltzman方程拟合得到稳态失活曲线。运动疲劳组大鼠L型-钙与对照组相比失活曲线发生右移,表明运动疲劳模型组的大鼠L-型钙通道失活过程更难,运动疲劳抑制了钙通道的失活过程,造成钙通道关闭延迟,单位时间内经由钙通道进入细胞内的Ca2+数量增加,致使细胞内钙浓度调节紊乱。
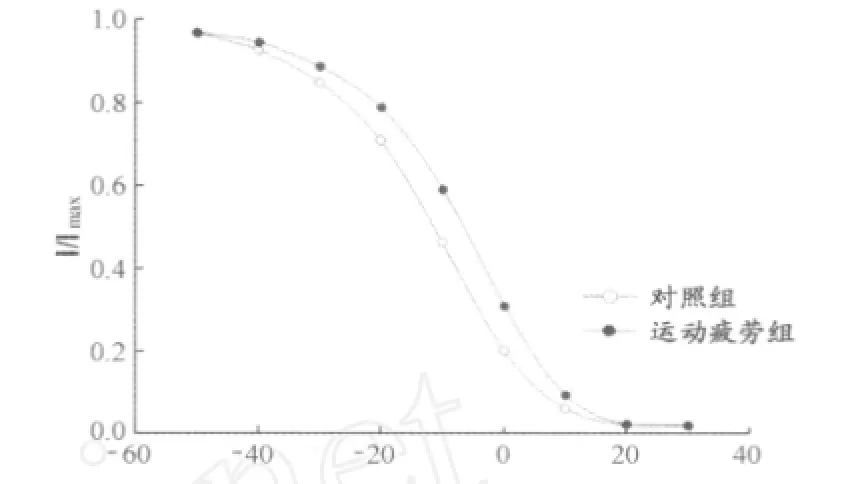
图3 运动性疲劳大鼠心肌细胞钙通道动力学特征曲线图Fig 3. Dynam ic properties of inactivation curve of the exercise-induced fatigue rats
3 讨论
本研究首次发现了经过2周力竭状态的运动可使大鼠心肌细胞L-型钙通道特性发生改变,钙电流产生增强,钙通道的失活曲线发生明显右移,单位时间内进入心肌细胞内Ca2+数量增加,为解释运动性疲劳引起细胞内钙超载机制提供了有力证据。由于大鼠心肌细胞L-型钙通道电流增强作用以及钙通道生物物理学特性的改变,导致了细胞内发生钙超载,从而使心肌细胞产生结构和功能上的改变。
运动疲劳是运动训练过程的一个重要的问题,但对于运动疲劳产生的原因以及其中的相关机制的研究仍存在许多争议。运动疲劳对心血管系统的影响方面,现认为在运动过程中,心脏提供的血流量已满足不了工作肌肉对氧和营养物质及运走过多代谢产物的需求[6],其中由于运动性疲劳而导致的心肌细胞钙离子平衡的紊乱是对心肌损伤中甚为重要的环节。
Ca2+在维持身体结构和细胞功能方面发挥着重要作用,几乎体内各种细胞功能均与钙离子调节有关。Ca2+活泼的特性使其容易结合细胞内的各种缓冲位点,这些位点通过结合肌钙蛋白、收钙素、钙调蛋白和ATP等物质[11],进而发挥重要的生理功能,所以,细胞内钙离子是调节信号转导和其他细胞生理过程重要的第二信使。而在心肌细胞中,游离钙作为偶联因子诱发心肌细胞兴奋与收缩偶联,进而产生心肌收缩,同时,胞内钙对增强心肌收缩力及收缩速率方面有着重要的作用,因此,不管心肌外部的调节机制多复杂,最后都可以归结为细胞内钙离子浓度的调节[5]。
近年来,运动性疲劳中Ca2+在心脏的代谢已受到重视。以往的研究认为,Ca2+在运动性疲劳中起着至关重要的作用,尤其是其对线粒体膜结构以及功能的影响方面。运动性状态下心肌线粒体的结构和功能发生了明显变化,这些变化可能是引起疲劳状态下心肌损伤的主要原因[4,1],而线粒体的这种损伤也与细胞内钙离子有直接关系。细胞以及线粒体内的钙聚集严重影响细胞正常功能,导致细胞产生程序性死亡(凋亡),细胞内钙超载常作为细胞结构损伤的特征,线粒体内的钙代谢紊乱超载将造成细胞不可逆损害[9,11]。所以,Ca2+在运动性疲劳中起着重要的作用,有可能是其产生的一个中枢机制,即胞浆内钙超载、线粒体里钙聚集是造成力竭损伤的主因。而关于心肌细胞胞浆内钙超载机制研究甚少。心肌细胞胞浆内钙浓度的增加主要是通过肌质网内的钙离子释放或由细胞膜上的钙离子通道进入的两种方式实现的[10]。因此,在本研究中,我们通过膜片钳技术检测了正常大鼠和运动疲劳大鼠心肌细胞膜L-型钙通道电流的变化,以及运动疲劳后大鼠心肌细胞膜L-型钙通道生物学特性的改变,通过对于运动疲劳后钙通道的研究,揭示导致细胞内Ca2+增多、造成细胞内钙超载、最终使心肌细胞内Ca2+平衡调节紊乱的原因。我们的研究发现:1)运动性疲劳大鼠心肌细胞L-型钙通道ICaL峰电流的显著增强:全细胞ICaL峰电流从-470±11.73 pA/p F变化到-819.90±10.78 pA/p F,比对照组增加了74.60%,表明与正常细胞相比,运动疲劳后的心肌细胞单位时间内通过细胞膜L-型钙通道进入细胞内的Ca2+数量显著增加,造成细胞内钙超载;2)通过对运动疲劳大鼠的L-型钙通道的动力学研究发现,该组大鼠L型-钙通道失活曲线发生了右移,激活曲线无变化,表明运动疲劳模型组的大鼠L-型钙通道失活过程更难,运动疲劳抑制了钙通道的失活过程,造成钙通道关闭延迟,单位时间内经由通道进入细胞的钙离子数量增加,这种钙通道生物物理学特性的改变导致细胞内钙调节的紊乱。
本研究首次直接观察到了由于力竭运动而导致大鼠心肌细胞膜L-型钙通道电流增强作用,证实了运动性疲劳产生的细胞内钙超载部分直接因素是通过改变细胞膜L-型钙通道生物物理学特性而实现的,揭示了运动疲劳状态下细胞内钙离子浓度升高的分子、细胞生理学机制,对于解释力竭造成的心肌细胞损伤有重要意义,为在体育运动训练中,选择合适的训练强度提高运动成绩,提供理论依据。
4 结论
作者研究了力竭运动对大鼠心肌细胞L-型钙通道电流的变化及钙通道生物物理学特性的改变,发现2周的力竭运动可导致心肌L-型钙通道电流振幅增强,激活曲线无变化,失活曲线显著右移,证明了L-型钙通道电流及生物物理学特性改变是运动疲劳导致细胞内钙超载的直接原因之一的分子、细胞生理学机制,由此产生细胞内钙超载、钙平衡调节紊乱。
参考文献:
[1]伏育平.运动性疲劳状态下大鼠心肌线粒体内钙、MDA及磷脂酶A-2的变化[J].广州体育学院学报,2005,25(5):27-30.
[2]杨锡让.实用运动生理学[M].北京:北京体育大学出版社,1994.
[3]曾庆华.内皮素对心血管的作用[M].长春:东北师范大学出版社, 1998.
[4]ASMUSSEN E.Muscle fatigue[J].Med Sci Sports,1979,11(4): 313-321.
[5]JIY H,SUN H Y.Cardiac cxcitation-contraction coupling mediated By Ca2+[J].Shi Yan Sheng Wu Xue Bao,2004.37(1):78-83.
[6]KAYSER B.Exercise starts and ends in the brain[J].Eur J Appl Physiol,2003,90(3-4):411-419.
[7]POOL-W ILSON P A.Enzyme loss and calcium exchange in is chemic or hypoxicmyocardium[J].Calcium Antagonists Cardiovascular Disease,1984,12(6):97-104.
[8]SITTERTZ-BHATKAR.Localizing distribution of beta–glucoronidase in individual cells[J].Biotechniques,1989,7(9):922-924.
[9]SOMLYO A V.Calcium releasesand ionic changes in the saroplasmic reticulum of tetanizedmuscle:an electron–probe study[J].Cell Biology,1981,90(2):577-594.
[10]SW IETACH P,SPITZER KW,VAUGHAN-JONESR D.Modeling calcium waves in cardiac myocytes:importance of calcium diffusion[J].Front Biosci,2010,15(5):661-680.
[11]V IHKO V,SALM INEN A.Exhaustive exerciese,endurance training,and acid hydrolase activity in skeletalmuscle[J].Appl Physiol, 1979,47(1):43-50.
Study of Biophysical Properties of L-type Calcium Channel in Rat M yocardial Cells with Exercise-induced Fatigue
JIANG Shan,HAN Yong,FEIM ing-xuan,ZHANG Shou-wei
Objective:To study the effects of exercise-induced fatigue on m yocardial cells L-type calcium currents and biophysical p roperties in rats;to p rove that L-type Ca2+channel participates directly in the change of[Ca2+]i.due to exercise-induced fatigue.Methods:48 rats,male o r female,were divided into control group and exercise-induced fatigue group random ly.15 days endurance sw imming training w as adopted to establish exercise-induced fatigue models; patch clamp technique was app lied to exam ine the effects of exercise-induced fatigue on m yocardial L-type calcium currents in rats.Results:1)The w hole cell L-type Ca2+channel peak currents obviously increased in exercise-induced fatigue rats:the w hole cell L-type Ca2+channel peak currents increased from-470±11.73pA to-819.90±10.78pA(n=8,P< 0.05),the exercise-induced fatigue group increased 74.60%compared w ith the control group. 2)Using patch clamp technique to examine the activation of L-type Ca2+channel currents and dynam ic p roperties of inactivation channel:Inactivation curve shifted to the right in the exercise-induced fatigue group compared w ith the control group,activation curve in the exercise-induced fatigue group did not alter compared w ith the control group.Conclusion:Exercise-induced fatigue changes biophysical p roperty of L-type Ca2+channel,and enhances L-type Ca2+channel currents and causes disorders in calcium balance adjustment.
L-type calcium channel;activation and inactivation curve;exercise-induced fatigue;m yocardial cell;rat
G804.2
A
1000-677X(2011)11-0048-04
2011-03-17;
2011-10-10
姜山(1977-),男,吉林长春人,讲师,博士,研究方向为运动训练学,E-mail:jiangs667@nenu.edu.cn;韩勇(1974-),男,黑龙江哈尔滨人,讲师,博士,研究方向为心脏生理学,E-mail:hany837@nenu.edu.cn;费明旋(1986-),男,黑龙江绥化人,硕士,研究方向为体育教学训练原理与方法,E-mail:feim xbest@126.com;张守伟(1974-),男,吉林临江人,副教授,博士,研究方向为体育教学训练原理与方法,E-mail:zhangsw178@nenu.edu. cn。
东北师范大学,吉林长春130024 No rtheast Normal University,Changchun 130024, China.
