不同质量浓度NaNO3对3种微藻生长及总脂肪酸含量和组成的影响
2010-12-31史全良江香梅
杨 凯,王 涌,史全良,①,江香梅
(1.苏州大学医学部基础医学与生物科学学院,江苏 苏州 215123;2.江西省林业科学院植物生物技术重点实验室,江西 南昌 330032)
生物柴油(biodiesel)是指以植物和动物油脂等可再生生物资源生产的可用于压燃式发动机的新型清洁替代燃油[1],其主要化学成分是软脂酸、硬脂酸、油酸、亚油酸等长链饱和或不饱和脂肪酸与甲醇或乙醇等醇类所形成的酯类物质。自然界中可用于提取及制备生物柴油的生物资源有很多种,其中微藻因具有生长速度快、生物量较大和含油量高等特点而倍受瞩目,将微藻作为制备生物柴油的原料来源具有广阔的应用前景。
不同种类微藻的脂肪酸成分与含量变化很大,而且与环境条件(温度、光照、营养盐浓度和植物激素等[2])密切相关,其中培养基中的氮浓度对微藻脂肪酸组成的影响比较显著。不同种类微藻所含的多不饱和脂肪酸(PUFA s)与氮营养的关系有一定差异,甚至相反。Yongm anitchai等[3]发现,在高氮浓度下,小球藻(Chlorellasp.)、栅藻(Scenedesmussp.)和三角褐指藻(PhaeodactylumtricornutumBohlin)的 PUFA s含量增加。Chen等认为,培养基中的氮源组成主要影响微藻细胞内饱和及不饱和脂肪酸的比例,当培养基中 C/N比升高时,Chlorellasorokiniana细胞内 PUFA s的含量升高[4]。当处于缺氮条件时,微藻细胞能够选择性地优先利用1种或多种含氮大分子,使细胞内的含氮物质(如蛋白质等)的含量下降,而使细胞内的碳水化合物(如多糖及脂肪酸等)的含量升高[5-6]。一般来说,微藻可以利用的氮源种类较多,无机氮源有铵盐、硝酸盐和尿素等,有机氮源有酵母膏、胰蛋白胨和氨基酸等[7]。
鉴于不同微藻藻种对氮源有不同的适应性,作者以微藻 P9(Klebsormidiumsp.)、TH6(Oedocladiumsp.)和 CF5(Stigonemasp.)为研究对象,探讨了在培养液中添加不同浓度硝态氮(NaNO3)对其生长和总脂肪酸含量及脂肪酸组成的影响,以便确定培养过程中不同微藻适宜的硝态氮浓度,并筛选出可作为生物柴油原料的微藻藻种,以期为利用微藻制备生物柴油提供基础资料。
1 材料和方法
1.1 材料
实验以微藻 P9、TH6和 CF5为材料,由苏州大学医学部史全良副教授鉴定。其中,微藻 P9为采自海南的第9号样本,生长在潮湿的土壤上,植物体为单列细胞组成的不分枝的丝状体,无特殊的基细胞和顶端细胞,易断裂成单个细胞,细胞略呈桶形,横壁略收缢,长度为宽度的1~3倍,初步判定为绿藻门(Ch lo rophyta)绿藻纲(Ch lorophyceae)丝 藻 目(U lo trichales)丝藻科(U lo trichaceae)克里藻属(KlebsormidiumSilva)种类;微藻 TH6为采自江苏苏州太湖的第6号样本,生长于潮湿的土壤上,植物体呈丝状,有分枝,以假根状枝着生于其他植物体上或漂浮于水面上,不具刺毛,营养细胞为柱状或近柱状,初步判定为绿藻门绿藻纲鞘藻目(Oedogoniales)鞘藻科(Oedogoniaceae)枝鞘藻属(OedocladiumStah l)种类;微藻 CF5为采自江苏苏州车坊镇的第5号样本,生长在水中木桩上,植物体由丝状体构成,具有不规则的侧生分枝,呈各种各样弯曲,成熟藻丝由单列或2列细胞组成,初步判定为蓝藻门(Cyanophyta)蓝藻纲(Cyanophyceae)真枝藻目(Stigonem atales)真枝藻科(Stigonem ataceae)真枝藻属(StigonemaAg.)种类。
1.2 方法
1.2.1 微藻培养 采用 BG11培养液配方配制微藻P9、TH6和 CF5的基本培养液(pH7.5),其中NaNO3质量浓度设置8个水平,分别为37.5、75.0、150.0、300.0、375.0、750.0、1500.0及1875.0m g·L-1,其中含1500.0m g·L-1NaNO3的BG11培养液为对照。接种后将各处理组微藻置于温度(25±1)℃、光照强度50μmol·m-2·s-1、光照时间12 h·d-1的白色日光灯下培养,每天定时摇瓶3次,每个浓度设置3个平行组。培养过程中每3天于超净工作台上称量1次,去除培养液后称量微藻及培养瓶的总质量,扣除培养瓶质量后即为微藻的生长量,每一样品重复测量3次,结果取平均值。
1.2.2 脂肪酸的提取及气相色谱分析 培养33 d后,取出藻体,于40℃条件下烘干48 h后,将干燥藻体研磨成粉末。取0.5 g藻体粉末,用索氏抽提法[8]抽提脂肪酸,并按文献[9]的方法酯化后用于气相色谱分析。
参照文献[2]的色谱条件,采用美国 Varian公司生产的 CP-3800型气相色谱仪测定脂肪酸含量,进样量为1μL。
1.3 数据处理
总脂肪酸含量和各脂肪酸成分相对含量的计算公式同文献[2]。采用 SPSS13.0统计分析软件进行ANOVA分析。
2 结果和分析
2.1 不同质量浓度 NaNO 3对3种微藻生长的影响
2.1.1 对微藻 P9生长的影响 在 BG11基本培养液中添加不同质量浓度 NaNO3,不同培养时间微藻P9的鲜质量见表1。由表1可知,在33 d的培养期中,在培养液中添加37.5~1875.0m g·L-1NaNO3对微藻 P9的生长均有一定的影响。在BG11培养液中添加37.5或75.0m g·L-1NaNO3,随培养时间延长,微藻 P9的鲜质量逐渐增加,并分别在培养的第24天或第21天达到峰值,然后再逐渐降低,但降低幅度不大且微藻 P9的鲜质量均明显高于培养初期;培养液中NaNO3添加量为150.0~1875.0m g·L-1,微藻 P9的鲜质量则随培养时间的延长逐渐增加,至培养结束时明显高于培养初期。
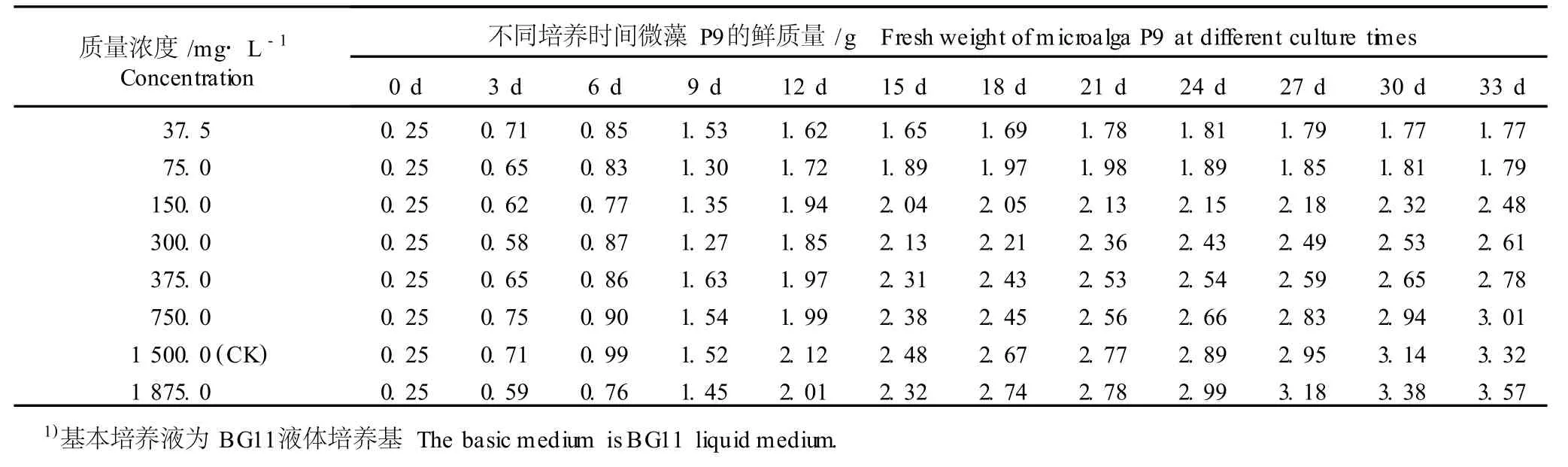
表1 不同质量浓度 NaNO 3对微藻 P9(K lebso rm id ium sp.)生长的影响1)Table1 Effect of d ifferen t concen tra tions of NaNO 3 on growth of m icroa lga P9(K lebso rm id ium sp.)1)
在不同培养阶段,在NaNO3添加量不同的各培养液中微藻 P9的生长量明显不同,尤其是在培养第18天后,均表现为随 NaNO3质量浓度的提高微藻 P9的鲜质量逐渐增加。若以添加1500.0 m g·L-1NaNO3的培养液为对照,在培养18 d后,仅在NaNO3添加量最高(1875.0m g·L-1)的培养液中微藻 P9的鲜质量略高于对照,而NaNO3添加量低于对照的其他处理组微藻 P9的鲜质量在不同培养时间均低于对照。
2.1.2 对微藻 TH6生长的影响 在 BG11基本培养液中添加不同质量浓度 NaNO3,不同培养时间微藻TH6的鲜质量见表2。由表2可看出,在33 d的培养期内,随NaNO3质量浓度的提高,微藻 TH6的鲜质量均相应增加。在 NaNO3质量浓度较低(37.5~75.0 m g·L-1)的培养液中,微藻 TH6的鲜质量随培养时间的延长先逐渐增加,至培养第27天时达到峰值,然后略微降低,但其鲜质量均明显高于培养初期;培养液中NaNO3添加量为150.0~1875.0m g·L-1,微藻TH6的鲜质量均随培养时间的延长逐渐增加,至培养结束时达到最高。若以添加1500.0m g·L-1NaNO3的培养液为对照,在添加了37.5~750.0 m g·L-1NaNO3的培养液中微藻 TH6的鲜质量在各个生长时间段均小于对照,但均表现出随NaNO3质量浓度的提高逐渐增加的趋势;只有在含1875.0 m g·L-1NaNO3的培养液中微藻 TH6的鲜质量在各个生长时间段均高于对照,其中在培养第33天时,微藻 TH6的鲜质量最高,比对照增加了5.09%。
2.1.3 对微藻 CF5生长的影响 在 BG11基本培养液中添加不同质量浓度 NaNO3,不同培养时间微藻CF5的鲜质量见表3。由表3可知,在33 d的培养期内,随NaNO3质量浓度的提高,微藻 TH6的鲜质量均相应增加。其中,在添加了37.5m g·L-1NaNO3的培养液中,随培养时间的延长,微藻 CF5的鲜质量先逐渐增加,在培养至第21天时达到峰值,随后逐渐降低,但降低幅度不明显,且其鲜质量明显高于培养初期;而在NaNO3添加量为75.0~1875.0m g·L-1的培养液中,微藻 CF5的鲜质量总体上随培养时间的延长逐渐增加,并在培养结束时达到最高。
以添加1500.0m g·L-1NaNO3的BG11培养液为对照,在添加37.5~750.0m g·L-1NaNO3的培养液中,培养前期(0~9 d)微藻 CF5的鲜质量或低于对照或高于对照,无明显的规律性;而在培养的中后期(12~33 d),在添加37.5~750.0 m g·L-1NaNO3的培养液中微藻 CF5的鲜质量均低于对照,且总体上呈现随质量浓度提高逐渐增加的趋势,即:NaNO3质量浓度越高,CF5鲜质量越大。在添加1875.0 m g· L-1NaNO3的培养液中,微藻 CF5鲜质量在大多数培养时间段均高于对照,至培养结束(33 d)时,微藻CF5的鲜质量最大(3.81 g),比对照增加了4.96%。
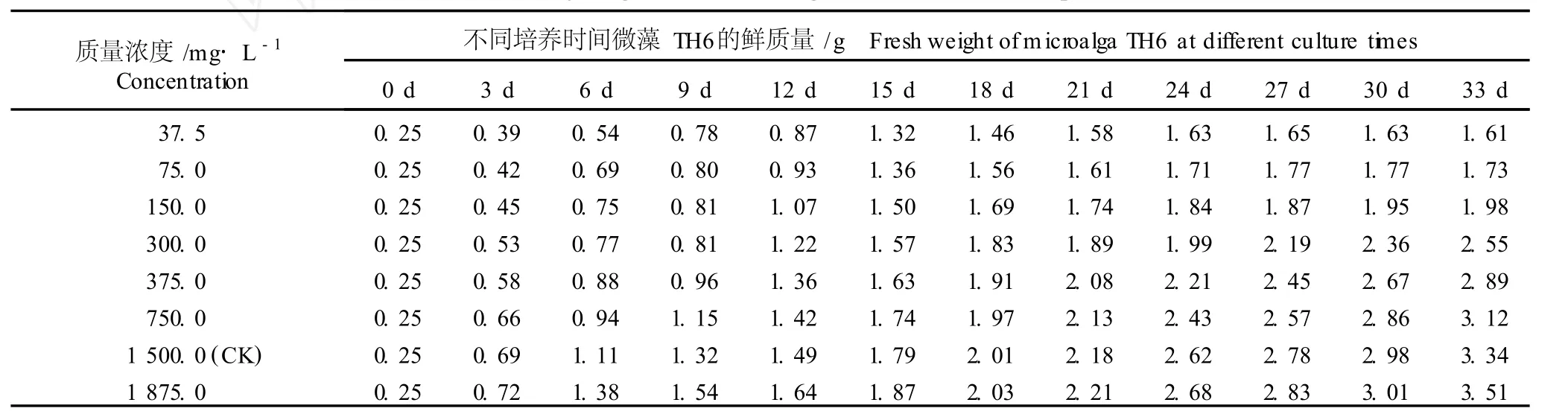
表2 不同质量浓度 NaNO 3对微藻 TH6(O edoc lad ium sp.)生长的影响1)Table2 Effect of d ifferen t concen tra tion s of NaNO 3 on growth of m icroa lga TH6(O edoc lad ium sp.)1)
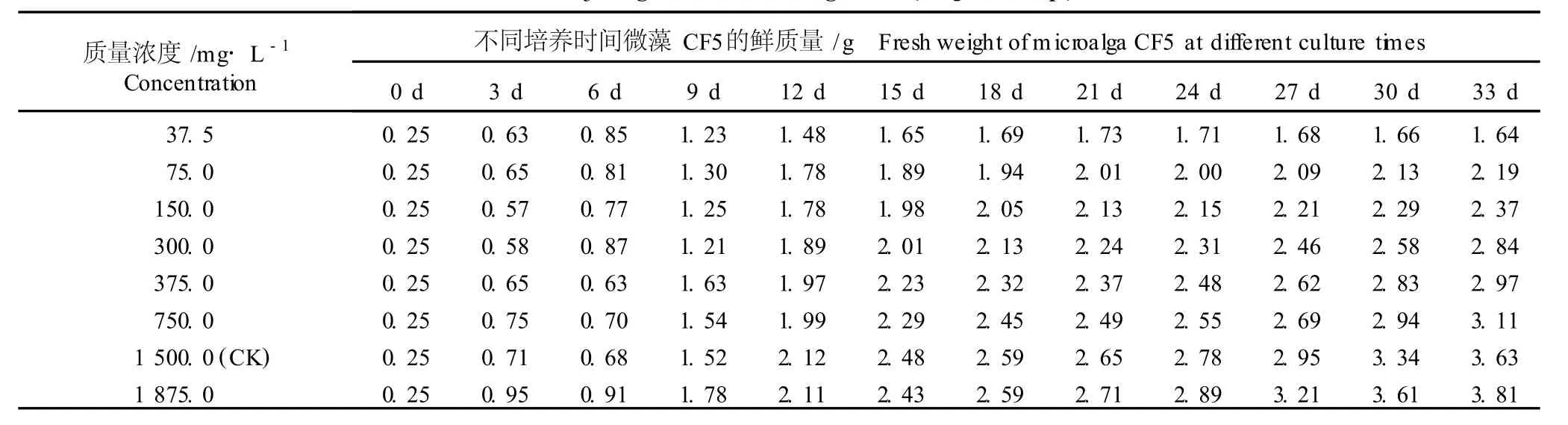
表3 不同质量浓度 NaNO 3对微藻 CF5(Stigonem a sp.)生长的影响1)Table3 Effect of d ifferen t concen tra tions of NaNO 3 on growth of m icroa lga CF5(Stigonem a sp.)1)
综合上述实验结果可看出,采用BG11培养液并改变(增加或减少)原有配方中NaNO3的质量浓度,均对微藻的生长量有一定的影响。在37.5~1875.0 m g·L-1质量浓度范围内,随 NaNO3质量浓度的提高,微藻的生长量逐渐增加;在低氮条件下,微藻的生长受到一定的抑制,NaNO3质量浓度为37.5 m g·L-1时,3种微藻的鲜质量均最小,并且随培养时间的延长,微藻的鲜质量呈下降趋势;而高氮(1875.0m g· L-1NaNO3)条件对微藻的生长则有一定的促进作用,培养结束时,3种微藻的鲜质量均最大。另外,在同样的条件下,3种微藻的生长量有一定的差异,随培养时间的延长生长量的变化趋势也有一定的差异,与微藻种类的不同有关。
2.2 不同质量浓度 NaNO 3对3种微藻总脂肪酸含量和脂肪酸组成的影响
2.2.1 对微藻 P9总脂肪酸含量和脂肪酸组成的影响 在BG11培养液中添加不同质量浓度NaNO3对微藻 P9总脂肪酸含量及脂肪酸组成的影响见表4。在37.5~1875.0m g·L-1质量浓度范围内,随NaNO3质量浓度的提高,微藻 P9的总脂肪酸含量呈现先增加后减少的变化趋势(表4),且不同质量浓度处理组间微藻 P9的总脂肪酸含量有明显的差异。
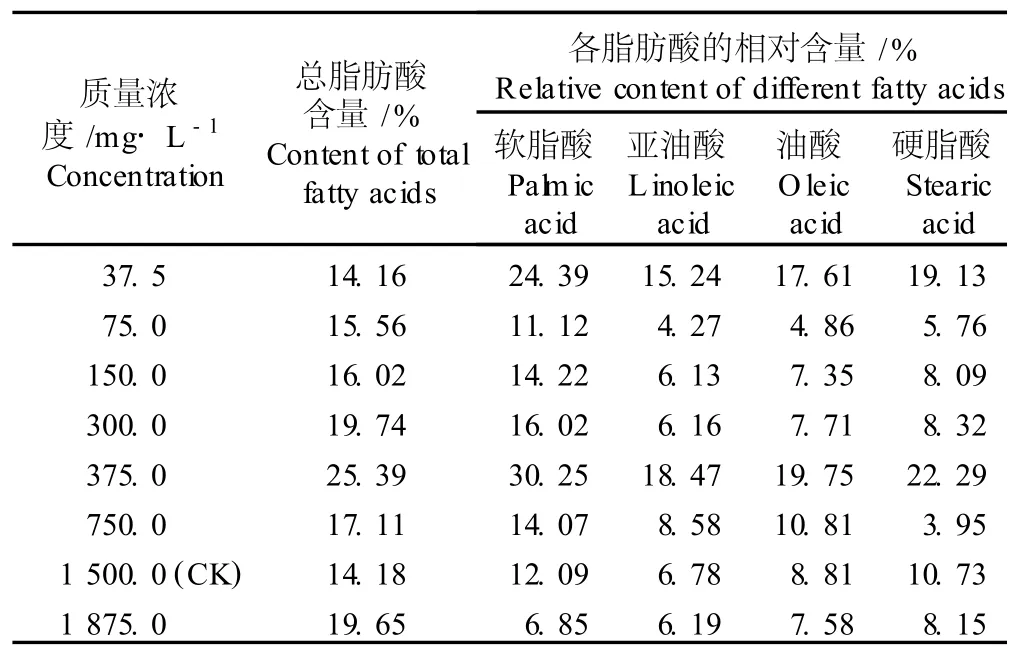
表4 不同质量浓度 NaNO 3对微藻 P9(K lebso rm id ium sp.)总脂肪酸含量和脂肪酸组成的影响1)Table4 Effect of d ifferen t concen tra tion s of NaNO 3 on tota l fa tty acid con ten t and fa tty acid com position of m icroa lga P9(K lebso rm id ium sp.)1)
在NaNO3添加量为375.0m g·L-1的培养液中微藻 P9的总脂肪酸含量最高,达到25.39%,为对照组(NaNO3质量浓度为1500.0 m g·L-1)微藻 P9总脂肪酸含量的1.79倍,但随培养液中 NaNO3质量浓度继续提高,微藻 P9的总脂肪酸含量并没有增加,反而略有下降,说明对于微藻 P9的培养而言,若以获取脂肪酸为培养目的,则培养液中最佳的NaNO3质量浓度应为375.0m g·L-1。而且,在 NaNO3添加量为375.0m g·L-1的培养液中,软脂酸、亚油酸、油酸和硬脂酸的相对含量分别为30.25%、18.47%、19.75%和22.29%,依次为对照组的2.50、2.72、2.24和2.08倍,其中,饱和脂肪酸相对含量为52.54%,不饱和脂肪酸相对含量为38.22%。因而,无论是从总脂肪酸含量还是从制备生物柴油所需的这4种脂肪酸的相对含量看,含有375.0m g·L-1NaNO3的BG11培养液不但适合微藻 P9的生长而且对脂肪酸合成有明显的促进作用,且脂肪酸的组成也适合制备生物柴油。
2.2.2 对微藻 TH6总脂肪酸含量和脂肪酸组成的影响 在BG11培养液中添加不同质量浓度NaNO3对微藻 TH6总脂肪酸含量及脂肪酸组成的影响见表5。随培养液中NaNO3质量浓度的提高,微藻 TH6的总脂肪酸含量无明显的变化趋势,但不同质量浓度NaNO3处理组间总脂肪酸含量有一定的差异。其中,在NaNO3添加量为37.5m g·L-1的 BG11培养液中,微藻 TH6的总脂肪酸含量最高,达到20.69%,为对照组(NaNO3质量浓度为1500.0m g·L-1)的1.89倍,也明显高于其他处理组;且其饱和脂肪酸和不饱和脂肪酸的相对含量分别为33.23%和14.75%,其中的软脂酸、亚油酸和油酸的相对含量也最高,分别达到28.07%、6.91%和7.84%,分别为对照组的3.37、1.79和1.92倍,但硬脂酸的相对含量则较对照减少了0.07百分点。实验结果表明,在低氮条件下(NaNO3质量浓度为37.5m g·L-1)培养有利于微藻TH6总脂肪酸的合成,也利于其中不饱和脂肪酸组分的合成。
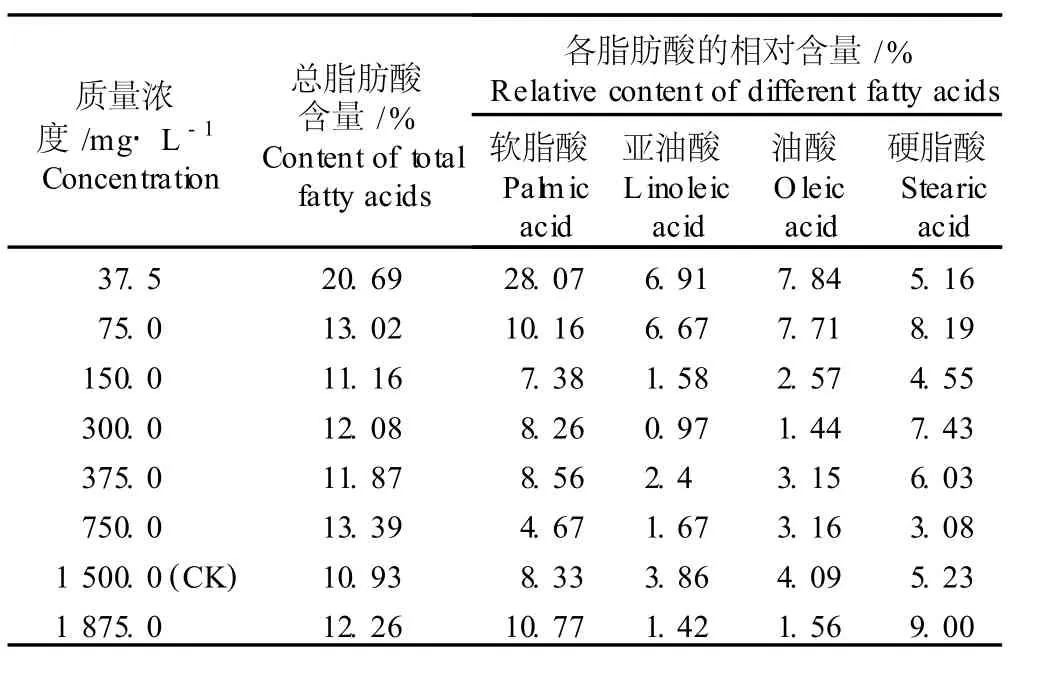
表5 不同质量浓度 NaNO 3对微藻 TH6(O edoc lad ium sp.)总脂肪酸含量和脂肪酸组成的影响1)Table5 Effect of d ifferen t concen tra tion s of NaNO 3 on tota l fa tty acid con ten t and fa tty acid com position of m icroa lga TH6(O edoc lad ium sp.)1)
2.2.3 对微藻 CF5总脂肪酸含量和脂肪酸组成的影响 在BG11培养液中添加不同质量浓度NaNO3对微藻 CF5总脂肪酸含量及脂肪酸组成的影响见表6。研究结果表明,随着 NaNO3质量浓度的提高,微藻CF5的总脂肪酸含量没有明显的变化趋势,但各处理组的总脂肪酸含量均高于对照组(NaNO3质量浓度为1500.0m g·L-1),表明培养液中 NaNO3质量浓度的改变对微藻 CF5的总脂肪酸合成有一定的影响,但这种影响效应不明显。
在NaNO3添加量为1875.0 m g·L-1的培养液中,微藻 CF5的总脂肪酸含量最高(18.79%);在NaNO3添加量为150.0 m g·L-1的培养液中,微藻CF5的饱和脂肪酸相对含量最高(21.93%);而在NaNO3添加量为750.0 m g·L-1的培养液中,微藻CF5的不饱和脂肪酸相对含量最高(16.14%)。综合以上研究结果后可看出,虽然在 NaNO3质量浓度为150.0m g·L-1的 BG11培养液中微藻 CF5的总脂肪酸含量并不是各处理组中最高的,且其不饱和脂肪酸的相对含量也低于75.0m g·L-1NaNO3处理组,但考虑到微藻CF5的生长量,最终确定微藻CF5培养的适宜NaNO3质量浓度为150.0m g·L-1。
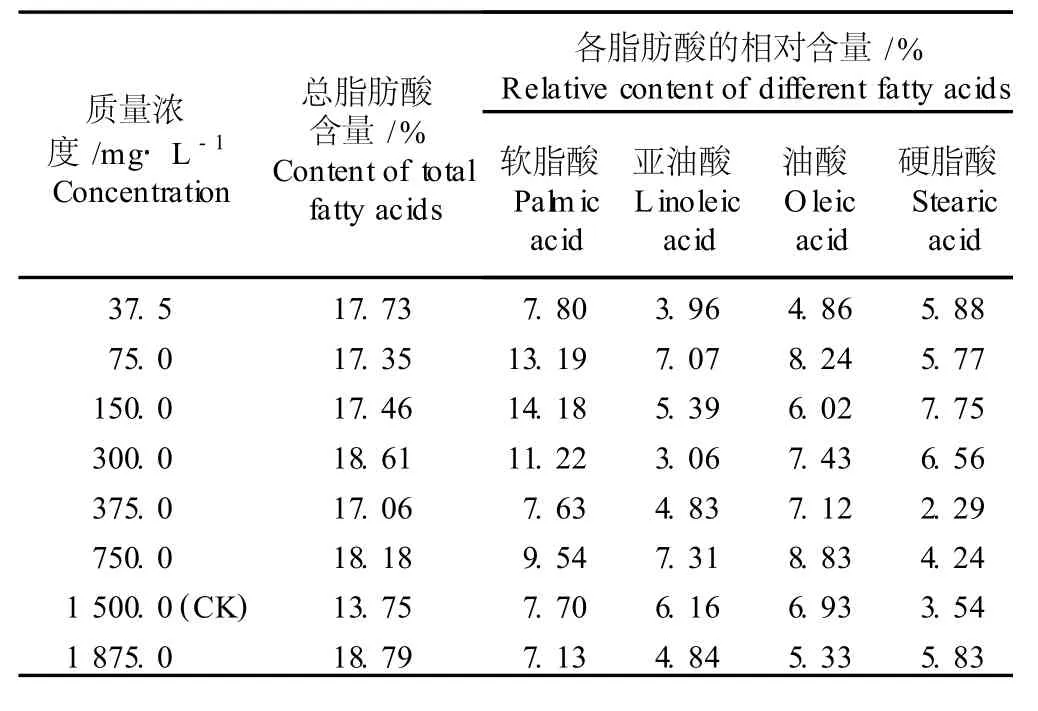
表6 不同质量浓度 NaNO 3对微藻 CF5(Stigonem a sp.)总脂肪酸含量和脂肪酸组成的影响1)Table6 Effect of d ifferen t concen tra tion s of NaNO 3 on tota l fa tty acid con ten tand fa tty acid com position of m icroa lga CF5(Stigonem a sp.)1)
3 讨 论
在培养微藻时硝态氮被广泛用作氮源,但当藻类受到氮胁迫时,由于光合作用并未中断,碳元素的同化作用仍继续进行,导致脂肪酸合成模式的改变,转而合成中性的甘油三酯[10],并以油滴的形式贮藏在细胞质中。Yongm anitchai等[3]发现,在缺氮条件下,有15种绿藻的总脂肪酸含量较高;Pio rreck等[11]也发现一些藻类在缺氮条件下脂类含量升高;Thom as等[12]和 Fábregas等[13]的研究结果也表明,在缺氮条件下,三角褐指藻和Dunaliellatertiolecta的脂类开始累积;Suen等[6]报道,在缺氮条件下,拟微球藻(Nannochloropsissp.Q II)的总脂肪酸含量可高达55%,而在氮饱和时总脂肪酸的含量只有24%。因此,氮含量对控制微藻脂肪酸含量有非常重要的作用,有些微藻在氮营养不足时脂肪酸含量并不增加,相反,在一定范围内氮浓度较高时脂肪酸的含量增加,说明这些藻类的代谢途径有所不同。Reitan等[14]曾研究了三角褐指藻等7种微藻在氮限制条件下脂肪酸含量的变化,结果表明:随氮盐不足的加剧,总脂肪酸中多数不饱和脂肪酸的百分比呈下降趋势;梁英等[15]研究了NaNO3浓度对2株三角褐指藻脂肪酸组成的影响,认为三角褐指藻的 EPA含量有随NaNO3质量浓度提高而增加的趋势。
实验结果表明,培养33 d后,随着NaNO3质量浓度的提高,3种微藻鲜质量均逐渐增大,但在选择微藻适宜的培养液时,不但要考虑微藻的生长量,更重要的是还要考虑微藻中总脂肪酸含量及脂肪酸组成的变化。随NaNO3质量浓度的提高,微藻 P9的总脂肪酸含量增加,且在 NaNO3添加量为375.0m g·L-1的培养液中总脂肪酸含量最高,不饱和脂肪酸的相对含量为38.22%,饱和脂肪酸的相对含量为52.54%,饱和脂肪酸与不饱和脂肪酸的相对含量分别是对照组的2.30和2.45倍,因此,在实验室条件下培养微藻P9时 NaNO3的添加量应为375.0 m g·L-1。低氮(37.5m g·L-1NaNO3)条件下,微藻 TH6的总脂肪酸含量最高,为对照组的1.89倍,亚油酸、油酸和硬脂酸的相对含量变化不显著,但是软脂酸相对含量较对照提高了约3倍,因此,在实验室条件下培养微藻TH6时 NaNO3的添加量应为37.5 m g·L-1。在NaNO3质量浓度不同的培养条件下,微藻 CF5的总脂肪酸含量差异不大,且软脂酸、亚油酸、油酸和硬脂酸含量的变化也不明显,但从饱和脂肪酸与不饱和脂肪酸的比例考虑,在实验室条件下培养微藻 CF5时NaNO3的添加量应为150.0m g·L-1。上述研究结果也表明,由于不同种类微藻的代谢机制不同,因而不同微藻适应的氮浓度也有明显的差异。
在脂肪酸的合成过程中,乙酰辅酶 A羧化酶(ACCase)是脂肪酸合成的关键限速酶;然而,对脂类代谢而言,ACCase和磷酸烯醇式丙酮酸羧化酶(PEPC)的相对活性影响着脂类代谢途径的走向;通过糖酵解途径产生丙酮酸后,ACCase催化底物乙酰辅酶A进入脂肪酸合成途径;乙酰辅酶A的浓度累积激活 PEPC,催化丙酮酸合成草酰乙酸进入氨基酸合成途径,因此,抑制 PEPC活性有助于提高ACCase催化底物进入脂肪酸合成途径[16]。研究结果表明,硝态氮浓度可能在一定程度上提高 ACCase的活性、促进脂肪酸合成、增加藻类总脂肪酸的含量,但是其作用机制以及是否具有抑制 PEPC活性的作用,目前尚不清楚。通过进一步的研究,如果能够准确控制微藻脂肪酸合成与代谢过程中 ACCase和 PEPC的活性,使代谢产物向脂肪酸合成途径方向进行转化,从而极大幅度提高微藻中的总脂肪酸含量,并使脂肪酸的组成更适合用于制备生物柴油,可为生产生物柴油提供更加廉价的原料。
[1]Shim ada Y,Watanabe Y,Sam ukaw a T,et al.Conversion of vegeTable oil to biodiesel using immobilizedCandidaantarcticalipase [J].Journal of theAmericanO ilChem ists’Society,1999,76(7):789-793.
[2]杨 凯,史全良.不同浓度 IAA对微藻 TH6(Oedocladiumsp.)生长及脂肪酸含量的影响[J].植物资源与环境学报,2009,18(2):80-83,96.
[3]YongmanitchaiW,Ward O P.growth of and omega-3 fatty acid p roduction byPhaeodactylumtricornutumunder different cu lture conditions[J].App lied and EnvironmentMicrobiology,1991,57(2):419-425.
[4]Chen F,JohnsMR.Effect of C/N ratio and aeration on the fatty acid composition of heterotrophicChlorellasorokiniana[J].Journal of App lied Phycology,1991,3(3):203-209.
[5]Kap lan D,Richmond A E,Dubinsky Z,et al.A lgal nutrition [M]∥Richmond A.Handbook of MicroalgalMass Culture.Boca Raton:CRC Press,1986.
[6]Suen Y,Hubbard JS,HolzerG,etal.Total lip id p roduction of the green algaNannochloropsissp.Q IIunder different nitrogen regimes [J].Journal of Phycology,1987,23(2):289-296.
[7]Regan D L.O therm icro-algal[M]∥Borow itzkaMA,Borow itzka L J.Micro-algal Biotechno logy.Cambridge:Cambridge University Press,1988.
[8]大连轻工业学院,华南理工大学,郑州轻工业学院,等.食品分析[M].北京:中国轻工业出版社,1998:73-223.
[9]邵海艳,吉宏武,章超桦,等.刺松藻化学成分测定及其营养评价[J].食品研究与开发,2007,28(10):160-162.
[10]Shaw R.The polyunsaturated fatty acids of m icroorganism s[J]. Advances in L ip id Research,1966,4:107-174.
[11]Piorreck M,Baasch K H,Pohl P.Biomass p roduction,total p rotein,chlorophylls,lip idsand fatty acids of freshwatergreen and blue-green algae under different nitrogen regimes[J].Phytochem istry,1984,23:207-216.
[12]ThomasWH,Seibert D L R,A lden M,et al.Yields,photosynthetic efficiencies and p roximate composition of dense marine m icroalgal cu ltures.I.Introduction andPhaeodactylumtricornutumexperiments[J].Biomass,1984,5:181-209.
[13]Fábregas J,Abalde J,Herrero C.Biochem ical composition and growth of the marine m icroalgaDunaliellatertiolecta(Butcher) with different ammonium nitrogen concentrations as chloride, sulphate,nitrate and carbonate[J].Aquaculture,1989,83(3/4):289-304.
[14]Reitan K L,Rainuzzo JR,O lsen Y.Effect of nutrient lim itation on fatty acid and lip id content of marinem icroalgae[J].Journal of Phycology,1994,30(6):972-979.
[15]梁 英,麦康森,孙世春.硝酸钠浓度对2株三角褐指藻生长及脂肪酸组成的影响[J].黄渤海海洋,2001,19(4):56-62.
[16]Song D H,Fu J J,ShiD J.Exp loitation of oil-bearingm icroalgae for biodiesel[J].Chinese Journal of Biotechnology,2008,24(3):341-348.
