水稻白叶枯病菌在离体培养条件下生物膜形成的检测
2010-11-30傅本重吴茂森陈华民何晨阳
傅本重, 吴茂森, 陈华民, 何晨阳
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
生物膜是细菌通过胞外基质(多糖、蛋白质、脂肪和核酸等)聚集附着于生物或非生物表面、结构复杂的群落[1]。无论是在自然环境还是在人工条件下,许多细菌主要以生物膜形式存活[2]。细菌生物膜不仅可引起严重的经济和健康问题(如对抗生素抗性和生物污染等)[3],而且它还是一个重要的致病因子,在人类致病菌以及植物-病原物互作中具有毒性作用的功能[4-5]。如植物病原细菌柑橘溃疡病菌和苛养木杆菌生物膜形成在其定殖和病害循环中起重要的作用[6-7]。
水稻白叶枯病菌(Xanthomonas oryzae pv.oryzae,Xoo)是一种世界范围内引起水稻严重病害的病原细菌[8]。长期以来,人们一直致力于Xoo生物学性状的研究,但有关其生物膜的研究鲜有报道。为了阐明Xoo在人工离体培养条件下生物膜形成及其影响因素,本研究分析了不同培养条件对Xoo生物膜形成的影响,利用结晶紫染色快速测试法,测定了Xoo不同菌株的生物膜形成能力。本研究结果不仅建立适合于Xoo生物膜形成能力的测定方法,而且也为研究Xoo生物膜产生机制及其在致病过程中的作用奠定了基础。
1 材料与方法
1.1 供试菌株和材料
本试验所用菌株及其来源列于表1。Xoo菌株用M210培养基(酶水解干酪素8 g/L、蔗糖5 g/L、酵母提取物 4 g/L、K 2HPO4 3 g/L、MgSO4·7H 2 O 0.3 g/L、pH 7.0)在28℃培养;基因缺失突变体和互补菌株的培养加入相应抗生素,使用浓度为庆大霉素(Gm)30μg/mL,壮观霉素(Sp)40μg/mL。结晶紫购自Amresco公司。96孔聚苯乙烯微量板为Axygen公司产品。
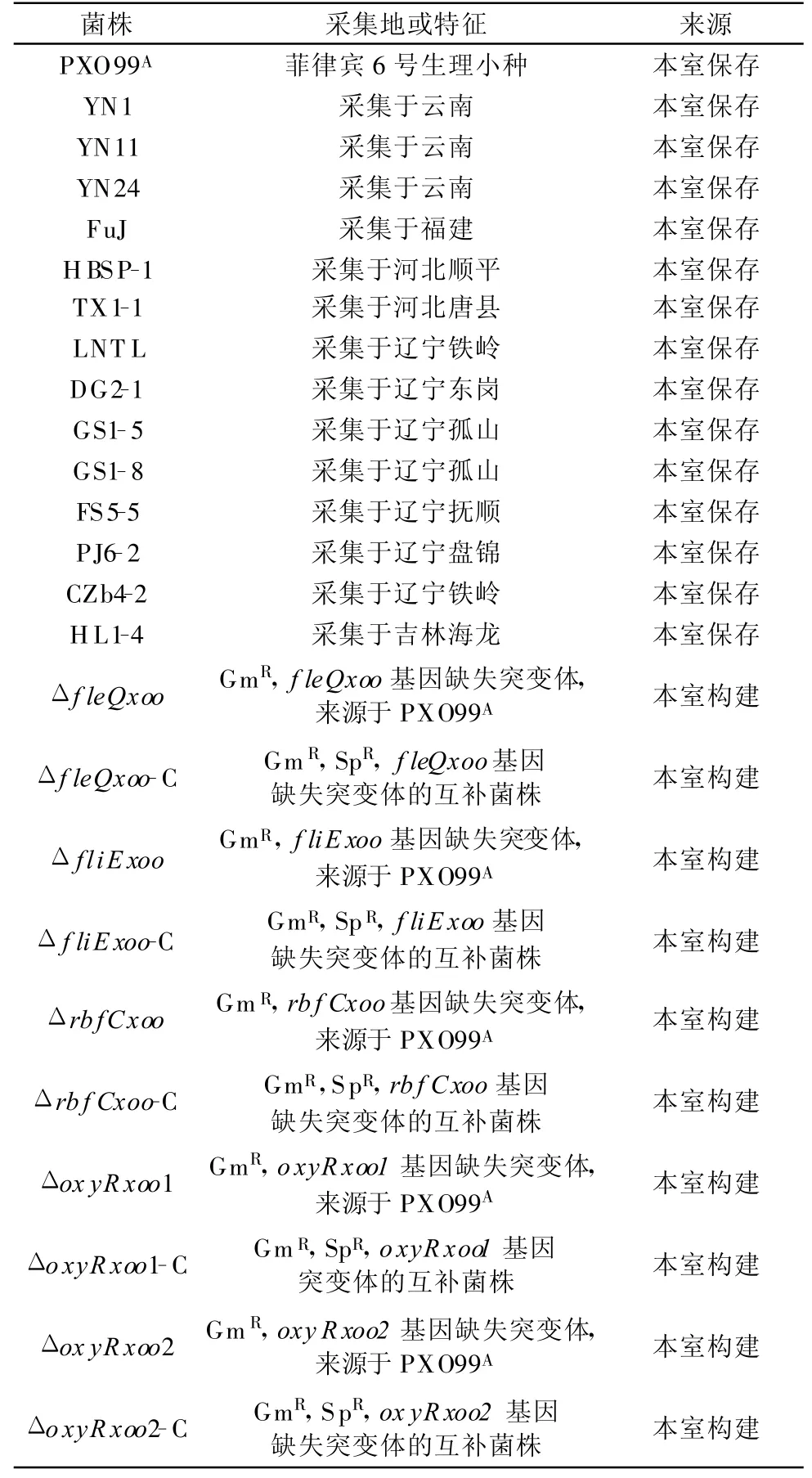
表1 本研究所用菌株来源
1.2 PXO99A在不同培养条件下生物膜形成的测定
挑取Xoo野生型菌株PXO99A的单菌落,接种于M 210,振荡培养(120 r/min,28℃)至指数生长期(A600=2.0)或平台期(A600=3.5),进行以下不同培养和测试条件的处理。参照文献[9]描述的结晶紫染色法进行生物膜测定。每个测试样品设5个重复,所有试验重复 3次。
测试材料:取1、2 mL和150μL指数生长期的菌液,分别加入1.5 mL聚丙乙烯离心管、15 mm×150 mm玻璃试管和96孔聚苯乙烯微量板孔中,在28℃静止24 h后,测试生物膜形成。
生长期:取150μL指数生长期或平台期的菌液,加入96孔聚苯乙烯微量板孔中,在28℃静止培养12、18 h和 24 h后,测试生物膜形成。
培养时间:取150μL指数生长期的菌液,加入96孔聚苯乙烯微量板孔中,在 28℃静止6、8、10 h、12、18、24 h和48 h,测试生物膜形成。
培养温度:取150μL指数生长期的菌液,加入96孔聚苯乙烯微量板孔中,在18、23、28℃和33℃静止培养24 h后,测试生物膜形成。
培养基:取 10 mL指数生长期的菌液,离心(5 000 r/min,10 min)收集菌体;加入10 mL新鲜M 210或 LB培养基,重新悬浮细菌;取150μL菌悬液加入96孔聚苯乙烯微量板孔中,在 28℃静止24 h后,测试生物膜形成。
1.3 Xoo不同野生型、突变体及其互补菌株生物膜形成的测定
挑取新鲜培养的单菌落,接种于M210中,振荡培养(120 r/min,28℃)至指数生长期(A600=2.0)。取150μL培养菌液加入96孔聚苯乙烯微量板孔中,在23℃静止培养24 h后,用结晶紫染色法测试其生物膜的形成。每个样品设5个重复,所有试验重复3次。
2 结果与分析
2.1 不同培养和测试条件对PXO99A生物膜形成的影响
为了阐明不同材料表面对Xoo菌株PXO99A生物膜形成的影响,本研究首先检测了病菌在塑料离心管、玻璃试管和96孔聚苯乙烯微量板3种不同材料表面生物膜的产生能力。PXO99A在3种材料表面都能产生生物膜,而在96孔聚苯乙烯板上形成的生物膜明显而稳定(图1)。因此,本研究选用96孔聚苯乙烯板进行后续检测分析。

图1 PXO99A在不同材料表面生物膜的形成
有报道认为细菌能在聚苯乙烯表面24 h内形成生物膜[5],因此,本研究对PXO99A生物膜形成最佳时间点进行了确定。PXO99A在6 h开始形成非常弱的生物膜,从18 h到48 h能形成较强的生物膜,其中24 h形成能力最强(图2)。对不同生长期细菌的生物膜测试表明,指数期和平台生长期细胞静止培养24 h后都形成明显的生物膜,指数生长期细胞的生物膜形成能力更强(图3)。

由于Xoo最适生长温度为26~28℃,本研究检测了该生长温度上下5℃温度范围内生物膜的形成情况。结果表明,Xoo在18~33℃均能形成生物膜,其中在23℃时形成能力最强(图4)。

图4 不同温度下的PXO99A生物膜形成
对在M210或LB培养基中生长的Xoo生物膜测试表明,更换新鲜培养基均降低生物膜形成能力,其中更换M210后减弱十分明显(图5)。

图5 不同培养基中PXO99A生物膜的形成
2.2 不同地区的Xoo野生型菌株生物膜形成能力
对前期收集或采集的、来源于南方地区(云南和福建)和北方地区(河北、辽宁和吉林)的 14个Xoo野生型菌株进行了生物膜测定。发现所有测试菌株都能产生生物膜,但各菌株之间的生物膜形成能力存在差异,然而这些差异与地区来源无关(图6)。

图6 不同来源的野生型Xoo菌株生物膜形成
2.3 Xoo不同基因缺失突变体及其互补菌株生物膜形成的能力
对前期构建的Xoo基因缺失突变体及其互补菌株[10]的生物膜形成进行了测定(图7)。与野生型菌株PXO99A相比,鞭毛合成转录调控因子基因突变体Δf leQxoo和基体蛋白基因突变体Δf liExoo、与H 2O2降解有关的转录调控因子基因突变体Δoxy Rxoo生物膜形成能力均显著降低,而糖基转移酶基因突变体Δrbf Cxoo生物膜形成能力明显增强。所有相应的互补菌株可以不同程度地恢复到与PXO99A相似的表型。

图7 Xoo不同突变株生物膜形成
3 结论与讨论
长期以来,对包括Xoo在内的病原黄单胞菌生物膜研究一直没有一套标准、规范和准确的快速测定方法,生物膜测试结果模糊,需要的菌液体积较大、试剂多,并且操作不便,容易产生误差。因此,本研究首先重点分析了不同培养条件(塑料和玻璃表面、培养时间、培养温度和培养基)对Xoo生物膜形成的影响,发现在聚苯乙烯界面、用M 210培养基、在23℃静止培养24 h是检测Xoo生物膜形成的适宜条件,从而为Xoo生物膜形成能力分析提供了一套快速可行的测定方法。有研究表明,适当降低培养温度利于弯曲杆菌在不锈钢材料表面的生物膜形成[11],其原因可能是由于生物膜依赖的基因表达增强引起的[12]。培养基对生物膜的影响可能主要是由于提供的营养条件变化引起的。在生长到指数期的细胞培养物中,营养成分大部分已经被消耗,营养受到限制而促进生物膜的形成。更换新鲜培养基后,生物膜形成能力下降。
本研究利用建立起的这一套相对规范的结晶紫染色法,测定了不同地区来源的Xoo野生型菌株、不同基因缺失突变体及其互补菌株的生物膜形成能力。发现所有野生型菌株都能产生生物膜(尽管生物膜形成能力存在一定的差异),这一结果表明生物膜产生在Xoo中是一个比较普遍的生物学性状。此外,本研究发现Xoo鞭毛合成调控或组成基因f leQxoo、f liExoo和rbf Cxoo以及H 2O2降解调控基因oxy Rxoo的突变都影响生物膜形成。这些基因突变与生物膜形成之间的作用机理尚需深入研究。尽管有许多报道认为生物膜形成是植物病原细菌一个新的致病机制,但是有关 Xoo生物膜在Xoo-水稻互作中的功能尚不清楚,有待进一步研究。
[1] O′Toole G,Kaplan H B,Kolter R.Biofilm formation as microbial development[J].Annu Rev Microbiol,2000,54:49-79.
[2] Webb J S,Givskov M,Kjelleberg S.Bacterial biofilms:prokaryotic adventures in multicellularity[J].Curr Opin Microbiol,2003,6(6):578-585.
[3] Costerton J W,Stewart P S,Greenberg E P.Bacterial biofilms:a common cause of persistent infections[J].Science,1999,284(5418):1318-1322.
[4] Yang L,Haagensen JA,Jelsbak L,et al.In situ growth rates and biofilm development of Pseud omonas aer uginosa populations in chronic lung infections[J].J Bacteriol,2008,190(8):2767-2776.
[5] Torres P S,Malamud F,Rigano L A,et al.Controlled synthesis of the DSF cell-cell signal is required for biofilm formation and virulence in Xanthomonas campestris[J].Environ Microbiol,2007,9(8):2101-2109.
[6] Rigano L A,Siciliano F,Enrique R,et al.Biofilm formation,epiphytic fitness,and canker development in Xanthomonas axonopodis pv.citri[J].Mol Plant Microbe Interact,2007,20:1222-1230.
[7] Osiro D,Colnago L A,Otoboni A M,et al.A kinetic model for Xylella fastidiosa adhesion,biofilm formation and virulence[J].FEMS Microbiol Lett,2004,236(2):313-318.
[8] Nino-Liu D,Ronald P,Bogdanove A J.Xanthomonasoryzae pathovars:model pathogens of a model crop[J].Molecular Plant Pathology,2006,7:303-324.
[9] Li X Z,Hauer B,Rosche B.Single-species microbial biofilm screening for industrial applications[J].Appl Microbiol Biotechnol,2007,76(6):1255-1262.
[10]张静,许景升,吴茂森,等.水稻白叶枯病菌转录调控因子基因 f leQxoo和σ54因子基因r poNxoo的分子鉴定[J].植物病理学报,2008,38(5):449-455.
[11]Sanders SQ,Frank J F,Arnold JW.Temperature and nutrient effects on Campylobacter jejuni attachment on multispecies biofilms on stainless steel[J].J Food Prot,2008,71:271-278.
[12]White-Ziegler C A,Um S,Perez N M,et al.Low temperature(23 degrees C)increases expression of biofilm-,cold-,shockand RpoS-dependent genes in Escher ichia coli K-12[J].Microbiology,2008,154:148-166.
