L-脯氨酸催化的硝基烷烃与醛的缩合反应*
2010-11-26杨建鑫陆伟栋施小新
杨建鑫, 吕 霞, 陆伟栋, 董 菁, 施小新
(华东理工大学 药学院 制药工程系,上海 200237)
硝基烯烃是一类十分重要的有机合成中间体[1~6],通常由硝基烷烃经Henry反应得到β-硝基醇,再经脱水而得[7~9]。Henry反应可在有机或无机碱催化下于低温进行[10~12],而Henry反应的产物β-硝基醇则需在酸或碱催化下经高温(回流)脱水生成硝基烯烃[13,14]。在硝基烯烃的合成中,Henry反应和β-硝基醇脱水反应可分步进行或“一锅法”完成,但两种方式中均需加热,因此,应尽可能使用弱碱和弱酸作为反应的催化剂,从而使反应的收率更高,并使反应的应用范围更加广泛。
最近,我们在研究硝基烷烃和醛的“一锅法”法合成硝基烯烃的过程中发现近中性的氨基酸可作为较理想的催化剂,尤其是L-脯氨酸对反应的催化效果最为理想。
本文研究了氨基酸催化的醛(1a~1i)与硝基甲烷(2)或硝基乙烷(3)的缩合反应,高产率(77%~95%)地合成了一系列的硝基烯烃4a~4i和5a,5b,5e,5g,5h(Scheme 1),其结构经1H NMR, IR和MS表征。并考察了各种氨基酸对4e产率的影响,结果发现以L-脯氨酸为催化剂时,其用量(0.1 eq)较低,且催化活性最强,4e产率达91%。
1 实验部分
1.1 仪器与试剂
SWG X-4型显微熔点仪;Bruker ADVANCE 500 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);NICOLET IR 550型红外光谱仪(KBr压片);HP 5989A型质谱仪。所用试剂均为分析纯。
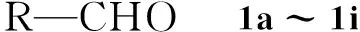
+(or(or)5a, 5b, 5e, 5g, 5h
Scheme1
1.2 4的合成(以4a为例)
在反应瓶中加入3,4-二甲氧基苯甲醛(1a)5.00 g(30 mmol)和230 mL,搅拌使其溶解,加入L-脯氨酸0.35 g(3 mmol),回流反应(TLC跟踪)。蒸干硝基甲烷,残余物用乙酸乙酯(30 mL)和水(10 mL)溶解,分液,水相用少量乙酸乙酯萃取,合并有机相,用无水MgSO4干燥,蒸干溶剂得深棕色固体,用乙醇/水重结晶得黄色固体4a;1H NMRδ: 3.94(s, 3H), 3.95(s, 3H), 6.92(d,J=8.3 Hz, 1H), 7.01(d,J=1.7 Hz, 1H), 7.18(dd,J=8.3 Hz, 1.7 Hz, 1H), 7.54(d,J=13.6 Hz, 1H), 7.97(d,J=13.6 Hz, 1H); IRν: 3 130, 3 000, 1 635, 1 600, 1 495, 1 340, 1 260, 1 225, 1 160, 1 145, 1 015, 805 cm-1; EI-MSm/z(%): 209(M+, 100), 178(6), 162(48), 147(16), 133(7), 119(11)。
用类似的方法合成4b~4i和5a,5b,5e,5g,5h(除4i为黄色液体外,其余均为黄色固体),其表征结果[15]与Scheme 1预期结构相符。
2 结果与讨论
2.1 氨基酸的催化活性
以3-吲哚甲醛(1e)和2的反应为模板,考察不同氨基酸对反应的催化活性,结果见表1。从表1可见,各种氨基酸均能催化1e和2的反应,生成相应的产物4e,但L-脯氨酸的催化活性最强,不仅用量较小,而且副反应少,收率明显较高。
2.2 L-脯氨酸催化的醛与硝基烷烃的缩合反应
L-脯氨酸催化1a~1i与2或3的反应结果见表2,表征结果[15]与Scheme 1预期相吻合。
2.3 氨基酸构型对反应的影响
对同一种氨基酸而言,其立体构型对反应几乎没有影响,即使用L-型、D-型或DL-型氨基酸对反应的速度和收率没有影响。但由于天然的氨基酸是L-构型,价格较便宜,本文研究均使用L-型氨基酸作催化剂。

表1 氨基酸对1e和2反应的催化活性Table 1 Catalytic activities of amino acids on the reaction between 1e and 2

表2 L-脯氨酸催化的醛与硝基烷烃的缩合反应结果Table 1 Condensation results of L-proline-catalyzed nitroalkanes with aldehydes
2.4 硝基烯烃的顺、反构型
在L-脯氨酸催化下,醛与硝基烷烃反应所生成的硝基烯烃的几何构型都为反式,即(E)-型,而且反应的顺反选择性很高,1H NMR分析表明,产物中几乎不含顺式异构体,反式含量都在99%以上。
3 结论
通过L-脯氨酸催化硝基甲烷或硝基乙烷与各种醛的“一锅”反应,合成了一系列硝基烯烃。与文献方法相比,主要优点是L-脯氨酸是一种近中性的化合物,本文报道的方法适用于一些对强碱或强酸较敏感的化合物的合成。而且L-脯氨酸的用量较小,反应后处理简单,收率很高,产物的顺反选择性也很高。
[1] Barrett A G M, Graboski G G. Conjugated nitroalkenes:Versatitle intermediates in organic synthesis[J].Chem Rev 1986,86(5):751-762.
[2] Barrett A G M. Heterosubstituted nitroalkenes in synthesis[J].Chem Soc Rev,1991,20(1):95-127.
[3] 尤启东,雷兴翰. 共轭硝基烯烃作为合成子的应用[J].中国医药工业杂志,1991,22(2):82-90.
[4] 刘云山,贝浼智,朱惠琴,等. 硝基烯烃化合物在有机合成中的应用[J].化学通报,1993,4:6-12.
[5] Boelle J, Schneider R, Gerardin P,etal. Synthesis and insecticidal evaluation of imidacloprid analogs[J].Pesticide Science,1998,54:304.
[6] Schales O, Graefe H A. Arylnitroalkenes:A new group of antibacterial agents[J].J Am Chem Soc,1952,74(18):4486.
[7] Melton J, McMurry J E. New method for the dehydration of nitro alcohols[J].J Org Chem,1975,40(14):2138-2140.
[8] Ballini R, Castagnani R, Petrini M. Chemoselective synthesis of functionalized conjugated nitroalkenes[J].J Org Chem,1992,57(7):2160-2162.
[9] Stanetty P, Kremslehner M. Synthesis of (E)-nitro olefins by isomerization of (Z)-nitro olefins with polymer supported triphenylphosphine[J].Tetrahedron Lett,1998,39(8):811-812.
[10] Luzzio F A. The Henry reaction:Recent examples[J].Tetrahedron,2001,57(6):915-945.
[11] Ballini R, Bosica G. Nitroaldol reaction in aqueous media:An important improvement of the Henry reaction[J].J Org Chem,1997,62(2):425-427.
[12] Kisanga P B, Verkade J G. P(RNCH2CH2)3N:An efficient promoter for nitroaldol(Henry) reaction[J].J Org Chem,1999,64(12):4298-4303.
[13] Yan S, Gao Y, Xing R,etal. An efficient synthesis of (E)-nitroalkenes catalyzed by recoverable diamino functionalized mesostructued polymers[J].Tetrahedron,2008,64(27):6294-6299.
[14] Demicheli G, Maggi R, Mazzacani A,etal. Supported organic catalysts:Synthesis of (E)-nitrostyrenes from nitroalkanes and aromatic aldehydes over propylamine supported on MCM-41 silica as a reusable catalyst[J].Tetrahedron Lett,2001,42(12):2401-2403.
[15] 4b:1H NMRδ: 6.07(s, 2H), 6.88(d,J=7.8 Hz, 1H), 7.00(s, 1H), 7.08(d,J=7.4 Hz, 1H), 7.48(d,J=13.5 Hz, 1H), 7.93(d,J=13.5 Hz, 1H); IRν: 3 180, 2 920, 1 630, 1 600, 1 495, 1 340, 1 270, 1 100, 1 030, 970, 915, 810 cm-1; EI-MSm/z(%): 193(M+, 100), 150(6), 146(78), 117(11), 89(38), 63(17). 4c:1H NMRδ: 4.02(s, 3H), 7.08(dd,J=7.6 Hz, 7.5 Hz, 1H), 7.19(d,J=8.4 Hz, 1H), 7.49~7.60(m, 1H), 7.74(dd,J=7.7 Hz, 1.4 Hz, 1H), 8.02(d,J=13.6 Hz, 1H), 8.20(d,J=13.6 Hz, 1H); IRν: 3 100, 2 945, 1 625, 1 505, 1 490, 1 340, 1 260, 1 160, 1 020, 965, 745 cm-1; EI-MSm/z(%): 179(M+, 100), 162(35), 131(44), 118(39), 105(19), 91(34), 77(41). 4d:1H NMRδ: 3.87(s, 3H), 6.96(d,J=8.7 Hz, 1H), 7.48~7.55(m, 3H), 7.98(d,J=13.6 Hz, 1H); IRν: 3 150, 2 920, 2 830, 1 630, 1 602, 1 515, 1 340, 1 250, 1 170, 1 040, 960, 730, 705 cm-1; EI-MSm/z(%): 179(M+, 56), 132(100), 121(17), 103(7), 89(30), 77(24). 4e:1H NMRδ: 7.25~7.38(m, 2H), 7.54~7.62(m, 1H), 7.93(d,J=13.4 Hz, 1H), 7.96~8.02(m, 1H), 8.16(s, 1H), 8.40(d,J=13.4 Hz, 1H); IRν: 3 400, 3 100, 2 540, 1 615, 1 475, 1 303, 1 240, 1 175, 925, 800, 745 cm-1; EI-MSm/z(%): 188(M+, 100), 171(8), 145(27), 141(70), 130(13), 115(91) , 104(10), 89(17). 4f:1H NMRδ: 6.88(d,J=8.1 Hz, 1H), 7.01(dd,J=7.5 Hz, 7.4 Hz, 1H), 7.30~7.41(m, 1H), 7.44(d,J=7.6 Hz, 1H), 7.99(d,J=13.6 Hz, 1H), 8.14(d,J=13.6 Hz, 1H); IRν: 3 420, 2 925, 2 850, 1 620, 1 600, 1 495, 1 330, 1 245, 970, 755 cm-1; EI-MSm/z(%): 165(M+, 34), 132(9), 118(100), 90(22), 77(10), 65(17). 4g:1H NMRδ: 6.96(d,J=8.6 Hz, 2H), 7.71(d,J=8.6 Hz, 2H), 7.84(d,J=13.5 Hz, 1H), 8.03(d,J=13.5 Hz, 1H); IRν: 3 365, 3 050, 2 510, 1 598, 1 485, 1 340, 1 255, 1 160, 970, 825 cm-1; EI-MSm/z(%): 165(M+, 67), 148(9), 118(100), 107(15), 91(26), 65(28). 4h:1H NMRδ: 3.90(s, 3H), 6.92(d,J=8.2 Hz, 1H), 7.29(dd,J=8.2 Hz, 1.8 Hz, 1H), 7.45(d,J=1.8 Hz, 1H), 7.89(d,J=13.5 Hz, 1H), 7.99(d,J=13.5 Hz, 1H); IRν: 3 475, 3 050, 2 580, 1 605, 1 520, 1 490, 1 360, 1 295, 1 160, 1 015, 815 cm-1; EI-MSm/z(%): 195(M+, 100), 148(55), 133(28), 105(12), 89(19), 78(11). 4i:1H NMRδ: 1.15(d,J=6.8 Hz, 6H), 2.55~2.75(m, 1H), 7.18(d,J=13.5 Hz, 1H), 7.29(dd,J=13.5 Hz, 7.2 Hz, 1H).5a:1H NMRδ: 2.50(s, 3H), 3.92(s, 3H), 3.94(s, 3H), 6.91~6.98(m, 2H), 7.14(dd,J=8.3 Hz, 1.5 Hz, 1H), 8.07(s, 1H); IRν: 3 128, 2 926, 1 645, 1 600, 1 525, 1 340, 1 284, 1 118, 982, 926, 845 cm-1; EI-MSm/z(%): 223(M+, 100), 224(12), 192(13), 176(75), 161(32), 146(30), 131(37), 91(27).5b:1H NMRδ: 2.46(s, 3H), 6.05(s, 2H), 6.85(d,J=8.1 Hz, 1H), 6.95(s, 1H), 6.98(dd,J=8.1 Hz, 1.0 Hz, 1H), 8.02(s, 1H); IRν: 3 180, 2 920, 1 665, 1 598, 1 525, 1 418, 1 328, 1 260, 1 025, 995, 825 cm-1; EI-MSm/z(%): 207(M+, 67), 103(100), 167(16), 160(73), 159(20), 131(23), 102(50), 77(60).5e:1H NMRδ: 2.54(s, 3H), 7.27~7.38(m, 2H), 7.47(d,J=8.0 Hz, 1H), 7.58(d,J=2.5 Hz, 1H), 7.83(d,J=7.8 Hz, 1H), 8.53(s, 1H), 8.75(d,J=2.4 Hz, 1H); IRν: 3 400, 3 100, 1 630, 1 575, 1 475, 1 322, 1 280, 1 220, 1 105, 965, 750 cm-1; EI-MSm/z(%): 202(M+, 100), 203(15), 157(22), 156(27), 155(79), 145(44),128(63).5g:1H NMRδ: 2.48(s, 3H), 5.70(s, 1H), 6.94(d,J=8.7 Hz, 2H), 7.38(d,J=8.7 Hz, 2H), 8.08(s, 1H); IRν: 3 300, 2 926, 1 650, 1 600, 1 435, 1 288, 1 200, 1 180, 1 190, 988, 835 cm-1; EI-MSm/z(%): 179(M+, 61), 132(100), 133(20), 131(69), 121(33), 115(21).5h:1H NMRδ: 2.47(s, 3H), 3.93(s, 3H), 6.16(s,1H), 6.95(d,J=1.4 Hz, 1H), 6.98(d,J=8.3 Hz, 1H), 7.04(dd,J=8.3 Hz, 1.4 Hz, 1H), 8.04(s, 1H); IRν: 3 525, 1 645, 1 545, 1 500, 1 500, 1 288, 1 178, 1 025, 998, 845 cm-1; EI-MSm/z(%): 209(M+, 100), 210(12), 163(17), 162(89), 147(54), 131(26), 103(82), 91(45).
