毒死蜱对植物胆碱酯酶活性的抑制作用研究
2010-11-20李远平陈华才朱旭华
李远平,陈华才,朱旭华
(中国计量学院生命科学学院,浙江杭州310018)
有机磷和氨基甲酸酯类农药是目前我国广泛使用的主体杀虫剂,由于其脂溶特点,多数情况下性状稳定而不易分解,对环境的污染、农作物中残留及生态产生的影响不容忽视[1].酶抑制法作为农药残留快速检测方法,因其操作简便快速且无须昂贵仪器,因而在农贸市场、超市等现场检测中得到广泛应用[2].动物胆碱酯酶和有机磷水解酶作为酶抑制法的两种酶源都不太适合现场快速检测[3],相对于动物胆碱酯酶和有机磷水解酶而言,植物酯酶具有酶源丰富、取材方便、成本较低、制备简单、保质期长等优点,因此筛选活性高、敏感性好、高效价廉的植物酯酶,优化检测条件,建立快速检测方法具有重要社会及经济价值.林素英等[4]研究多种豆类酯酶表明以绿豆酯酶的总酯酶活力和敏感性为最好,本文以绿豆酯酶为研究对象,优化了其反应条件以及被毒死蜱抑制的检测条件,为绿豆酯酶应用于蔬菜中毒死蜱残留的快速检测奠定基础.
1 仪器与材料
1.1 材 料
绿豆购自杭州下沙物美超市.
1.2 试 剂
冰乙酸 、丙酮、磷酸氢二钠、磷酸二氢钠、α-乙酸萘酯、固蓝B盐均为分析纯;有机磷农药毒死蜱标样(Sigma公司).
1.3 仪 器
T U-1901型紫外可见分光光度计(普析通用仪器有限公司),冷冻离心机,恒温水浴锅,恒温振荡器,电子天平.
2 试验方法
2.1 基本原理
胆碱酯酶催化α-乙酸萘酯水解为 α-萘酚和乙酸,α-萘酚与显色剂固B盐作用形成紫红色的偶氮化合物,测定该物质的吸光度值即可表示酶活性大小.有机磷农药对胆碱酯酶具有抑制作用,如果试样中没有农药残留或者残留量极小,酶的活性不被抑制,α-乙酸萘酯被催化水解,水解产物通过与显色剂作用显色;反之,如果农药残留量较高,酶的活性就会被农药所抑制,水解产物减少或者没有产物生成[5].通过吸光值的变化可表示酶被抑制的程度,进而反映有机磷农药的含量.
2.2 试剂配制
磷酸缓冲液:
A:0.2 mol/L Na2HPO4,准确称取 71.64 g该试剂用蒸馏水定容至1 000 mL
B:0.2 mol/L NaH2PO4,准确称取31.20 g该试剂用蒸馏水定容至1 000 mL
然后根据A,B液的不同比例配置不同pH的磷酸缓冲液.
α-乙酸萘酯溶液 :将125 mg α-乙酸萘酯溶于100 mL无水乙醇.
显色剂:将50 mg固蓝B盐溶于100 mL蒸馏水中.
终止液:30mL冰乙酸加蒸馏水定容至100mL.
有机磷农药标样的制备:取毒死蜱标样储备液(25 mg/mL),准确吸取0.1 mL标准物质,用丙酮稀释并定容至100 mL,质量浓度为25 μ g/mL作为母液.吸取适量的母液,用pH 6.7的缓冲液稀释并定容至100 mL,使农药最终质量浓度分别为0.1,0.2,0.5,0.8,1.0,1.5,2.0 μ g/mL,4 ℃冰箱中保存备用.
2.3 粗酶液制备及粗酶含量测定
发芽24 h的绿豆冰浴研磨后,按1∶5(w/v)加入pH 6.5的0.2 mol/L磷酸缓冲液,40℃,120 r/min条件下振摇2 h,取出迅速过滤,清液以4500 r/min,4℃离心10 min,上清液为粗酶液[6].以牛血清蛋白作标准,用考马斯亮蓝G-250法测定蛋白质含量[7].
2.4 酯酶催化α-乙酸萘酯水解条件优化
2.4.1 最大吸收波长的确定 取1 mL粗酶液加3 mL 0.2 mol/L磷酸盐缓冲液(pH=6.7)和0.1 mL α-乙酸萘酯溶液,40℃反应10 min后加0.6 mL显色剂,显色10 min后加入2 mL终止液并定容至20 mL,室温下400~700 nm范围内扫描其吸光度值,确定最大吸收波长.
2.4.2 粗酶液浓度对水解反应的影响 在上述反应体系中,粗酶液添加量分别为0.05,0.1,0.15,0.2,0.3 mL,考察粗酶液浓度对水解反应的影响.
2.4.3 显色时间与吸光度的关系 在上述反应体系中,分别测定显色1,5,10,15,20 min后的吸光度值.
2.4.4 温度对酶促反应的影响 上述反应体系分别在30℃,35℃,40℃,45℃,50℃恒温水浴下反应10 min,显色10 min后最大吸收波长下测定吸光度值,确定最佳酶促反应温度.
2.4.5 pH对酶促反应的影响 上述反应体系中,缓冲液pH值分别为5.9,6.3,6.7,6.9,7.1,7.5,水解、显色后测定吸光度值,确定反应体系的最佳pH值.
2.4.6 酶促反应时间的确定 上述反应体系中,酶促水解反应时间分别为5,10,15,20 min,显色后测定吸光值,确定最佳酶促反应时间.
2.4.7 农药抑制时间的确定 上述反应体系中,加入1 μ g/mL的毒死蜱农药标样,抑制时间分别为2,4,6,8 min,显色后最大吸收波长处测定吸光度值,确定农药最佳抑制时间.
2.5 农药浓度与抑制率标准曲线的绘制
取7支试管,分别加入3 mL pH 6.7磷酸盐缓冲溶液,1 mL的植物酯酶溶液,1 mL有机磷标准溶液(分别为 0.1,0.2,0.5,0.8,1.0,1.5,2.0 g/mL),40℃下反应2 min后,加入0.1 mL的α-乙酸萘酯溶液,40℃下酶解反应5 min,再加入0.6 mL固蓝B盐溶液,40℃下显色反应10 min后加入2 mL乙酸终止液,定容至20 mL后在520 nm处测得吸光度A,以不加有机磷农药和α-乙酸萘酯溶液为参比.以不加有机磷农药为空白,同上的操作测得A0,按下式计算抑制率:

2.6 灵敏度及检测限的测定
参照薛晓荣方法[8]:取15支试管,分别加入3 mL pH 6.7磷酸盐缓冲溶液,1 mL的植物酯酶溶液,加入0.1 mL的蒸馏水,40℃下恒温水浴5 min,再加入0.6 mL固蓝B盐溶液,40℃下显色反应10 min后加入2 mL终止液,定容至20 mL后在520 nm处测得吸光度A0.
3 结果与分析
3.1 粗酶提取及蛋白质含量测定
绿豆发芽24 h后,去皮,冰浴研磨,0.2 mol/L磷酸缓冲液提取,过滤离心后获得绿豆酯酶粗酶液,粗酶液澄清透明.考马斯亮蓝法测定粗酶液的蛋白质含量为3.44 mg/mL.
3.2 酯酶水解产物吸收曲线
发芽绿豆提取的酯酶液催化α-乙酸萘酯水解,水解产物与固蓝B显色呈紫红色,在400~700 nm范围内的吸收光谱曲线如图1所示,在520 nm处有最大吸收值,无背景干扰,可作为定量分析测量波长.后面的实验都以此最大吸收波长点的吸光度值比较.

图1 显色后反应体系的吸收光谱Figure 1 Absorption spectrum of color reaction system
3.3 粗酶液添加量与吸光度的关系
粗酶液添加量与水解产物吸光度值的关系如图2,吸光度值随着粗酶液的添加量增加而升高,考虑到测量误差和经济性,粗酶液添加量以0.15~0.3 mL(0.52~1.04 mg)较适宜.
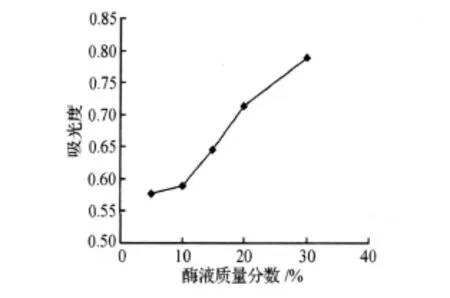
图2 酶液添加量与吸光度的关系Figure 2 Relationship between the enzyme concentration and the absorbance
3.4 显色时间对吸光度的影响
酯酶催化α-乙酸萘酯水解,产物与显色剂反应,生成紫红色偶氮化合物.吸光度与显色时间的关系如图3,显色10min时吸光度最大,达到了0.61,并在随后的5 min之内保持相对稳定,15 min后吸光度急剧下降.因此,样品应在添加显色剂10 min后开始测量吸光度值,并在5 min内测量完毕.
3.5 反应温度对吸光度的影响
反应体系温度与吸光度关系如图4.40℃时,酶活性最强,吸光值最大,以此作为酶促反应和显色温度.

3.6 pH对酶促反应的影响
缓冲溶液的pH值不仅影响酯酶的活性,也影响水解产物与显色剂的显色反应.图5为缓冲溶液pH值与吸光度的关系,pH 6.7时有最大吸光度值.

图5 pH值与吸光度关系Figure 5 Relationship between the pH and the absorbance
3.7 酶促水解反应时间的确定
图6为酯酶催化α-乙酸萘酯水解反应时间与吸光度的关系.由图中可知当酶促反应时间在5 min时吸光值已达到最大值,随着反应时间的延长吸光值保持稳定,因此本反应体系选择以5 min作为酶促反应时间.

图6 酶促反应时间与吸光度关系Figure 6 Relationship between the reaction time and the absorbance
3.8 农药对酯酶抑制时间的确定
图7为农药抑制时间与酶活性抑制率的关系.农药对酯酶的抑制率在2~4 min之内较高,并基本保持稳定.因此,农药对酯酶的抑制时间应控制在2~4 min之内.

图7 农药抑制时间与抑制率的关系Figure 7 Relationship between the time and the enzyme inhibition rate
3.9 毒死蜱对酶的抑制标准曲线
毒死蜱对酯酶活性的抑制率与浓度成线性关系,抑制曲线如图8,毒死蜱的质量浓度在0~2.5 μ g/mL间,线性关系较好,相关系数为0.983 9.因此,在此线性范围内,可以通过酯酶活性抑制率计算出溶液有机磷农药毒死蜱的残留量,并据此建立毒死蜱等有机磷农药快速检测方法.

图8 毒死蜱对酶的抑制曲线Figure 8 Inhibition curve of chlorpyrifos to the enzyme

表1 空白试验结果Table 1 Blank experiment results
3.10 灵敏度和检测限
通过实验我们测得了15个空白样本的吸光度,如表1.灵敏度计算得:

检测限计算得:

4 讨 论
本试验确定了从发芽绿豆中提取的胆碱酯酶液与α-乙酸萘酯进行酶促反应过程中的最大吸收波长为520 nm,粗酶液添加量为0.52 mg,反应时间5 min,显色时间10 min,反应温度 40℃,反应pH为6.7;农药对酯酶的抑制时间为2 min,毒死蜱对绿豆酯酶活性的标准抑制曲线相关系数达到0.983 9,检测灵敏度和检测限分别为0.006 7 μ g/mL和0.08 μ g/mL,应用该植物酯酶检测毒死蜱基本能够满足国家标准对毒死蜱残留限量测定的要求.
研究表明,酶促反应体系的温度以及pH值对结果的影响较大,因此,在整个试验中反应温度应保持在40℃左右,pH值应保持在6.7左右.
固蓝B盐显色液非常不稳定,研究表明在室温下40 min后固蓝B盐显色液显色能力大大下降[6],同时在实验过程中我们发现固蓝B盐显色剂溶液若放置时间过长溶液颜色加深影响实验结果,因此显色液应现配现用.显色反应在10~15 min之间会有一个平台期,吸光度基本变化不大有利于实验数据的测量,因此我们选择显色10 min作为显色时间,并以终止液终止显色反应后测量吸光度.与乙酰胆碱酯酶法相比,本方法在显色后使用终止液有效地提高了测量的准确性.
由于酶是一种生物活性物质,在液体状态下保存极易导致酶失活或引起酶的变性.有研究表明粗酶液在冷藏条件下可以保存1周[9],提取的绿豆酯酶在4℃冰箱中可保存1~2周时间.近年来研究人员利用酶固定化技术解决酶液难以贮藏的问题,许学勤等[10]用离子交换树酯作为固定化载体对小麦酯酶进行了固定化后稳定性有很大的提高.因此下一步的实验工作需对该植物胆碱酯酶的提纯、浓缩条件,酶的稳定性及保存方法作进一步的研究和探讨.
[1]陈如玉,杨华铮,徐本立.农药化学[M].北京:清华大学出版社,2002:1-10.
[2]陈章发,罗赫荣.果蔬中有机磷等化学农药残留的快速检测技术研究与应用[J].湖南农业科学,2000(2):31-32.
[3]SINGH A K,FLOUNDES A W,VOLPONE J V,et al.Development of sensors for direct detection of organophosphates[J].Biosensor&Bioelectronics,1999,14(9):703-713.
[4]林素英,林少琴,王 军,等.豆类酯酶的提取及其在有机磷农药检测中的应用[J].现代农业科学,2008,15(9):14-15.
[5]黄志勇,袁 园,吕禹泽.蔬菜中有机磷农药残留的两种酶抑制快速检测方法的比较研究[J].食品科学,2003,24(8):135-137.
[6]杨 娟.物胆碱酯酶抑制法分析有机磷农药残留的研究[J].黑龙江八一农垦大学学报,2006,18(5):55-58.
[7]邵雪玲,毛 歆,郭一清.生物化学与分子生物学实验指导[M].武汉:武汉大学出版社,2003:32-35.
[8]薛晓荣.最低检出量确定方法的探讨[J].青海环境,2000,10(4):186-188.
[9]于基成,边 辞,赵 娜.抑制法快速检测蔬菜中有机磷农药残留[J].江苏农业科学,2006(5):170-172.
[10]许学勤,徐 斐,华泽钊.用于有机磷农药残留快速检测的固定化小麦酯酶研究[J].食品科学,2003,24(3):122-126.
