贝氏柯克斯体重组膜蛋白抗原激活树突状细胞诱导特异性免疫应答*
2010-11-14
树突状细胞(dendritic cells,DCs)广泛分布于脑以外的全身组织和脏器,数量较少,是人体内功能最强也是唯一能活化静息T细胞的抗原呈递细胞;有不成熟(immature dendritic cells,iDCs)和成熟(mature dendritic cells,mDCs)两个分化阶段。iDCs担负免疫哨兵的职责,密切监控病原的入侵,在感染部位吞噬和处理病原并在病原抗原的刺激下转变为mDCs〔1〕;mDCs在起始免疫中发挥抗原呈递功能,是机体特异性免疫应答的始动者。当iDCs受到外源刺激后会向淋巴结迁移,在此过程中伴随着它功能和表型的成熟,主要体现在细胞表面分子如共刺激分子 CD80、CD40、CD58、CD86 以及成熟标记分子CD83的表达增加和细胞因子分泌的改变〔2〕。
贝氏柯克斯体(Coxiella burnetii,Cb)为Q热的病原体,专性吞噬细胞内寄生,对人和动物的感染性极强,为重要的人兽共患病原体〔3〕。本实验以人源DCs的体外培养体系为模型,用5种Cb重组膜蛋白分别对体外培养的DCs刺激,比较这5种膜蛋白促DCs成熟能力,并用其中促成熟作用最强的SecB蛋白间接刺激T细胞,探讨其诱导细胞免疫应答能力。
1 材料与方法
1.1 试剂 细胞培养液RPMI-1640、胎牛血清购于 Hyclone公司,细胞诱导因子 rhGM-CSF、rhIL-4购于PEPROTECH INC.公司,Ni-NTA Agarose试剂盒购于QIAGEN,蓝菌 素 BFA、鼠 抗 人 CD11c、CD83、CD80、CD40、CD86、CD58、CD54、CD3、CD4、CD8、CD69、IFN-α、IL-12p70、IL-10、IFN-γ、TNF-α、均购于BD公司,淋巴细胞分离液、大肠杆菌LPS、PHA购于Sigma公司,鲎试剂购于北京百星高科技公司。
1.2 重组蛋白 含有CbicmO、enhA、secB、lo1A、htpB基因的重组菌由本室构建〔6〕;培养重组菌并诱导目的蛋白IcmO、EnhA、SecB、Lo1A、HspB表达,集菌后进行蛋白纯化。蛋白纯化过程依据Ni-NTA Agarose试剂盒说明书,概述如下:(1)可溶性表达形式的目的蛋白 IcmO、SecB、HspB的纯化:超声裂解表达目的蛋白的重组菌后,离心收集裂解上清,与Ni-NTA振荡混匀,倒入纯化空柱中,洗涤后,加入洗脱缓冲液,收集洗脱蛋白。(2)包涵体表达形式的目的蛋白EnhA与Lo1A的纯化:超声裂解表达目的蛋白的重组菌后,离心弃上清,加入变性缓冲液B变性蛋白,再次离心收集上清,与Ni-NTA振荡混匀,静置后洗涤混合物2~3次,依次加入含6mol/L至0M尿素的复性缓冲液,复性完成后弃上清,后续步骤同可溶性表达形式的目的蛋白的纯化。纯化的蛋白加入TritonX-114去除 LPS,鲎试剂检测 LPS浓度均低于0.005EU/mL。
1.3 树突状细胞与T细胞 从解放军307医院输血科获得健康人新鲜浓缩白细胞,直接用淋巴细胞分离液从浓缩白细胞中分离出单个核细胞,用含10%小牛血清的RPMI-1640悬浮后按1×106细胞/mL密度铺于12孔板,置于37℃、5%的CO2培养箱中,贴壁2~5h,分别收集悬浮细胞和贴壁细胞。悬浮细胞主要是T细胞,将其冻存,待用时取出。贴壁细胞大部分是单核细胞,含有少量B淋巴细胞。加入培养液RPMI-1640(含10%小牛血清、103U/mL rhGM-CSF、103U/mL rhIL-4)培养分离出单核细胞,将细胞悬液加到12孔板内培养,每孔 1mL;将细胞置 37℃、5%的CO2培养箱培养5d,隔天加入103U/mL rhGM-CSF和103U/mL rhIL-4对细胞进行诱导培养,每3d半量换液1次。
1.4 刺激树突状细胞 分别用纯化的5种蛋白以及大肠杆菌LPS刺激体外培养的DCs,将加入蛋白洗脱液刺激的DCs作为模拟刺激组。其中重组蛋白以20μ g/mL的终浓度刺激DCs,大肠杆菌LPS以6μ g/mL的终浓度刺激DCs。加入刺激物24h后,收集各组细胞做细胞表型分析。实验重复3次。
1.5 树突状细胞与T细胞共培养 将接受SecB蛋白刺激的DCs或其培养上清作为刺激物,将复苏的冻存的同种同体T细胞作为效应细胞,进行共培养,其中调节DCs密度为104/mL,T细胞密度为106/mL,DCs与T细胞的细胞数比例为1∶100,DCs培养上清按100μ L/mL加入。培养12或24h,收获细胞。其中与未受刺激DCs共培养的T细胞作为阴性对照组,与受细胞洗脱液刺激的DCs共培养的 T细胞作为模拟刺激组,以 PHA(10μ g/mL)刺激的 T细胞作为阳性对照组。
1.6 流式细胞仪检测细胞表型 收集各组细胞并制备成单细胞悬液,PBS洗涤细胞2次,500g离心5min,弃上清,调整细胞密度为2×1010个/L,以每测试管50μ L的体积分装,再分别用 CD11c-APC、CD58-FITC、CD80-PE、CD40-FITC、CD83-PE、CD54-PE、CD86-PE荧光抗体对细胞进行标记,置于4℃,避光反应 30min,PBS洗细胞 2次,500g离心 5min,去除上清后每测试管加入500μ L含有1%多聚甲醛的PBS悬浮固定,用FACS-Calibur flow cytometer(Becton Dickinson)流式细胞仪对处理标本进行检测,通过CELLQUEST软件分析细胞表面分子的表达。
1.7 流式细胞仪检测胞内细胞因子表达 诱导培养5d的DCs接受刺激物刺激20h,加入 BFA继续培养4h,细胞因子的分泌被阻断在高尔基体,收集细胞制备成单细胞悬液,用含1%BSA的PBS洗涤细胞2次,500g离心5min,弃上清,调整细胞密度为2×1010个/L,CD11c-APC标记细胞膜分子,室温避光 30min,加入 1mL溶血素,避光,室温放置10min,离心去上清,加入0.5mL破膜剂,再次室温避光放置10min;离心,用含 1%BSA 的PBS洗涤细胞2,加入 IFN-α-PE、IL-12p70-PE、IL-10-PE对胞内相应抗原进行标记,室温避光30min,含1%BSA的PBS洗涤细胞2次,去除上清后加入500μ L PBS重悬细胞,用 FACS-Calibur flow cytometer流式细胞仪对处理标本进行检测,通过CELLQUEST软件分析细胞因子的表达。T细胞接受相应刺激20h,加入BFA继续培养4h,收集细胞,抗体标记步骤同上,所选择的抗体依次是细胞膜分子抗体 CD3-PerCP、CD4-APC、CD8-APC,胞内抗体 IFN-γ-FITC、TNF-α-PE、IL-10-PE。
1.8 流式细胞仪检测T细胞活化 接受相应刺激的T细胞培养12h,收集细胞,对细胞表面分子进行标记,荧光抗体依次 是 CD3-PerCP、CD4-APC、CD8-APC 及 CD69-PE,用FACS-Calibur flow cytometer流式细胞仪对处理标本进行检测,通过CELLQUEST软件分析细胞表面分子的表达。
1.9 统计分析方法 各实验组数据用SAS9.1.3统计软件进行单因素k水平定量资料的方差分析〔4〕。
2 结 果
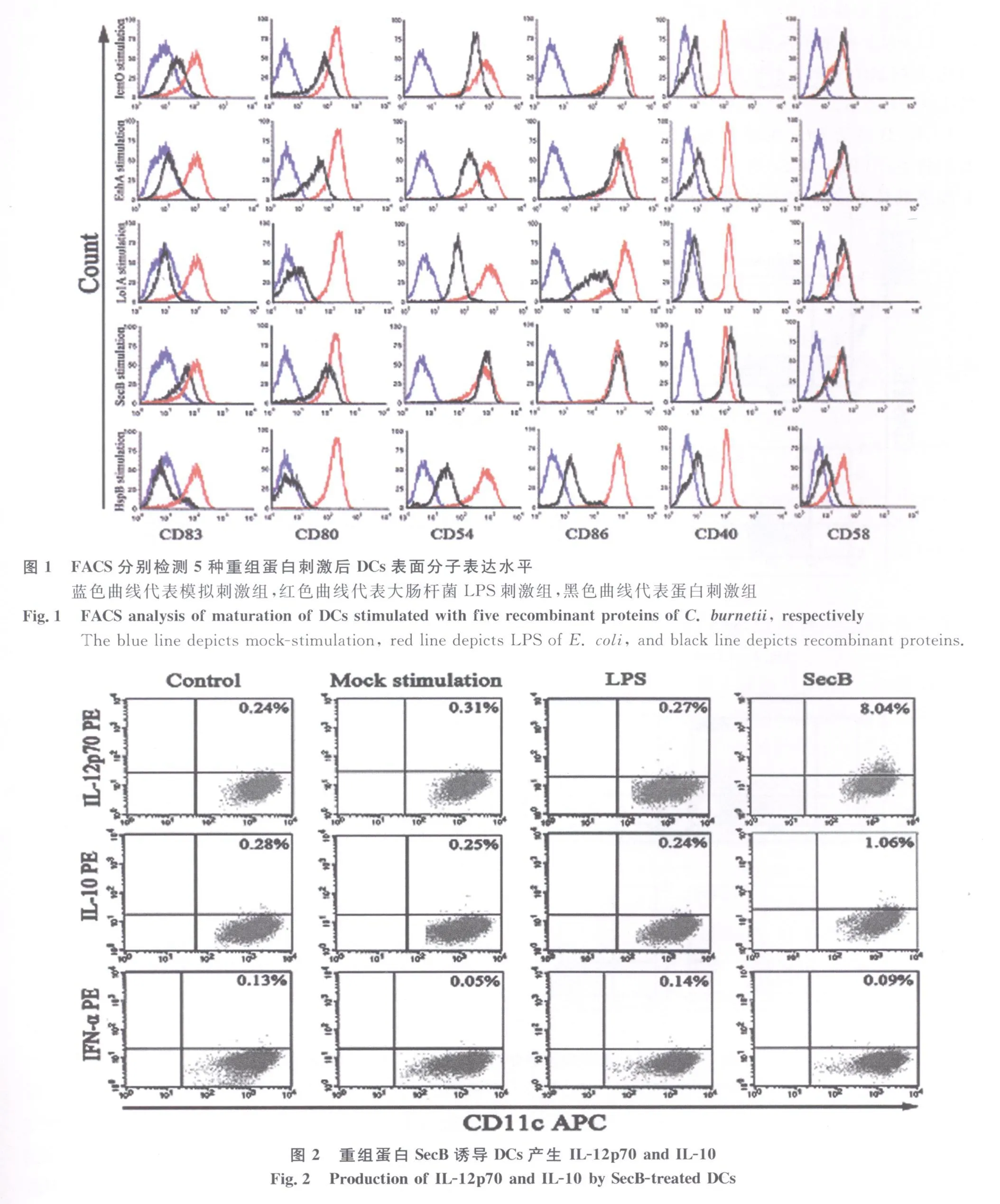
2.1 5种重组蛋白对DCs促成熟作用比较 5种重组蛋白分别刺激体外诱导培养的DCs,刺激24h,以DCs成熟标记分子CD83以及共刺激分子CD54 、CD58、CD80、CD86、CD40的表达来比较 5 种蛋白对DCs促成熟作用的强弱。结果显示SecB的促成熟作用最强,在该蛋白刺激下DCs表面CD40的表达水平超过阳性对照组大肠杆菌LPS的刺激,CD83 、CD54、CD58、CD80、CD86的表达水平与大肠杆菌LPS的刺激不相上下;蛋白 IcmO、EnhA对DCs刺激作用相当,除CD83与CD40的表达水平较低外,其余几种表面分子的表达均得到上调;Lo1A蛋白作用较弱,而促成熟作用最弱的是HspB蛋白,CD83、CD40、CD58、CD80的表达依然维持在基础状态,见图1。
2.2 SecB蛋白刺激DCs的细胞因子检测 上述结果表明SecB蛋白的刺激能够有效地促进DCs表型的成熟,那么成熟的DCs能够分泌何种类型的细胞因子?我们用蓝菌素BFA阻断细胞因子向胞外的分泌,将其截留在细胞内,流式检测证明由SecB刺激成熟的DCs胞内产生I型细胞因子IL-12,见图2。结果同时也发现IL-10的产生,但与IL-12相比,显得微乎其微。多次实验均未检测出IFN-α的分泌。
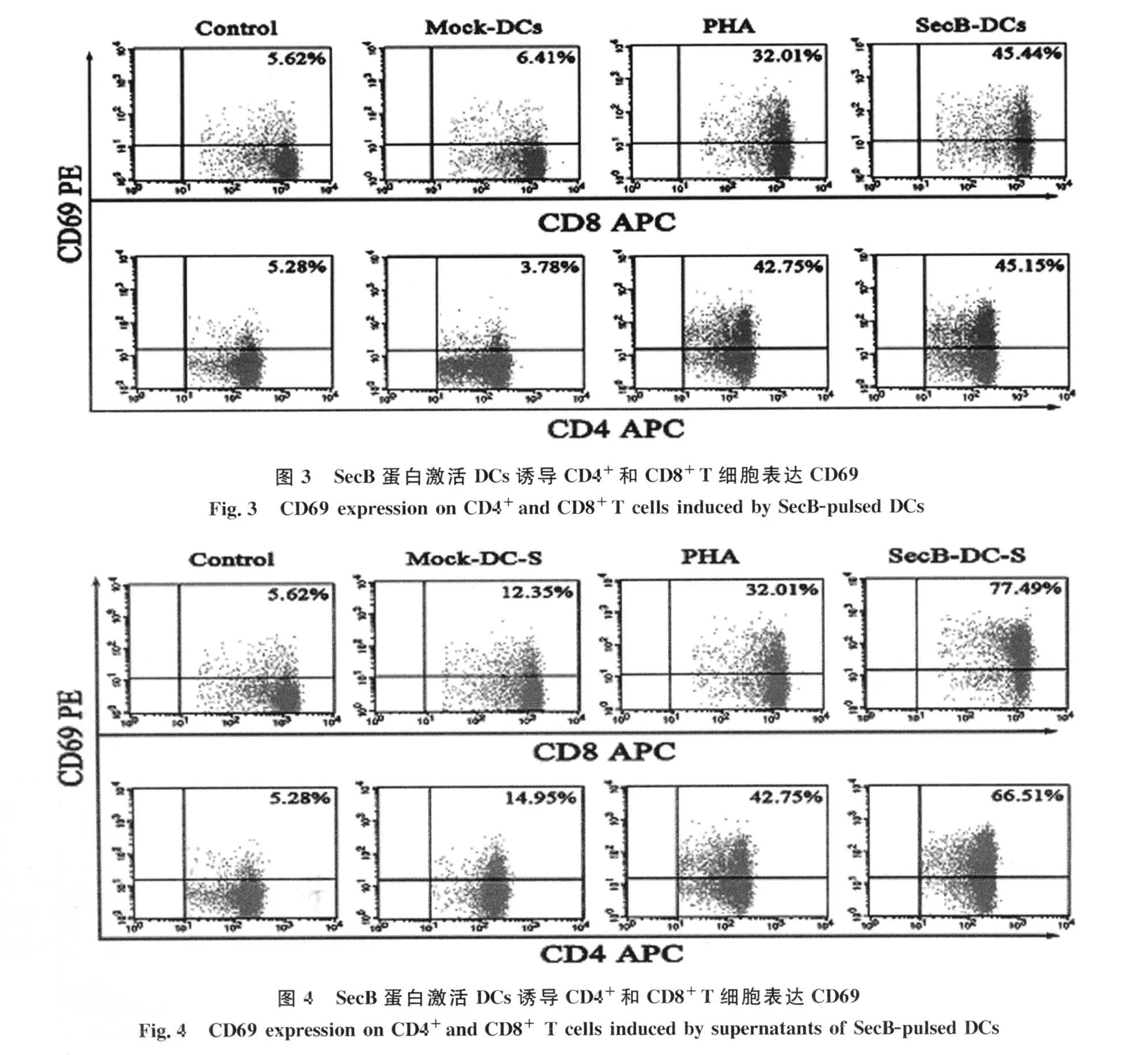
2.3 SecB激活DCs对 T细胞早期活化分析CD69是T淋巴细胞激活后最早表达的表面抗原,当其表达后,可作为共刺激信号促进T细胞进一步活化和增殖〔5-6〕。检测SecB蛋白激活 DCs(SecBDCs)或激活DCs培养上清(SecB-DC-S)刺激的同种同体T细胞,结果显示SecB-DC或SecB-DC-S活化CD4+T细胞和CD8+T细胞的CD69的表达均高于以PHA刺激阳性对照组,见图3、4;SecB-DC-S活化T细胞的CD69水平为SecB-DCs活化T细胞的1.4-1.7倍。
2.4 SecB激活DCs诱导T细胞产生细胞因子我们将SecB-DCs和SecB-DC-S分别与同种同体的T细胞共培养24h,然后分别检测CD4+和CD8+T细胞内的IFN-γ、TNF-α以及IL-10表达水平。结果发现不管是SecB-DCs还是SecB-DC-S刺激,在CD4+和CD8+T细胞内均检测到Th1和Tc1特征性细胞因子IFN-γ,同时也检测到 TNF-α(图5、6),但均未检测出IL-10。SecB-DC-S诱导T细胞产生IFN-γ和 TNF-α能力强于SecB-DCs(图5A 、B);其中SecB-DC-S诱导CD8+T细胞IFN-γ的表达量是CD4+T细胞的1.2倍(图 5B),而 SecB-DC-S诱导CD4+T细胞TNF-α的表达量是CD8+T细胞表达量的3倍(图6B);SecB-DCs诱导CD8+T细胞和CD4+T细胞分泌IFN-γ的能力不分上下(图5A),但诱导CD8+T细胞分泌TNF-α的能力仅为CD4+T细胞的25%(图6A)。
3 讨 论
Cb icmO、enhA、secB、lo1A、htpB基因分别编码Ⅳ分泌系统蛋白IcmO、增强入侵蛋白EnhA、蛋白输出蛋白SecB、外膜脂质载体蛋白Lo1A、热休克蛋白HspB,这5种蛋白在Cb的感染中担负不同的功能。本研究用这5种蛋白分别刺激人源DCs,结果表明它们对DCs的表型促成熟作用存在较大差异。SecB蛋白的促DCs成熟能力最强,能够促进DCs表型完全成熟;而HspB则表现出很弱的刺激能力,仅有限地提高了CD54和CD86的表达。多次重复实验证明DCs受到HspB刺激后表面共刺激分子表达维持在较低水平,而成熟标记分子CD83的表达水平仅与iDCs相似,提示HspB不能诱导DCs成熟。有研究认为只有成熟DCs才能在起始免疫中发挥抗原呈递功能;一旦DCs的成熟环节被阻断或是改变,导致不成熟或不完全成熟DCs的形成,DCs的免疫功能也随之发生变化,参与抑制细胞免疫反应、引发的机体免疫耐受。已有研究证实贝氏柯克斯体强毒株感染DCs能干扰DCs的成熟,达到逃避免疫监控的目的〔7〕,但贝氏柯克斯体弱毒株不具备此功能,具体机制目前并不十分清楚。我们以前的实验已经证实Cb新桥株LPS与灭活新桥株刺激DCs后导致其表型更接近未成熟DCs,而去掉LPS新桥株全菌蛋白的刺激虽然能提高DCs的成熟度但与完全成熟的DCs膜分子的表达水平依然有一定差距〔8〕,这些结果提示了除了贝氏柯克斯体LPS外还有其它蛋白参与 DCs活化的抑制作用。

图5 抗原刺激 DCs诱导T细胞IFN-γ表达A:抗原刺激DCs诱导;B:抗原刺激DCs的培养上清诱导。*与模拟刺激DCs诱导比较,P<0.05Fig.5 IFN-γ expression of T cells induced by antigenpulsed DCsA,Induced by antigen-pulsed DCs;B,Induced by culture supernatant of antigen-pulsed DCs.*Compared by that induced by mock-stimulated DCs,P<0.05.

图6 抗原刺激DCs诱导T细胞TNF-α表达A:抗原刺激DCs诱导;B:抗原刺激DCs的培养上清诱导。*与模拟刺激DCs诱导比较,P<0.05Fig.6 TNF-α expression of T cells induced by antigenpulsed DCsA,Induced by antigen-pulsed DCs;B,Induced by culture supernatant of antigen-pulsed DCs.*Compared with that induced with mock-stimulated DCs,P<0.05.
DCs作为体内唯一能活化初始T细胞的抗原提呈细胞,在提呈抗原之前以未成熟的状态遍布全身各组织器官,一旦iDCs捕获抗原,iDCs可迅速分化为mDCs,细胞表型发生改变,表现为细胞膜上MHC II类分子表达上调,淋巴功能相关抗原CD58、细胞间黏附分子CD54、信号分子CD40、共刺激分子CD80和CD86等T细胞活化辅助分子表达明显增加,并出现 DCs成熟标志 CD83〔2〕。mDCs能抵抗 IL-10的抑制作用,分泌高水平的 IL-12。DCs的成熟对于启动 T细胞免疫至关重要。在DCs活化T细胞的过程中,DCs将通过表面分子的表达与T细胞建立活化信号传导通路:CD58与 T细胞CD2分子相互黏附促进T细胞识别抗原的功能;CD80、CD86与 T细胞CD28结合为 T细胞TCR/CD3活化途径提供重要的协同刺激信号;CD40的表达诱导了 T细胞CD40L(CD154)的表达,而CD40L的表达又进一步刺激DCs上调共刺激分子的表达与 IL-12的分泌,这样不仅延长了DCs的存活时间,又活化了T细胞,并促使T细胞向Th1应答方向发展〔9〕。
SecB蛋白的刺激使DCs表面成熟标记分子CD83以及多种T细胞活化辅助分子、共刺激分子处于高表达状态,其表达水平和E.coliLPS的刺激不相上下。这一结果证明SecB蛋白能够诱导人源DCs表型的成熟,使其具备启动T细胞免疫应答的条件。mDCs在行使抗原呈递功能的同时,通过自身表面多种分子活化 T细胞。作为体内重要的免疫调节细胞,DCs本身还分泌不同的细胞因子参与先天性和获得性免疫应答。因此,本研究进一步对DCs分泌的细胞因子进行了检测,证实SecB在诱导DCs表型成熟的同时也促进了以IL-12为主的细胞因子的表达,提示此时DCs的功能已被激活,具备刺激T细胞增殖、调节T细胞分化、启动细胞免疫应答的功能。
我们以T细胞早期活化标志CD69为检测对象,证明了被SecB刺激成熟的DCs与其培养上清均能活化T细胞,两者刺激T细胞表达CD69的程度高于阳性对照PHA的刺激。同时,DCs培养上清激活T细胞的能力显著强于DCs,说明T细胞的活化与SecB激活DCs分泌的细胞因子密切相关。研究已证明成熟的DCs通过表面粘附分子、MHC/抗原肽段与T细胞相互作用提供自身活化增殖分化的第一信号;通过两者间共刺激因子的相互作用提供自身增殖与分化的第二信号,活化T细胞使其分泌 IL-12、IL-4、IL-6、IFN-γ等细胞因子,进一步诱发自身的增殖与分化;而DCs所分泌的细胞因子(IL-12)则提供了第三信号,是活化 T细胞的增殖与分化必不可少的因素〔10〕。我们已经证明DCs在SecB的刺激下产生以IL-12为主的细胞因子,它的分泌使DCs培养上清具有活化T细胞的功能,其作用强于DCs与T细胞的直接相互作用。mDCs不仅能活化T细胞,更重要的是它们能调节T细胞的分化方向,参与T细胞的免疫应答。本研究结果显示DCs受到SecB刺激后,诱导CD4+和CD8+T细胞表达了Th1与Tc1特征性细胞因子IFN-γ,也表达了对T细胞增殖、对巨噬细胞杀菌活性有促进作用的炎性细胞因子TNF-α。一些研究证明在Cb的感染中IFN-γ和TNF-α有利于机体启动保护性免疫反应,控制Cb在细胞内的繁殖〔11-13〕。因而 IFN-γ和TNF-α的表达表明SecB激活DCs诱发了T细胞向Th1与T c1的分化,引发了特异性细胞免疫应答,有利于吞噬细胞内Cb的清除。我们的研究提示SecB是贝氏柯克斯体潜在保护性抗原,可能诱导机体抗贝氏柯克斯体免疫应答。
〔1〕Steinman RM,Banchereau J.Taking dendritic cells into medicine〔J〕.Nature,2007,449(7161):419-426.
〔2〕Banchereau J,Steinman RM.Dendritic cells and the control of immunity〔J〕.Nature,1998,392(6673):245-252.
〔3〕Marrie T J.Q fever pneumonia〔J〕 .Curr Opin Infect Dis,2004,17(2):137-142.
〔4〕胡良平.口腔医学科研设计与统计分析〔M〕.北京:人民军医出版社,2007:215-220.
〔5〕Bikah G.Pouge-Caley RR,McHeyzer-Williams LJ,et al.Regulating T helper cell immunity through antigen responsiveness and calcium entry〔J〕.Nat Immunol,2000,1(5):402-412.
〔6〕Sancho D,Santis AG,Alonso-Lebrero JL,et al.Functional analysis of ligand-binding and signal transduction domains of CD69 and CD23 C-ty pe lectin leukocyte receptors〔J〕.J Immunol,2000,165(7):3868-3875.
〔7〕Shannon JG,Howe D,Heinzen RA.VirulentCox iella burnetiidoes not activate human dendritic cells:role of lipopolysaccharide as a shielding molecule〔J〕.Proc Natl Acad Sci U S A,2005,102(24):8722-8727.
〔8〕王颖,吴德平,王锡乐,等.贝氏柯克斯体新桥株刺激人树突状细胞的表型分析〔J〕.中国人兽共患病杂志,2009,25(11):1041-1045.
〔9〕Aimanianda V,Haensler J,Lacroix-Desmazes S,et al.Novel cellular and molecular mechanisms of induction of immune responses by aluminum adjuvants〔J〕.Trends Pharm Sci,2009,30:287-295.
〔10〕金伯泉.细胞和分子免疫学〔M〕.北京:科学出版社,2001:495-502.
〔11〕Honstettre A,Ghig o E,Moynault A,et al.Lipopolysaccharide fromCoxiella burnetiiis involved in bacterial phagocytosis,filamentous actin reorganization,and inflammatory responses through T oll-like receptor 4〔J〕.J Immunol,2004,172(6):3695-3703.
〔12〕Shannon JG,Heinzen RA.Adaptive immunity to the obligate intracellular pathogenCoxiella burnetii〔J〕.Immunol Res,2009,43:138-148.
〔13〕Ghigo E,Honstettre A,Capo C,et al.Link between impaired maturation of phagosomes and defectiveCoxiellaburnetiikilling in patients with chronic Q fever〔J〕.J Infect Dis,2004,190:1767-1772.
