蛋清蛋白质降压肽的化学及酶稳定性研究
2010-10-28于志鹏赵文竹于一丁刘博群刘静波
于志鹏,赵文竹,于一丁,刘博群,刘静波*
(吉林大学军需科技学院营养与功能食品研究室,吉林 长春 130062)
蛋清蛋白质降压肽的化学及酶稳定性研究
于志鹏,赵文竹,于一丁,刘博群,刘静波*
(吉林大学军需科技学院营养与功能食品研究室,吉林 长春 130062)
以血管紧张素转化酶抑制活性为指标,通过Plackett-Burman设计研究影响蛋清蛋白质降压肽化学稳定性的因素,同时考察蛋清蛋白质降压肽在模拟胃肠道环境中的抗胃蛋白酶和胰蛋白酶裂解的稳定性。结果表明:pH值、温度、光照、空气、贮藏肽溶液的质量浓度、巴氏灭菌处理、超声波及镁离子等因素对蛋清蛋白质降压肽的化学稳定性影响不显著(P>0.05);蛋清蛋白质降压肽经胃蛋白酶和胰蛋白酶水解后活性由46.0%分别下降为13.0%和4.0%,对胃蛋白酶和胰蛋白酶均没有良好的耐受性。
蛋清蛋白质;肽;稳定性;血管紧张素转化酶
血管紧张素转化酶通过影响肾素-血管紧张素系统和激肽释放酶-激肽系统对人体血压调节有重要的生理作用[1]。研究发现,血管紧张素转化酶抑制肽(降压肽) 是一类具有抑制ACE 活性的物质。随着人们对食品安全问题的高度关注,食源性降压肽成为当前的研究热点。自1965年首次在南美茅头蝮蛇毒液中发现降压肽[2]以来,国内外研究人员已从不同来源的蛋白质中制备出各种具有降压活性的肽类物质[3-8]。但是这些研究主要集中在降压肽的高效分离制备及构效关系的研究上[9-12],而对贮存的环境条件、加工条件和胃肠道酶耐受性等性质对其活性影响却报道很少。由于多肽中的氨基酸组成复杂,且各氨基酸性质不一,这使得其在生产、应用和贮存过程中存在着因脱酰胺、氧化、水解或环化等作用而发生降解的可能,甚至有可能导致活性完全丧失[13]。蛋清降压肽无论是作为功能性食品还是药品,最终都要摄入人体内才能发挥其降低血压的作用。在人体胃肠道复杂的环境下,蛋清降压肽容易受胃蛋白酶及胰蛋白酶的影响,其中高活性肽段的一级结构裂解失活,在体内失去降压活性。因此蛋清降压肽的抗胃肠道酶降解的能力成为一个很值得关注的问题。研究蛋清降压肽活性稳定性对于制定科学的生产工艺和应用方法具有重要的指导意义,为进一步设计具有降压活性的抗酶解活性肽提供理论依据。
本实验在前期蛋清降压肽研究的基础上,对蛋清降压肽的化学稳定性及在体外模拟胃肠道环境中抗胃肠道酶降解的能力进行研究,为蛋清降压肽的工业化生产以及体内功能实验和在小肠内的吸收转运情况提供参考。
1 材料与方法
1.1 材料与试剂
蛋清蛋白粉 吉林金翼蛋品有限公司;血管紧张素转化酶(ACE)、卡托普利(captopriL)、马尿酰组氨酰亮氨酸(HHL)、马尿酸(hippμric acid)、胃蛋白酶和胰蛋白酶 美国Sigma公司;Alcalase 2.4L碱性蛋白酶 丹麦诺维信公司;乙腈(色谱纯) 和三氟乙酸(色谱纯) 天津市博迪化工有限公司,其他试剂均为分析纯。
1.2 仪器与设备
LC-2010高效液相分析仪(紫外检测器、C18色谱柱(250mm×4.6mm,5μm)和LC solution 工作站) 日本岛津公司;超速冷冻离心机 美国Sigma公司;100~1000μL 移液器和10~100μL移液器 Pipette 公司;CS-501型超级恒温水浴锅 上海锦屏仪器有限公司;ZD-2型自动电位滴定仪 上海精密科学仪器有限公司-雷磁仪器厂;AG204型电子天平 瑞士Mettle Toledo公司;HJ-6型多头磁力加热搅拌器 江苏金坛荣华仪器有限公司;B-191喷雾干燥机 瑞士Buchi公司。
1.3 方法
1.3.1 蛋清降压肽的制备
取一定量蛋清蛋白质配制成一定质量浓度的水溶液,置于恒温水浴锅中90℃热变性10min。冷却至酶解温度,用0.5mol/L氢氧化钠溶液调解pH值至酶解条件,加入一定量的碱性蛋白酶进行水解,水解过程中不断搅拌,并不断加入适当质量浓度的氢氧化钠溶液以维持pH值在规定的范围内(±0.05),水解3h后经80℃灭酶10min,9000×g离心10min,喷雾干燥,保存备用。
1.3.2 蛋白质水解度(DH)的测定
采用pH-stat法,参考文献[14]方法进行。
1.3.3 血管紧张素转化酶抑制活性测定
在Cushman等[15]方法基础上进行了一些修改。取30μL HHL底物液,加入10μL抑制剂混合均匀,在(37±0.5)℃ 恒温水浴中预热3~5min,然后加人20μL ACE液充分混合,37℃保温30min后,再加入60μL的1mol/L HCl终止反应,得到反应液。同时用10μL pH8.3的硼酸缓冲液替代抑制剂溶液作为空白对照组。该反应液用0.45μm滤膜过滤后直接用HPLC系统进行分析。色谱条件:柱温25℃,流速0.5mL/min,流动相乙腈-水(0.05% TFA)体积比为25:75等度洗脱,检测波长228nm。ACE抑制活性计算公式如下:

式中:M为空白对照组中马尿酸的峰面积;N为添加抑制剂组中马尿酸的峰面积。
1.3.4 蛋清降压肽化学稳定性研究
影响活性肽稳定性的因素诸多,温度、光照、超声波、湿度、缓冲盐的种类、pH值以及氧气等对活性肽的稳定性都具有不同程度的影响。实验中选定pH值(以磷酸缓冲盐配置)、温度、光照、空气、贮藏肽溶液的质量浓度、巴氏灭菌处理、超声波及镁离子(硫酸镁盐)作为试验因素进行考察。应用Minitab 15.1.0软件对影响蛋清高F值寡肽稳定性的因素进Plackett-Burman设计(因素水平设计见表1)。对可能影响蛋清降压肽化学稳定性的8个主要因素进行筛选,每个变量分别确定(+)和(-)两个水平,以血管紧张素转化酶活性抑制率为指标,共进行12次试验以确定每个因素对蛋清降压肽化学稳定性的影响。

表 1 蛋清降压肽化学稳定性Plackett-Burman设计因素水平表Table 1 Factors and levels for stability of antihypertensive peptides from egg white protein
1.3.5 蛋清降压肽抗酶解研究
在模拟胃肠道环境下,蛋清降压肽还存在活性制约其体内作用的发挥。胃蛋白酶和胰蛋白酶是胃肠道环境中的两种重要肽类水解酶,体外具有活性的肽段容易被胃蛋白酶和胰蛋白酶裂解,使其影响活性的关键氨基酸丢失,造成体外有活性而体内无活性的结果。抗胃蛋白酶和胰蛋白酶裂解能力对蛋清降压肽在体内稳定存在至关重要。因此,实验着重研究了蛋清降压肽的抗胃肠道蛋白酶裂解的能力。实验中按照《中华人民共和国药典》第五部的要求制备人工模拟胃肠液(人工胃液的配制:人工胃液取稀盐酸16.4mL,加水约800mL与胃蛋白酶10g,摇匀后,加水衡释至1000mL;人工肠液的配制:取磷酸二氢钾6.8g,加水500mL使溶解,用0.1moL/L氢氧化钠溶液调节pH值至6.8,取胰蛋白酶10g,加水适量使溶解,将两液混合后,加水稀释至1000mL即得)。取上述配制的人工胃液,人工肠液各10mL配制成10mg/mL的肽溶液,于37℃条件下胃液反应5h,肠液反应4h。反应结束后在100℃加热15min,5000×g,-4 ℃条件下离心5min。按1.3.3节方法进行活性测定。
2 结果与分析
2.1 蛋清降压肽化学稳定性
蛋清降压肽生产和储藏过程中,影响其血管紧张素转化酶抑制活性的因素较多。通过PB设计对可能影响蛋清降压肽活性稳定性的因素进行筛选,结果见表2。利用Minitab 15.1.0软件进行数据处理。

表2 蛋清降压肽化学稳定性Plackett-Burman设计试验结果Table 2 Results of antihypertensive peptide stability determined by Plackett-Burman design
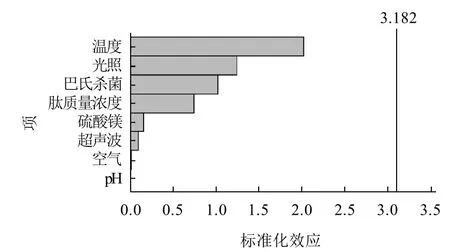
图 1 蛋清蛋白质降压肽的标准化效应Pareto图Fig.1 Standardization effect of antihypertensive peptides from egg white protein

图2 蛋清蛋白质降压肽的标准化效应正态图Fig.2 Normal distribution of standardization effect of antihypertensive peptides from egg white protein
按表2选定的各因素进行试验,取样测定酶活并取3次测量值的平均值分别计算各因素效应及标准化效应分布,结果见图1、2。根据效应和系数估计值中温度、空气、巴氏杀菌和Mg2+的效应和系数均为正值,表明温度、空气、巴氏杀菌和Mg2+为影响蛋清蛋白质降压肽降压活性的正相关因素。但通过标准化效应图来看,所考察的8个因素对蛋清蛋白质降压肽的化学稳定性影响均不显著。
2.2 蛋清降压肽酶稳定性
通过模拟胃肠道环境实验,蛋清蛋白质降压肽经胃蛋白酶和胰蛋白酶处理后,血管紧张素转化酶抑制活性明显下降(表3)。胰蛋白酶水解位点为赖氨酸和精氨酸的羧基端,胃蛋白酶的水解位点为苯丙氨酸、苏氨酸和色氨酸的氨基端,这可能因为具有血管紧张素转化酶抑制活性的肽段经胃蛋白酶或胰蛋白酶水解而失去或部分失去活性。但由于蛋清蛋白质降压肽成分复杂,不能确定经胃蛋白酶和胰蛋白酶处理前后的活性肽结构的变化。

表3 降压肽模拟体内环境处理结果Table 3 Results of antihypertensive peptide stability in mimic gastrointestinal environment
3 结 论
蛋清蛋白质降压肽具有耐热性,在酸性和碱性条件下活性均很稳定,蛋清蛋白质降压肽的血管紧张素转化酶抑制活性受超声、光照和镁离子等因素影响不显著,但其他金属离子对其活性稳定性的影响程度还需进一步深入研究。蛋清蛋白质降压肽对胃蛋白酶和胰蛋白酶的耐受性不强,分别经两种酶处理后降压肽活性明显下降。Miguel等[16]研究表明蛋清胃蛋白酶酶解产物对原发性高血压大鼠(SHR)具有降压作用。Fujita等[17]研究也表明来源蛋清的一种8肽经乳化喂养SHR后,降压效果明显提高,这可能是经乳化的活性肽提高了胃肠道酶的耐受性。
[1] 何瑞荣. 心血管生理学[M]. 北京: 人民卫生出版社,1987: 165-173.
[2] FERREIRA S H. A bradykinin-potentiating factor (bpf) present in the venom of bothrops jararaca[J]. British Journal of Pharmacology, 1965,24(1): 163-169.
[3] AHN J E, PARK S Y, ATWAL A, et al. Angiotensin I-converting enzyme (ACE) inhibitory peptides from whey fermented by Lactobacillus species[J]. Journal of Food Biochemistry, 2009, 33(4): 587-602.
[4] CONTRERAS M D, CARRON R, MONTERO M J, et al. Novel casein-derived peptides with antihypertensive activity[J]. International Dairy Journal, 2009, 19(10): 566-573.
[5] FAN Junfeng, HU Xiaozhong, SZESZE T, et al. Isolation and characterization of a novel angiotensin I-converting enzyme-inhibitory peptide derived from douchi, a traditional Chinese fermented soybean food[J].Journal of the Science of Food and Agriculture, 2009, 89(4): 603-608.
[6] LEE J K, HONG S, JEON J K, et al. Purification and characterization of angiotensin I converting enzyme inhibitory peptides from the rotifer,Brachionus rotundiformis[J]. Bioresour Technol, 2009, 100(21): 5255-5259.
[7] LI Guanhong, WAN Juzhen, LI Guowei, et al. Novel angiotensin I-converting enzyme inhibitory peptides isolated from Alcalase hydrolysate of mung bean protein[J]. Journal of Peptide Science, 2006, 12(8):509-514.
[8] MEGIAS C, PEDROCHE J, YUST M D, et al. Purification of angiotensin converting enzyme inhibitory peptides from sunflower protein hydrolysates by reverse-phase chromatography following affinity purification[J]. Lwt Food Science and Technology, 2009, 42(1): 228-232.
[9] RHO S J, LEE J S, CHUNG Y, et al. Purification and identification of an angiotensin I-converting enzyme inhibitory peptide from fermented soybean extract[J]. Process Biochemistry, 2009, 44(4): 490-493.
[10] SHEIH I C, FANG T J, WU T K. Isolation and characterization of a novel angiotensin I-converting enzyme (ACE) inhibitory peptide from the algae protein waste[J]. Food Chemistry, 2009, 115(1): 279-284.
[11] TOVAR-PEREZ E G, GUERRERO-LEGARRETA I, FARRESGONZALEZ A, et al. Angiotensin I-converting enzyme-inhibitory peptide fractions from albumin 1 and globulin as obtained of amaranth grain[J]. Food Chemistry, 2009, 116(2): 437-444.
[12] WU J P, ALUKO R E, MUIR A D. Production of angiotensin I-converting enzyme inhibitory peptides from defatted canola meal[J]. Bioresource Technology, 2009, 100(21): 5283-5287.
[13] SEWALD N, JAKUBKE H D. Peptides: chemistry and biology[M].Weinheim: Federal Republic of Germany, 2002: 13-14.
[14] 于志鹏, 林松毅, 刘静波, 等. 优化蛋清粉蛋白热变性条件的研究[J].食品科学, 2007, 28(10): 229-232.
[15] CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemical Pharmacology, 1971, 20(7): 1637-1648.
[16] MIGUEL M, RECIO I, GOMEZ-RUIZ J A, et al. Angiotensin I-converting enzyme inhibitory activity of peptides derived from egg white proteins by enzymatic hydrolysis[J]. Journal of Food Protection, 2004, 67(9): 1914-1920.
[17] FUJITA H, SASAKI R, YOSHIKAWA R, et al. Potentiation of the antihypertensive activity of orally, a vasorelaxing peptide derived from ovalbumin, by emulsification in egg phosphatidyl-choline[J]. Bioscience Biotechnology and Biochemistry, 1995, 59(12): 2344-2345.
Stability of Antihypertensive Peptides from Egg White Protein to Chemicals and Enzymes
YU Zhi-peng,ZHAO Wen-zhu,YU Yi-ding,LIU Bo-qun,LIU Jing-bo*
(Laboratory of Nutrition and Functional Food, College of Quartermaster Technology,Jilin University, Changchun 130062, China)
The stability of antihypertensive peptides from egg white protein to chemicals was evaluated by Plackett-Burman design and its stability in mimic gastrointestinal environment was also investigated by determining angiotensin converting enzyme activity. Results indicated that pH, temperature, light illumination, stock peptide concentration, Pasteurization treatment,ultrasonic treatment and magnesium ions had no significant effect on the stability of antihypertensive peptides. However, the stability of antihypertensive peptides was sensitive to pepsin and trypsin. The activity of antihypertensive peptides decreased to 13.0 % and 4.0 % from 46.0 %.
egg white protein;peptide;stability;angiotensin converting enzyme
TS253.1
A
1002-6630(2010)09-0023-04
2009-09-24
国家“863”计划项目(2007AA10Z329)
于志鹏(1984—),男,硕士研究生,研究方向为营养与功能食品。E-mail:yuzhipeng20086@sina.com
刘静波(1962—),女,教授,博士,研究方向为营养与功能食品。E-mail:ljb168@sohu.com
