裂解性福氏志贺氏菌噬菌体SF-A2的生物学特性及其在巴氏杀菌牛奶中的灭菌效果
2010-10-27包红朵
张 辉,王 冉*,包红朵
(江苏省农业科学院 农业部食品安全监控重点开放实验室,江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,江苏省畜禽产品安全性研究重点实验室,江苏 南京 210014)
裂解性福氏志贺氏菌噬菌体SF-A2的生物学特性及其在巴氏杀菌牛奶中的灭菌效果
张 辉,王 冉*,包红朵
(江苏省农业科学院 农业部食品安全监控重点开放实验室,江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地,江苏省畜禽产品安全性研究重点实验室,江苏 南京 210014)
分离裂解性福氏志贺氏菌(Shigella flexneri)噬菌体,鉴定其生物学特性,研究其在巴氏杀菌牛奶的灭菌效果。以福氏志贺氏菌为宿主菌,从污水中分离获得特异性针对福氏志贺氏菌的具有高裂解活性的噬菌体,命名为SF-A2。运用PEG/NaCl法纯化SF-A2,经负染后电镜观察,该噬菌体为肌尾科噬菌体。生物学特性分析表明:该噬菌体特异性针对福氏志贺氏菌,且对温度及pH值具有良好的耐受能力。将SF-A2以高感染复数(103)用于即食性食品(牛奶)中的福氏志贺氏菌的生物防控实验。结果表明:SF-A2能够有效灭菌,在加入48h后,福氏志贺氏菌降低了3lg(CFU/mL);作用至72h,能够完全将福氏志贺氏菌灭活。从而表明,裂解性福氏志贺氏菌噬菌体SF-A2具有良好的杀菌能力,能够在食品中防控福氏志贺氏菌的污染,也为防治由福氏志贺氏菌引起的腹泻性疾病提供生物源性治疗源。
裂解性福氏志贺氏菌;噬菌体;生物防控
志贺氏菌(Shigella)是胃肠疾病感染的主要病原菌之一,能够导致严重的腹泻。2005年,世界卫生组织发布的数据显示,各种腹泻引起的疾病约有8000万例,约70万人死亡[1]。而致病原因主要是由于误食志贺氏菌污染的食品、水所致。志贺氏菌属分4个种,其中福氏志贺氏菌(Shigella flexneri,S. flexneri) 是发展中国家痢疾发病的优势菌[2]。有关资料显示,食品中志贺氏菌污染呈现日益严重趋势,玉溪市餐饮业卫生调查从芫荽中出检出志贺氏菌6型[3];2006年,重庆南川市发生食物中毒事件,其原因是食用福氏志贺氏菌污染的食物所致[4],控制食品中志贺氏菌的污染已刻不容缓。
噬菌体是一类病毒,对一些特定细菌具有高度的专一性,当噬菌体侵染细菌时,可在细菌中繁殖并杀死细菌,但其对动植物或人体本身没有毒性。因此,噬菌体以其特有的自然特征有望成为较理想的抗菌药[5]和新型生物杀菌制剂。目前已有噬菌体用于食品生物防控的报道,如用空肠弯曲菌(Campylobacter jejuni)噬菌体灭活鸡体表的空肠弯曲菌[6];沙门菌噬菌体PHL4用于控制沙门菌在生禽中的污染[7];Guenther等[8]将毒性噬菌体A511和P100混合用于固体和液体食品的杀菌研究,证实其能够有效杀灭和控制即食性食品中的单核细胞增生性李斯特菌(Listeria monocytogenes,Lm)污染;Carcí a等[9]还将金黄色葡萄球菌噬菌体Φ88和Φ35混合后用于控制凝乳加工过程中的金黄色葡萄球菌污染等。目前,美国FDA已批准噬菌体作为食品添加剂用于杀灭食品中的李斯特菌[10]。因此,本研究以引起腹泻的主要病原福氏志贺菌作为宿主菌,分离特异的福氏志贺氏菌噬菌体,初步分析其生物学特性,并在食品中进行噬菌体生物防控研究。
1 材料与方法
1.1 材料、菌种与培养基
巴氏杀菌牛奶 南京卫岗乳业有限公司。
福氏志贺氏菌(CMCC 51572) 广州微生物研究所菌种保藏中心;大肠杆菌(ATCC 25922) 杭州天和微生物试剂有限公司;肠炎沙门氏菌(ATCC 13076)由扬州疾病预防控制中心巢国祥博士惠赠;福氏志贺氏菌分离株由江西省农业科学院曾艳兵惠赠。
营养肉汤、LB培养基 青岛高科园海博生物技术有限公司;NaCl、Tris、氯仿、CaCl2(均为生化试剂)汕头市西陇化工厂有限公司。
1.2 方法
1.2.1 噬菌体分离
污水样取自鲜肉加工车间。将污水用双层滤纸过滤,除去大量杂质;再将滤液用无菌滤器(0.22μm)除菌;取50mL过滤液,同时加入2mL噬菌体宿主菌(CMCC 51572)过夜培养物,然后加入CaCl2溶液(100mmol/L)至终浓度为1mmol/L,混匀,置于室温作用30min,再放置于37℃培养箱培养过夜。次日,取上述培养物以12000r/min离心30min,取上清;12000r/min再次离心20min,取上清并加入数滴氯仿,此即为噬菌体原液。
1.2.2 噬菌体原液单层平板实验
将营养琼脂平板分为2个区域:吸取宿主菌液0.1mL滴于平板正中央,将菌液均匀涂开;待其晾干后,取噬菌体原液0.05mL滴于其中一个区域,并涂布均匀;待晾干后,倒置于37℃温箱培养10h后,观察两个区域的变化。同时以噬菌体原液作对照,以鉴定噬菌体中是否含有宿主菌。
1.2.3 噬菌体双层平板及效价测定
取噬菌体原液0.1mL,进行10倍稀释,取10-4、10-6稀释液各0.1mL与0.1mL宿主菌过夜培养物混匀,室温吸附15min后,加入约5mL 0.7%琼脂的LB培养基,混匀后迅速倾倒入LB平板上,平置5min,37℃培养箱培养,12h后观察噬菌斑形成情况。
1.2.4 噬菌体纯化
在形成噬菌斑的双层平板上挑取形态大小一致的单个噬菌斑,用接种针穿刺目的噬菌斑,将穿刺后接种针伸入3~5mL LB培养基中,重复3~5次后,加入噬菌体宿主菌液0.1mL,混匀,室温作用15min,37℃培养10~14h,4℃、12000r/min离心20min,取上清,同时加入0.1mL氯仿,室温作用20min,无菌过滤上清,同1.2.3节方法测定纯化噬菌体的效价。将纯化的噬菌体悬液经PEG/NaCl处理后[11],4℃、12000r/min离心40min,取上清,用1L的SM(sodium-magnesium)溶液(NaCl 100mmol/L、MgSO4·7H2O 10mmol/L、Tris-HCl(pH7.5) 0.05mol/L)溶解沉淀,即为浓缩液。
1.2.5 噬菌体电镜观察
取纯化的噬菌体浓缩液0.01mL,以2%磷钨酸(pH7.0)进行负染色5~10min,通过透射电镜进行观察。
1.2.6 噬菌体感染复数(multiplicity of infection,MOI)
将宿主菌培养至对数生长期,测定OD600nm,并以此将其浓度调整为2×107CFU/mL,按照不同MOI加入噬菌体和宿主菌的比例分别为100:1、10:1、1:1、1:10、1:100、1:1000,加入液体培养基调整每管总体积相同,37℃、150r/min培养4h后,再经10000r/min离心10min,取上清液测其效价,每个MOI均作2~3个重复。以产生最高噬菌体效价的MOI为最佳MOI。
1.2.7 噬菌体一步生长曲线实验
方法详见参考文献[12]。
1.2.8 噬菌体热稳定性和pH值稳定性的测定
取0.1mL 1×108PFU/mL 纯化噬菌体分别于40~90℃水浴作用30min和1h,并立即将样品冰浴冷却后测其效价;分别取pH4.0~10.0的蛋白胨水和2×109PFU/mL纯化噬菌体等量混合,37℃水浴作用2h后测其效价。
1.2.9 噬菌体宿主谱分析
分别取0.1mL 105、106纯化噬菌体稀释液与大肠杆菌、肠炎沙门氏菌和福氏志贺氏菌分离株各0.1mL混匀,室温放置15min后,上层加入含0.7%琼脂的LB培养基约5mL,将该混合液迅速倾倒入下层LB培养基平板上,37℃温箱培养10~12h后观察噬菌斑形成情况。
1.2.10 噬菌体SF-A2在食品中的灭菌实验
将宿主菌静置过夜培养,次日测定其OD600nm,用SM溶液将其浓度调整为5×105CFU/mL。设A组为实验组:分别取100μL菌液加入5mL巴氏杀菌牛奶中,同时加入100μL(用SM调整至5×108PFU/mL)纯化的SF-A2噬菌体稀释液,将其充分混匀;B组为对照组:取100μL菌液加入5mL巴氏杀菌牛奶中,不加噬菌体;C组为空白对照:取100μL SM加入5mL巴氏杀菌牛奶中,不加噬菌体;以上3组接种后室温作用15min立即置于4℃,分别于0、2、24、48h和72h检测噬菌体的灭菌效果。
2 结果与分析
2.1 福氏志贺氏菌噬菌体的分离、鉴定及效价测定结果
在单层平板实验中,涂有噬菌体原液的区域没有细菌生长,而涂宿主菌液未涂噬菌体原液的区域有细菌生长。从而说明,噬菌体原液中可能含有对福氏志贺氏菌特异的噬菌体,且效价较高。将噬菌体原液进行倍比稀释后,进行双层平板实验,次日,平板中有噬菌斑形成(图1)。计数10-6稀释液平板中的噬菌斑,计算得出此噬菌体原液的效价为2.1×109PFU/mL。将双层平板中大小一致的噬菌斑进行进一步纯化,并进行进一步的效价测定。结果纯化的噬菌体效价为3.0×109PFU/mL,再经PEG/NaCl法沉淀后,其效价为7.5×1010PFU/mL,有利于进一步实验的进行。
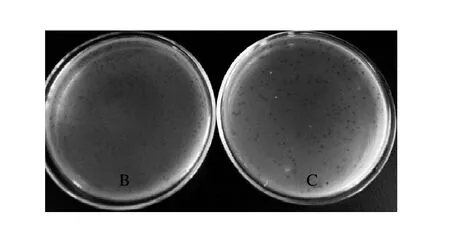
图1 噬菌体双层平板检测结果Fig.1 Phage test results using double layer agar medium plate
2.2 噬菌体电镜观察结果
透射电镜观察纯化的噬菌体浓缩液,结果见图2。该噬菌体有立体对称的头部,直径约为44.4nm,具有可伸缩性尾,尾长约168.9nm(尾部在制备过程中有部分脱落)。按照国际病毒分类委员会(International Committee on Taxonomy of Viruses,ICTV)分类规则,将该噬菌体归类为肌尾病毒科,并命名为SF-A2。
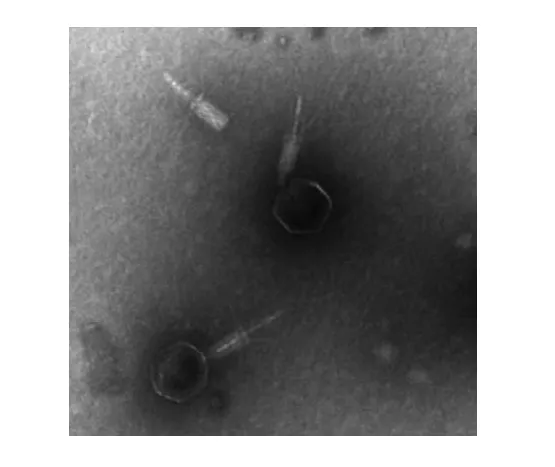
图2 福氏志贺氏菌噬菌体SF-A2电镜图Fig.2 Electron micrograph of S. flexneri phage SF-A2
2.3 噬菌体最佳MOI

表1 福氏志贺氏菌噬菌体最佳MOI测定结果Table 1 Determination of optimal multiplicity of infection (MOI)
由表1可知,当MOI为10:1和1:1时,噬菌体效价分别为2.84×109PFU/mL和1.73×109PFU/mL,产生的子代噬菌体数量较高,因此噬菌体扩增应选择MOI为10:1时最佳。
2.4 噬菌体一步生长曲线
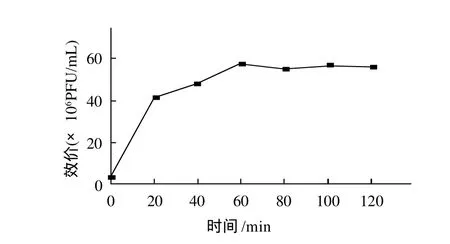
图3 噬菌体SF-A2一步生长曲线Fig.3 One-step growth curve of phage SF-A2
由图3可见,福氏志贺氏菌噬菌体SF-A2感染宿主菌的潜伏期约为10min,平均裂解量为53.5(裂解量=爆发期噬菌体滴度/感染初期宿主菌浓度),具有高裂解活性。
2.5 噬菌体热稳定性和pH值稳定性

图4 温度和pH值对噬菌体活性的影响Fig.4 Effect of temperature and pH on the activity of phage SF-A2
如图4a所示,噬菌体在40℃和50℃分别作用30min和60min后,其活性无明显变化;60℃作用1h,活性有所降低;70℃作用后,效价降低至初始效价的50%以下;至9 0℃,几乎失活。如图4b所示,噬菌体在pH5.0~9.0内,其效价均在109PFU/mL以上,其活性无明显变化;当pH4.0时,其效价降至108PFU/mL;pH10.0时,其效价迅速降低,表明SF-A2对酸和碱有一定的耐受力。
2.6 噬菌体宽噬实验
大肠杆菌及沙门氏菌在双层平板上层培养基生长均匀,无噬菌斑形成,而福氏志贺氏菌分离株中有噬菌斑,说明分离的噬菌体对福氏志贺氏菌特异。
2.7 噬菌体在巴氏杀菌牛奶中的灭菌效果

图5 噬菌体SF-A2在巴氏杀菌牛奶中的灭菌效果Fig.5 Inactivation of S. flexneri in milk by phage SF-A2
将噬菌体以较高MOI(103)用于巴氏杀菌牛奶灭菌,结果如图5所示,在室温吸附15min后,立即测定不同组的宿主菌数量,结果在0h,加入噬菌体组的宿主菌数量有所下降;作用2h后,再进行检测,实验组中宿主菌与对照组相比较显著下降(约下降2lg(CFU/mL));24h后,对照组宿主菌数量无显著变化,但实验组仍有减少;至48h,实验组与对照组相比较,宿主菌数量下降约3lg(CFU/mL);至72h,实验组中已检测不到宿主菌,而对照组宿主菌中数量仍持续在起始水平。SM对照组在实验始末均未检测到宿主菌及噬菌体。
3 讨 论
志贺氏菌是重要的食源性病原菌之一,可以通过粪-口传染、也可通过污染的食物、水等传播。目前,临床上主要以抗菌药物和补液治疗痢疾,但由于志贺氏菌对抗生素日趋耐药,严重影响了治疗效果。噬菌体用于食品生物防控和治疗已成为目前的研究热点。噬菌体广泛存在于自然界中,其多样性尤其惊人,在生物圈中其数量达1031之巨[13]。与传统的抗生素相比较,噬菌体具有特异杀菌、不产生抗性等特点。因此,本研究分析了分离获得的福氏志贺氏菌噬菌体SF-A2的基本生物学特性,并将其应用于即食性食品,进行噬菌体杀菌效果研究。
本研究中所分离的噬菌体SF-A2特异性针对福氏志贺菌2a血清型,宿主谱较窄[14],为裂解性噬菌体。且当Ca2+浓度为1mmol/L时,噬菌体对宿主吸附能力最佳[15],效价可达109~1010PFU/mL。当噬菌体与宿主菌以MOI为10:1接种时,效价较高,为制备噬菌体源提供了必要的前提。在一步生长曲线中可以看出,噬菌体SF-A2潜伏期较短,而在大肠杆菌噬菌体研究中潜伏期平均为25~27min[16],同样黏质沙雷氏菌裂解性噬菌体的潜伏期也为30min[15],而本研究中噬菌体SF-A2的潜伏期较短,约为10min。此外,电镜观察显示,该噬菌体为肌尾噬菌体,为双链DNA[14],具有传统裂解性噬菌体生物学特性。
噬菌体用于食品生物防控已有报道,噬菌体SF-A2对温度及pH值具有一定的耐受能力,而通常即食性食品的pH值中性偏酸,因此,SF-A2对酸的耐受有利于在食品杀菌过程中保持必要的活性。对牛奶中福氏志贺氏菌的杀菌效果表明,SF-A2能够有效灭菌,在作用48h后,宿主菌减少了3lg(CFU/mL),而在72h,已检测不到宿主菌。这一结果表明,噬菌体SF-A2具有良好的杀菌效力,且在作用72h后噬菌体数量仍持续在107PFU/mL(数据未显示)。综上所述,本实验所分离噬菌体用于生物防控是切实可行的,其高效杀菌以及无毒副作用的前提将优于其他化学制品。噬菌体用于控制食品中食源性病原污染的研究屡见不鲜,如在大肠杆菌O157[17]、沙门氏菌[18]等,然而目前未见志贺氏菌噬菌体用于食品生物防控的报道,因此本研究将为今后噬菌体作为食品添加成分用于食品生物防控杀菌制剂的开发提供有力的实验依据。目前,荷兰已有商品化噬菌体产品LISTEXTM P100作为食品中的生物杀菌剂,且FDA已批准噬菌体有机制应用于食品,美国农业部还批准Omnilytics公司生产的以噬菌体为主的杀菌剂用于杀灭宰前动物中污染的大肠杆菌O157:H7及沙门氏菌等,因此,噬菌体作为新型食品生物防控制剂具有广阔的开发和应用前景。
[1]World Health Organization. Guidelines for the control of shigellosis,including epidemics due toShigella dysenteriaetype 1[R]. Geneva:WHO, 2005.
[2]von SEIDLEIN L, KIM D R, ALI M, et al. A multicentre study ofShigella diarrhoeain six Asian countries: disease burden, clinical manifestations, and microbiology[J]. PLos Med, 2006, 3(9): 1556-1569.
[3]向正华, 林党柒, 陈娟, 等. 玉溪市中心城区餐饮业卫生善调查[J].职业与健康, 2008, 24(8): 749-750.
[4]易娟, 赵寒, 娄静梅. 一起学校细菌性痢疾爆发的流行病学调查[J].中国学校卫生, 2007, 28(9): 850.
[5]UGORCAKOVA J, BUKOVSKA G. Lysins and holins: Tools of phageinduced lysis[J]. Biologia (Bratislava), 2003, 58: 327-334.
[6]WAGENAAR J A, van BERGEN M A, MUELLER M A, et al. Phage therapy reducesCampylobacter jejunicolonization in broilers[J]. Vet Microbiol, 2005, 109(3/4): 275-283.
[7]HIGGINS J P, HIGGINS S E, GUENTHER K L, et al. Use of a specific bacteriophage treatment to reduceSalmonellain poultry products[J].Poult Sci, 2005, 84(7): 1141-1145.
[8]GUENTHER S, HUWYLER D, RICHARD S, et al. Virulent bacteriphage for efficient biocontrol ofListeria monocytogenesin readyto-eat foods[J]. Appl Environ Microbiol, 2009, 75(1): 93-100.
[9]CARCIA P, MADERA C, MARTINEZ B, et al. Biocontrol ofStaphylococcus aureusin curd manufacturing processes using bacteriophages[J]. Int Dairy J, 2007, 17(10): 1232-1239.
[10]DANIELLS S. FDA approves viruses as food additive for meats[EB/OL]. (2006-08-23) [2010-08-20]. http://www.foodnavigator-usa.com/Financial-Industry/FDA-approves-viruses-as-food-additive-for-meats.
[11]萨姆布鲁克 J, 拉塞尔D W. 分子克隆实验指南[M]. 3版. 北京: 科学出版社, 2002: 185-187.
[12]LU Z, BREIDT F, FLEMING H P, et al. Isolation and characterization of aLactobacillus plantarumbacteriophage, ΦJL-1, from a cucumber fermentation[J]. Int J Food Microbiol, 2003, 84(2): 225-235.
[13]HENDRIX R W. Bacteriophage genomics[J]. Curr Opin Microbiol,2003, 6(5): 506-511.
[14]FARUGUE S M, CHOWDHURY N, KHAN R, et al.Shigella dysenteriaetype 1-specific bacteriophage from environmental waters in bangladesh[J]. Appl Environ Microbiol, 2003, 69(2): 7028-7031.
[15]于龙, 温占波, 杨文慧, 等. 一株粘质沙雷氏菌烈性噬菌体污水分离及特性[J]. 微生物学报, 2008, 48(4): 498-502.
[16]张培东, 孙岩, 任慧英, 等. 大肠杆菌噬菌体的分离及其生物学特性[J]. 中国兽医杂志, 2008, 44(4): 10-12.
[17]ABULADZE T, LI Manrong, MENETREZ M Y, et al. Bacteriophages reduce experimental contamination of hard surfaces, tomato, spinach,broccoli, and ground beef byEscherichia coliO157:H7[J]. Appl Environ Microbiol, 2008, 74(20): 6230-6238.
[18]LEVERENTZ B, CONWAY W S, JANISIEWICZ W, et al. Biocontrol of the food-borne pathogensListeria monocytogenesandSalmonella entericaserovar Poona on fresh-cut apples with naturally occurring bacterial and yeast antagonists[J]. Appl Environ Microbiol, 2006, 72(2):1135-1140.
Biological Characteristics of Lytic SF-A2 Phage and Its Sterilization Effect in Milk
ZHANG Hui,WANG Ran*,BAO Hong-duo
(Key Laboratory of Agro-Food Safety and Quality, Ministry of Agriculture, Key Laboratory of Food Quality and Safety of Jiangsu Province-State Key Laboratory Breeding Base, Key Laboratory of Animal-derived Food Safety of Jiangsu Province, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
In order to analyze biological characteristics ofShigella flexneri(S. flexneri) phage and its sterilization effect in milk,the lyticS. flexneriphage SF-A2 was isolated from sewage. Electron microscope observation showed that purified phage SF-A2 was a member of family Myoviridae. Based on its biological characteristic assay, phage SF-A2 exhibited the tolerance to temperature and pH. In addition, phage SF-A2 could effectively inactivateS. flexneri. After adding phage SF-A2 for 48 h, the concentration ofS. flexneriwas reduced by 103 folds compared with the host control. After 72 h incubation, the concentration ofS. flexneriwas declined to the limit of detection. Therefore, SF-A2 is a virulent bacteriophage and can effectively inactivateS. flexneriin ready-to-eat milk. It will be a good biological control agent for food safety and also an efficient antimicrobial source for diarrhea.
Shigella flexneri;bacteriophage;biological control
TS201.3; Q939.48
A
1002-6630(2010)23-0214-05
2010-09-19
江苏省自然科学基金项目(BK2009328);江苏省农业科技自主创新项目(cx(10)438)
张辉(1978—),女,助理研究员,博士,主要从事食源性病原菌的监测及生物防控研究。E-mail:HZ581200@yahoo.com.cn
*通信作者:王冉(1973—),女,副研究员,博士,主要从事畜禽产品安全及监控研究。E-mail:wangran2001@126.com
