米氏凯伦藻对褶皱臂尾轮虫、卤虫和黑褐新糠虾存活的影响
2010-10-23周名江何建宗
孙 科, 颜 天, 周名江, 何建宗
(1. 中国科学院 海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071; 2. 中国科学院研究生院,北京 100039; 3. 香港公开大学 科技学院, 香港 999077)
米氏凯伦藻对褶皱臂尾轮虫、卤虫和黑褐新糠虾存活的影响
孙 科1,2, 颜 天1, 周名江1, 何建宗3
(1. 中国科学院 海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071; 2. 中国科学院研究生院,北京 100039; 3. 香港公开大学 科技学院, 香港 999077)
初步研究了一株米氏凯伦藻对褶皱臂尾轮虫(Brachionus plicatilis)、卤虫(Artemia salina)幼体和黑褐新糠虾(Neomysis awatschensis)的毒性效应和机制。研究发现米氏凯伦藻(Karenia mikimotoi)在较低密度下就能明显减少轮虫的种群数量, 24 h EC50仅为20个/mL左右; 该藻的各组分毒性比较结果显示,只有藻液和细胞重悬液有这种毒害作用, 而去藻过滤液和藻细胞破碎液的影响不明显, 表明这种毒害作用可能是由于活的藻细胞引起的; 在米氏凯伦藻中卤虫和黑褐新糠虾的存活数量也明显下降。结果表明, 米氏凯伦藻赤潮可能通过直接影响存活从而对浮游动物产生影响。
米氏凯伦藻(Karenia mikimotoi); 褶皱臂尾轮虫(Brachionus plicatilis); 卤虫(Artemia salina);黑褐新糠虾(Neomysis awatschensis); 种群数量; 存活
凯伦藻(Karenia sp.)作为一种世界广布种, 在全球范围内多个沿海国家形成过赤潮[1], 该藻引发的鱼毒性赤潮常常导致大量鱼类和底栖生物的死亡[2~4]。在我国, 凯伦藻赤潮的发生呈现出由南向北不断扩大的趋势[5~7], 其中两次较为严重的凯伦藻赤潮分别发生在1998年的香港海域和2005年的浙江沿海, 分别给海水养殖业造成了3.5亿元和2000万元的直接经济损失[7,8]。除能够对鱼类、贝类等较大生物产生危害, 米氏凯伦藻赤潮还能对中华哲水蚤等浮游动物产生不利影响[9]。
海洋浮游动物能够摄食浮游植物, 又能够被更高营养级的海洋生物所摄食, 它们在生态系统中起着承上启下的重要作用, 可见, 赤潮对浮游动物的影响将会间接扩大为对整个海洋生态系统的影响,且赤潮藻能够通过多种方式与机制对浮游动物造成影响[10]。因此, 开展米氏凯伦藻(Karenia mikimotoi)对海洋浮游动物影响的研究具有重要的意义。轮虫个体小, 生命周期短, 实验室易培养; 卤虫卵可以在实验室内进行孵化而得到大量的均匀个体, 且它们可以直接滤食和接触有害藻; 黑褐新糠虾(Neomysis awatschensis)是广泛分布于我国沿海的一种小型甲壳生物。近年来, 轮虫、卤虫和黑褐新糠虾已被广泛应用于有害赤潮藻的毒性研究中[11~20]。因此, 作者以褶皱臂尾轮虫(Brachionus plicatilis)、卤虫(Artemia salina)幼体、黑褐新糠虾模拟不同大小的海洋浮游动物, 针对米氏凯伦藻对其种群数量和存活的影响进行了实验研究, 并初步分析了米氏凯伦藻赤潮对浮游动物的危害机制。
1 材料与方法
1.1 材料
供试褶皱臂尾轮虫由中国科学院海洋研究所培养中心提供, 为实验室常年培养种。实验用卤虫幼体为低温保藏卤虫卵经海水孵化得到的无节幼体(instarⅡ-), Ⅲ卤虫卵产自青海尕海湖。黑褐新糠虾于1995年采集自胶州湾西海岸, 在中国科学院海洋研究所进行了多年多代连续培养。
实验所用的米氏凯伦藻分离于南海, 由暨南大学提供。实验用藻使用3 L锥形瓶以f/2培养液纯种培养, 培养温度(20±1), ℃光暗比为14L∶10D。小球藻(Chlorella sp.)由中国科学院海洋研究所藻种中心提供, 以小球藻培养液培养, 培养温度(20±1), ℃光暗比12L∶12D。糠虾实验海水取自青岛胶州湾外太平角无污染海水, 使用前经沉淀沙滤, 用于藻类培养与轮虫、卤虫实验的海水经 0.45 μm混合纤维滤膜过滤和高温灭菌, 盐度用ATAGO手提式盐度计测定, 通过加蒸馏水来调节。
1.2 方法
1.2.1 米氏凯伦藻对轮虫的影响实验
轮虫实验容器为50 mL烧杯, 实验体积为30 mL,实验温度为(20±1)℃, 实验中盐度调节至31±1。取指数生长中期的米氏凯伦藻用0.5 mL计数框计数后以海水稀释, 使实验液藻细胞密度分别达到5、10、20、40、80个/mL, 实验前轮虫饥饿12 h, 之后用80 μm筛绢浓缩并以藻培养液和海水稀释, 使轮虫最终密度为10个/mL。以投喂小球藻(投喂小球藻终密度约为 104个/mL) 为对照, 另设以消毒海水为实验液的饥饿组, 每组3个平行, 24 h记录轮虫存活数量。
1.2.2 米氏凯伦藻不同组分对轮虫的影响实验
(1)藻培养液: 取指数生长中期米氏凯伦藻, 用0.5 mL计数框计数。(2)藻细胞重悬液:将藻培养液经10μm筛绢过滤浓缩后, 用海水将藻细胞重新悬浮。(3)藻培养液过滤液:将(2)中过滤液再经双层滤纸过滤, 镜检无藻细胞。(4)藻细胞破碎液:将(2)中的藻细胞重悬液混匀, 超声波细胞粉碎机将藻细胞打碎。将以上新鲜制备的各种组分以海水稀释到藻细胞密度是或相当于 1 000个/mL, 以投喂小球藻(密度约为104个/mL)为对照, 另设以消毒海水为实验液的饥饿组, 每组3个平行, 24 h记录轮虫种群数量。
1.2.3 米氏凯伦藻对卤虫存活的影响实验
卤虫实验容器为12孔板, 实验体积为5 mL, 实验温度为(20±1), ℃盐度为31±1。取指数生长中期米氏凯伦藻用0.5 mL计数框计数后以海水稀释, 使藻细胞密度分别达 100、200、500、1 000、2 000、5 000、10 000、15 000个/mL, 分别加至12孔板中, 每孔放入大小较为均一的卤虫无节幼体10尾。对照组投喂处于指数增长期的小球藻(密度为 106个/mL), 以海水为饥饿组, 每组3个平行。每隔24 h观察记录各组中卤虫存活数(以解剖针触动卤虫, 5 s内触角不动作为死亡标准), 加入适量蒸馏水调节盐度, 48 h更换实验液, 实验进行96 h。
1.2.4 米氏凯伦藻对黑褐新糠虾存活的影响实验
黑褐新糠虾实验容器为500 mL烧杯, 实验体积为400 mL, 实验温度为(20±1),℃ 盐度为31±1, 取指数生长中期米氏凯伦藻用0.5 mL计数框计数后以海水稀释, 使藻细胞密度分别达到 2 000、5 000、10 000、15 000个/mL。选取(5±1)日龄健康活泼幼虾随机放入配制好的实验液中, 每杯10尾。以海水作为对照, 每组3个平行。每24 h投喂适量卤虫幼体, 吸取死虾和杯底污物, 并记录糠虾的存活数, 每48 h换一次处理液, 实验共进行16 d。
1.3 数据处理
使用Excel中的STDEV以及TTEST等函数进行数据处理和统计分析。
2 结果
2.1 米氏凯伦藻对轮虫种群数量的影响
米氏凯伦藻对褶皱臂尾轮虫种群数量的影响如图1所示。24 h时, 对照组的轮虫种群数量有所增加,饥饿组中轮虫种群数量仍维持在起始状态。其他各密度组的轮虫种群数量均有一定程度的下降, 而且随着米氏凯伦藻藻细胞密度升高, 轮虫种群数量降低程度越明显, 至 20个/mL时, 轮虫种群数量与饥饿组有显著差异(P<0.05), 当藻细胞密度达到40个/mL和80个/mL时, 轮虫种群数量与饥饿组有极显著差异(P<0.01)。米氏凯伦藻对轮虫的24 h EC50约为 20个/mL。由实验结果可见, 米氏凯伦藻藻细胞对轮虫具有很强的毒性作用。
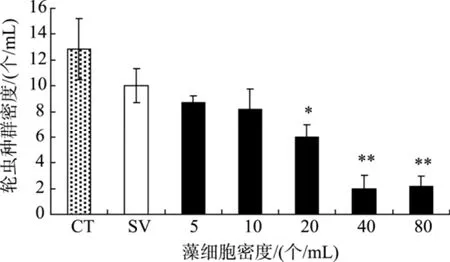
图 1 不同密度米氏凯伦藻对轮虫种群数量的影响(CT:对照; SV:饥饿)Fig. 1 The effect of K. mikimotoi on rotifer B. plicatilis population (CT: control; SV: starvation)
2.2 米氏凯伦藻不同组分对轮虫种群数量的影响
为了探明米氏凯伦藻对轮虫的毒性来源, 作者比较了藻的各组分:藻培养液、藻细胞重悬液、藻培养液过滤液、藻细胞破碎液对轮虫种群数量的影响。由图2可见, 24 h后藻的各组分中只有藻液和藻细胞重悬液使轮虫种群数量显著降低(P<0.01), 分别减少了 98%和 85%, 其他组分中的轮虫种群数量与饥饿组无显著性差异。看来只有完整的活藻细胞(藻培养液和藻细胞重悬液) 才具有对轮虫的急性致死效应, 因此该藻的毒性可能与藻细胞活性有关。
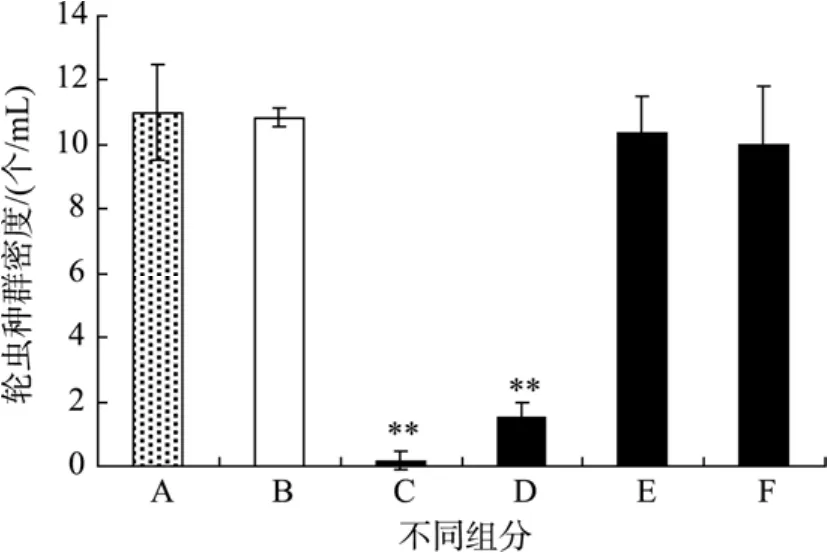
图2 米氏凯伦藻不同组分对轮虫种群数量的影响Fig. 2 The effect of different fractions on rotifer B. plicatilis populationA.对照; B.饥饿; C.藻培养液; D.藻细胞重悬液; E.藻培养液过滤液; F.藻细胞破碎液A. Control; B. Starvation; C. Algal culture; D. Re-suspended algal cells; E. Filtrate; F. Broken cells
2.3 米氏凯伦藻对卤虫存活的影响
米氏凯伦藻对卤虫存活的影响如图3所示。24 h,各实验组中卤虫的存活率均在90%以上; 48 h后除对照组外, 其他各组中的卤虫存活率都呈现下降的趋势, 且各藻密度组中卤虫的存活率与饥饿组之间没有显著性差异, 说明在仅有米氏凯伦藻存在的条件下卤虫不能存活, 饥饿可能是造成其死亡的原因。在实验中观察到高密度组中卤虫被黏性物质缠在一起, 不能自由运动, 藻细胞外黏液及毒性物质可能也是导致卤虫死亡的原因。
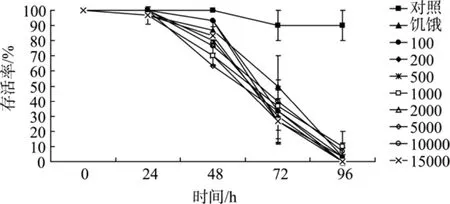
图3 米氏凯伦藻对卤虫存活的影响Fig. 3 The effect of K. mikimotoi density on brine shrimp A.salina
2.4 米氏凯伦藻对黑褐新糠虾存活的影响
米氏凯伦藻对黑褐新糠虾存活的影响如图 4所示。16 d时, 糠虾的存活率随藻细胞密度的增加而下降, 在低密度(<5 000个/mL)下糠虾的存活率为100%, 而在10 000、15 000个/mL密度下, 糠虾的存活率分别为77%和27%, 其中15 000个/mL密度中的糠虾存活率与对照组有极显著的差异(P<0.01)。米氏凯伦藻对糠虾的16 d半致死密度(16 d LD50) 约为12 500个/mL。
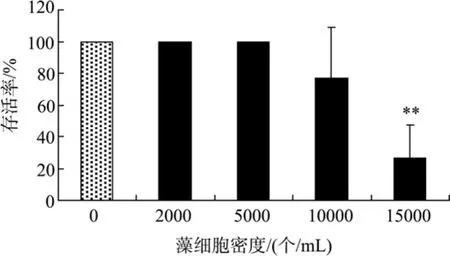
图4 米氏凯伦藻对黑褐新糠虾存活的影响Fig. 4 The effect of K. mikimotoi density on Neomysis awatschensis
3 讨论
3.1 米氏凯伦藻赤潮对海洋生态系统的潜在危害
一般认为米氏凯伦藻赤潮的危害有以下三种途径: 首先, 在赤潮发生时藻细胞夜间呼吸以及在赤潮消退期藻细胞分解会消耗大量氧气, 产生低氧环境; 其次, 米氏凯伦藻能产生溶血毒素、鱼毒素[21,22]、活性氧[25]及部分细胞毒素[24,25]等; 再次, 米氏凯伦藻赤潮发生时海水中存在黏液性物质或者泡沫[2,26~28],Partensky[29]认为由此造成的海水黏滞性增加是导致海洋生物死亡的主要原因。
当米氏凯伦藻赤潮爆发时, 人们一般只关注其造成的鱼类等个体较大生物的死亡, 而根据本研究的结果, 2×104个/L密度的米氏凯伦藻24 h就能导致轮虫数量减少一半, 且韩刚等[9]在现场实验中发现,米氏凯伦藻赤潮能够显著降低中华哲水蚤的数量,相关研究还发现凯伦藻能导致沙蚕、牡蛎幼体和鲍鱼幼体的死亡, 抑制扇贝受精卵分裂并导致其胚胎发育异常等[21,26,30~32]。因此可以推测, 在米氏凯伦藻赤潮发生时, 某些浮游动物可能已经会出现大量死亡现象。因此, 凯伦藻赤潮对浮游动物的种群数量,以及整个海洋生态系统的负面影响也值得关注。
3.2 不同生物对米氏凯伦藻敏感性的比较
本实验中 3种生物对于米氏凯伦藻的敏感性差异非常明显。其中轮虫最为敏感, 然后依次为卤虫和糠虾。24 h轮虫数量和藻细胞密度对数值间的线性方程为: y = -6.367x + 13.684, R2= 0.902 6, 以此计算,当暴露于2 000个/mL的米氏凯伦藻中时, 24 h内轮虫将全部死亡。而在此密度下, 24 h内卤虫的存活率为100%, 96 h后才大量死亡。黑褐新糠虾在2 000个/mL的米氏凯伦藻中却能够存活至少 16 d, 当密度达到10 000个/mL时才出现死亡。敏感性的差异可能是由于它们具有不同的生理结构、代谢途径和摄食方式等造成的。
有学者指出甲藻对褶皱臂尾轮虫的毒害作用是由于藻细胞和轮虫之间发生频繁碰撞而影响了轮虫体内某些生理功能, 并刺激了藻细胞毒性物质的释放[33,34]。Zou等[35]在研究一株米氏凯伦藻时也发现该藻藻细胞对褶皱臂尾轮虫具有急性致死作用, 当藻细胞与轮虫之间的直接接触被阻断时, 这种毒性作用会随之消失, 且藻培养液过滤液与藻细胞破碎液不具有这种毒性作用, 说明完整藻细胞的直接接触是导致轮虫死亡的关键因素; 通过化学方法去除藻细胞可能含有的活性氧后, 毒性作用仍然存在,且该藻对轮虫的毒性作用与其溶血活性具有一定的相关性, 说明这种毒性作用与活性氧无关, 其可能与溶血活性有关; 他们在实验中观察到, 当暴露在米氏凯伦藻藻细胞中, 部分轮虫的头冠会被黏性分泌物包裹并出现泡沫状结构。综上所述, 他们认为米氏凯伦藻对褶皱臂尾轮虫的毒性作用可能是由于直接接触造成了头冠等敏感部位膜结构的损伤。卤虫是一种鳃足类甲壳生物, 它的鳃裸露位于附肢基部,容易受到米氏凯伦藻产生的毒性物质的毒害。虽然米氏凯伦藻中卤虫存活率的下降趋势与饥饿组相似,但实验发现卤虫能够摄食米氏凯伦藻, 藻细胞可能给卤虫提供部分营养, 可能由于藻细胞提供营养不足, 或者在摄入藻细胞的同时摄入了某些有害物质而导致卤虫死亡, 高密度藻细胞产生的黏性物质也可能是导致卤虫死亡的原因。黑褐新糠虾虽不摄食藻细胞, 但由于卤虫能够摄食米氏凯伦藻, 毒性物质可能通过卤虫的传递或在糠虾捕食和吞水过程中进入糠虾体内, 从而对其产生毒性影响。在今后的实验中, 作者将使用双壳贝类和鱼类等作为受试生物,使研究结果更充分地反映出有害赤潮可能对海洋生态系统各种生物造成的影响。致谢: 本实验得到了中国科学院海洋研究所张利永博士在藻类培养方面的指导, 以及汤士英和别焕章师傅在生物培养方面的大力协助, 在此一并致以谢忱。
[1] Taylor F J R, Fukuyo Y, Larsen J. Taxonomy of harmful dinoflagellates [A]. Hallegraeff G M. Manual on Harmful Marine Microalgae [C]. Paris: Intergovernmental Oceanographic Commission of UNESCO, 1995,283-317.
[2] Jones K J, Ayres P, Bullock A M, et al. A red tide of Gyrodinium aureolum in sea lochs of the Firth of Clyde and associated mortality of pond-reared salmon [J].Journal of the Marine Biological Association of the United Kingdom, 1982, 62: 771-782.
[3] Erard-Le Denn, E., Belin C, Billard C. Various cases of ichtyotoxic blooms in France [A]. Arzul G. Aquaculture,Environement and Marine Phytoplankton [C]. Proceedings of a symposium held in Brest, 21-23 may 2001. Actes Colloq. IFREMER, 2002, 89-102.
[4] Arzul G, Erard-Le Denn E, Belin C, N’ezan E. Ichtyotoxic events associated with Gymonodinium cf. nagasakiense on the Atlantic coast of France [J]. Harmful Algal News, 1995, 2/3: 8-9.
[5] 国家海洋局. 中国海洋环境质量公报(2000-2008)[R].北京: 国家海洋局, 2000-2008.
[6] 国家海洋局. 中国海洋灾害公报(1989-2008)[R]. 北京: 国家海洋局, 1989-2008.
[7] 梁松, 钱宏林, 齐雨藻. 中国沿海的赤潮问题 [J].生态科学, 2000, 12: 44-50.
[8] 王金辉, 秦玉涛, 刘材材, 等. 长江口及邻近海域有毒藻类和赤潮毒素的本底调查 [J]. 海洋湖沼通报,2007, 1: 52-61.
[9] 韩刚. 东海大规模赤潮对中华哲水蚤和黑褐新糠虾的生态毒理学研究[D]. 青岛: 中国科学院海洋研究所, 2006.
[10] 陈洋, 颜天, 周名江. 有害赤潮藻对浮游动物摄食的影响 [J]. 海洋科学, 2005, 29(12): 81-87.
[11] Snell T W, Persoone G. Acute toxicity bioassays using rotifers. I. A test for brackish and marine environments with Brachionus plicatilis [J]. Aquatec Toxicology,1998a, 14: 65-68.
[12] Snell T W, Persoone G. Acute toxicity bioassays using rotifers. .Ⅱ A fresh water test with Brachionus rubens[J]. Aquatec Toxicology, 1998b, 14: 81-92.
[13] Preston L B, Snell T W, Kneisel R. UV-B exposure increases acute toxicity of pentachlorophenol and mer-cury to the rotifer Brachionus calyciflorus [J]. Environmental Pollution, 1999, 106: 23-31.
[14] Radix P, Severin G. Reproduction disturbances of Brachionus calyciflorus(rotifer) for the screening of environmental endocrine disrupters [J]. Chemosphere,2002, 47: 1097-1101.
[15] Demaret A, Sohet K, Houvenaghel G. Efects of toxic dinoflagellates on the feeding and mortality of A rtemiafranciscana larvae [A]. Lassns P, Arzul G, Erardle D E, et al. Harmful Marine Algal Blooms [C]. Paris: Lavoisier, 1995, 427-432.
[16] Lush G J, Hallegraeff G M. High toxicity of the red tide dinoflagellate Alexandrium minutum to the brine shrimp Artemia salina [A]. Yasumoto T, Oshima Y,Fukuyo Y. Harmful and Toxic Algal Blooms [C]. Paris:Intergovernmental Oceanographic Commission of UNESCO, 1996, 389-392.
[17] Simonsen S, Moller B L, Larsen J, et al. Haemolytic activity of Alexandrium tamarense [A]. Lassns P, Arzul G, Erardle D E, et al. Harmful Marine Algal Blooms[C]. New York: Lavoisier, 1995, 513-517.
[18] 颜天, 周名江, 傅萌, 等. 赤潮异弯藻毒性及毒性来源的初步研究 [J]. 海洋与湖沼, 2003, 34(1): 50-55.
[19] 谭志军. 塔玛亚历山大藻(Alexandrium tamarense)对黑褐新糠虾(Neomysis awatschensis)和鲈鱼(Lateolabrax japonicus)的生态毒理学效应 [D]. 青岛:中国科学院海洋研究所, 2003.
[20] 张彬. 亚历山大藻(非 PSP产毒株)毒理的初步研究[D]. 青岛: 中国科学院海洋研究所, 2007.
[21] Gentien P, Arzul G. Exotoxin production by Gyrodinium cf. aureolum (Dinophyceae) [J]. Journal of the Marine Biological Association of the United Kingdom, 1990, 70: 571-581.
[22] Yasumoto T, Underal B, Aune T, et al. Screening for hemolytic and ichthyotoxic components of Chrysochromulina polylepis and Gyrodinium aureolum from Norwegian coastal waters [A]. Graneli E, Sundstorm B,Edler L, et al. Toxic Marine Phytoplankton [C]. New York: Elsevier, 1990. 436-440.
[23] Yamasaki Y, Kim D, Matsuyama Y, et al. Production of superoxide anion and hydrogen peroxide by the red tide dinoflagellate Karenia mikimotoi [J]. Journal of Bioscience and Bioengineering, 2004, 97(3): 212-215.
[24] Satake M, Shoji M, Oshima Y, et al. Gymnocin-A, a cytotoxic polyether from the notorious red tide dinoflagellate, Gymnodinium mikimotoi [J]. Tetrahedron Letters, 2002, 43: 5829-5832.
[25] 陈洋. DSP等赤潮藻毒素对哺乳类细胞的毒性效应及机制研究 [D]. 青岛: 中国科学院海洋研究所, 2008.
[26] Helm M M, Hepper B T, Spencer B E, et al. Lugworm mortalities and a bloom of Gyrodinium aureolum Hulburt in the eastern Irish Sea, Autumn 1971 [J]. Journal of the Marine Biological Association of the United Kingdom, 1974, 54: 857-869.
[27] Potts G W, Edwards J M. The impact of a Gyrodinium aureolum bloom on inshore young dish populations [J].Journal of the Marine Biological Association of the United Kingdom, 1987, 67: 293-297.
[28] Ballantine D, Smith F M. Observations on blooms of the dinoflagellate Gyrodinium aureolum Hulburt in the River Conwy and its occurrence along the North Wales coast [J]. British Phycological Journal, 1973, 8:233-238.
[29] Partensky F. Does the fish-killing kinoflagellate Gymnodinium cf. nagasakiense produce cytotoxins [J].Journal of the Marine Biological Association of the United Kingdom, 1989, 69: 501-509.
[30] Uchida T, Todab S, Matsuyamaa Y, et al. Interactions between the red tide dinoflagellates Heterocapsa circularisquama and Gymnodinium mikimotoi in laboratory culture [J]. Journal of Experimental Marine Biology and Ecology, 1999, 241: 285-299.
[31] Botes L, Smit A J, Cook P A. The potential threat of algal blooms to the abalone (Haliotis midae) mariculture industry situated around the South African coast [J].Harmful Algae, 2003, 2: 247-259.
[32] Sellem F, Pesando D, Bodennec G, et al. Toxic effects of Gymnodinium cf. mikimotoi unsaturated fatty acids to gametes and embryos of the sea urchin Paracentrotus lividus [J]. Water Research, 2000, 34(2): 550-556.
[33] Kim D, Sato Y, Oda T, et al. Specific toxic effect of dinoflagellate Heterocapsa circularisquam a on the rotifer Brachionus plicatilis [J]. Bioscience Biotechnology and Biochemistry, 2000, 64(12): 2719-2722.
[34] 王丽平, 颜天, 谭志军, 等. 塔玛亚历山大藻和东海原甲藻对褶皱臂尾轮虫种群数量的影响 [J]. 应用生态学报, 2003, 14(7): 1151-1155.
[35] Yanan Zou, Yamasaki Y, Matsuyama Y, et al. Possible involvement of hemolytic activity in the contact-dependent lethal effects of the dinoflagellate Karenia mikimotoi on the rotifer Brachionus plicatilis.Harmful Algae, 2010, 9: 367-373.
Effect of Karenia mikimotoi on the survival of rotifer Brachionus plicatilis, brine shrimp Artemia salina, and Neomysis awatschensis
SUN Ke1,2, YAN Tian1, ZHOU Ming-jiang1, Ho KC3
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Graduate School, Chinese Academy of Sciences, Beijing 100039, China; 3. School of Science and Technology, The Open University of Hong Kong, Hong Kong 999077)
Mar., 25, 2010
Karenia mikimotoi; Brachionus plicatilis; Artemia salina; Neomysis awatschensis; population; survival
In this paper, we analyzed the distribution of blooms caused by Karenia sp. in China and the toxicity of Karenia mikimotoi to Brachionus plicatilis, Artemia salina, and Neomysis awatschensis. The population of B. plicatilis was significantly decreased when exposed to K. mikimotoi at low densities and the 24h EC50was about 20 cells/mL. Comparison of the toxicities of different algal fractions showed that the algal culture and re-suspended algal cells had the adverse effects, but the broken cells and filtrate showed little impact, indicating that the inhibitory effect was mainly related to the active whole algal cells. The survival of A. salina or N. awatschensis was significantly decreased when exposed to K. mikimotoi. The results suggest that K. mikimotoi blooms might directly impact zooplankton survival.
S963.14
A
1000-3096(2010)09-0076-06
2010-03-25;
2010-06-12
中国科学院创新项目(KZCX2-YW-208); 国家自然科学基金项目(U0733006); 国家 973计划项目(2010CB428700)
孙科(1985-)男, 山东淄博人, 硕士研究生, 研究方向:海洋生态学, E-mail: sunke20021@126.com; 颜天, 通信作者, 主要从事赤潮危害机制研究, E-mail: tianyan@qdio.ac.cn
(本文编辑: 梁德海)
