重金属胁迫对杜氏盐藻生长及叶绿素荧光特性的影响
2010-10-23冯力霞田传远
王 帅, 梁 英, 冯力霞, 田传远
(1. 中国海洋大学 海水养殖教育部重点实验室, 山东 青岛 266003; 2. 国家海洋局第一海洋研究所 海洋生物活性物质重点实验室, 山东 青岛 266061)
重金属胁迫对杜氏盐藻生长及叶绿素荧光特性的影响
王 帅1,2, 梁 英1, 冯力霞1, 田传远1
(1. 中国海洋大学 海水养殖教育部重点实验室, 山东 青岛 266003; 2. 国家海洋局第一海洋研究所 海洋生物活性物质重点实验室, 山东 青岛 266061)
研究了杜氏盐藻Dunaliella salina在不同浓度的Cu2+、Zn2+、Cd2+等重金属离子胁迫一段时间(24、48、72 和96 h)后, 叶绿素荧光特性的变化情况。测定的主要参数有: PSII的最大光能转化效率(Fv/Fm)、PSII的潜在活性(Fv/Fo)、PSII的实际光能转化效率(Yield)、相对光合电子传递效率(rETR)、光化学淬灭(qP)和非光化学淬灭(NPQ)。研究结果表明, 当 Cu2+浓度范围在 600~800 µmol/L时, 杜氏盐藻的Fv/Fm、Fv/Fo、Yield、rETR和qP均明显降低, NPQ变化不规律, 随着胁迫时间的延长, 除qP在96 h时有所上升外, 各荧光参数均逐渐降低; Zn2+胁迫下Fv/Fm、Fv/Fo、Yield和rETR随着浓度的增加而降低, NPQ先下降后上升, qP仅在Zn2+浓度范围(800~3200 µmol/L)下明显下降, 随着胁迫时间的延长, 各荧光参数均逐渐降低; Cd2+胁迫下各荧光参数均明显下降, 随着胁迫时间的延长, Fv/Fm、Fv/Fo和NPQ先下降后上升, 在48 h时达到最低值, Yield、rETR和qP均逐渐降低。在3种重金属离子胁迫下, 细胞密度和叶绿素相对含量也显著降低。根据 3种重金属离子的半抑制浓度(EC50), 其毒性大小顺序为 Cu2+>Cd2+> Zn2+。
杜氏盐藻Dunaliella salina; 重金属胁迫; 叶绿素荧光
微藻作为海洋的主要初级生产者在研究生态系统中是一个重要因素, 其光合作用的强弱决定了在食物链中可以传递的能量的多少。随着海洋污染的日益严重, Cu2+、Zn2+、Cd2+等重金属离子在海水中的浓度不断增加, 微藻的光合作用过程受重金属的影响越来越大[1~6]。因此, 研究重金属离子对海洋微藻的毒害作用, 并在此基础上进行水污染生物监测具有十分重要的意义。
以往研究重金属对微藻毒性的方法是将微藻置于含有不同浓度重金属离子的培养液中进行培养,通过测定微藻细胞密度、叶绿素含量等指标来反映重金属对微藻生长的影响。对微藻生长的半抑制浓度(EC50)、半致死浓度(LC50)或刺激浓度(SC20)可以用来表示微藻对重金属胁迫的敏感程度[6~9], 一般测定其72 h或96 h的EC50或LC50。但该法存在测量时间较长、测量结果不是很准确(微藻的活细胞和死细胞较难区分)等缺陷。因此, 寻找一种快速、简便、对细胞无损伤的方法, 就显得十分必要和迫切。为了解决这个问题, 国外某些学者尝试用叶绿素荧光技术来测定重金属对微藻的毒害作用[8,10~13], 测定的主要参数有 PSII的最大光能转化效率(Fv/Fm)、Fv'/Fm'(PSII有效光化学量子产量)、PSII的实际光能转化效率(Yield)、光化学淬灭(qP)、非光化学淬灭(NPQ)等, 并以某些荧光参数(Fv'/Fm'、Yield、qP等)的半抑制浓度(EC50)来表示微藻受重金属胁迫的程度[14,15]。这种方法具有快速、准确、需要样品量少的优点。但目前应用此法开展的研究工作还远远不够, 还未见用叶绿素荧光法研究重金属离子对杜氏盐藻影响的报道。
盐藻具有很强的耐盐性, 可以在含0.05~5.5 mol/L NaCl的培养液中生存[16], 是迄今为止最耐盐的真核生物。其细胞内 β-胡萝卜素、甘油和蛋白质含量十分丰富, 含有包括人类必需氨基酸在内的 18种氨基酸, 因此具有非常重要的商业价值。杜氏盐藻的抗逆性很强,近年来已被国内外广泛应用于环境胁迫的研究[17], 作者研究了重金属胁迫对杜氏盐藻生长及叶绿素荧光特性的影响, 并据此计算出叶绿素荧光参数的半抑制浓度(EC50), 以期对将来培育抗逆性强的微藻品种及水污染生物监测提供参考依据。
1 材料与方法
1.1 藻种
实验所用杜氏盐藻 Dunaliella salina (MACC/C43)藻种取自中国海洋大学微藻种质库。
1.2 微藻培养及重金属胁迫
预培养在3 000 mL的三角烧瓶中进行, 采用f/2培养基[18], 盐度为28, 培养温度为25℃±1, pH℃为8.2, 连续光照, 光强强度为4 000 lx。
实验在250 mL的三角烧瓶中进行, 根据预实验的结果, 将 Cu2+浓度设定为 0, 100, 200, 400, 600,800 µmol/L等梯度; Zn2+浓度设定为0, 200, 400, 600,800, 1600, 3 200 µmol/L等梯度; Cd2+浓度设定为0,50, 100, 200, 400, 600, 800, 1000 µmol/L 等梯度。以不加重金属的空白组为对照, 将处于指数生长期的杜氏盐藻以相同的接种量(9×104个/mL)分别接入上述重金属离子浓度的培养液中进行重金属胁迫处理;每个浓度3个平行组。培养过程中不充气, 每日随机调换三角烧瓶并摇动3~5次。分别于胁迫24, 48, 72,96 h后取样, 进行细胞密度(血球计数板)、叶绿素含量及叶绿素荧光各项参数的测定。
1.3 叶绿素含量的测定
用德国Walz公司产Water-PAM水样叶绿素荧光仪(Walz, Effeltrich, Germany)进行叶绿素含量的测定,由于瞬间荧光产量(F)和叶绿素浓度在一定范围内成正比, 通过校正可测出叶绿素含量。为避免校正过程中可能产生的误差, 文中的叶绿素含量用相对含量(每次测得的叶绿素含量与接种时叶绿素含量的比值)表示。
1.4 叶绿素荧光参数的测定
用德国Walz公司产Water-PAM水样叶绿素荧光仪(Walz, Effeltrich, Germany)进行叶绿素荧光各个参数的测定。测量前将微藻样品暗适应 15 min。叶绿素荧光参数Fv/Fm、Yield、rETR、qP和NPQ可在荧光仪上直接读出, Fv/Fo则用公式(Fm-Fo)/ Fo计算出,其中 Fo(基础荧光)用弱测量光(0.5 lx)测量可得, 用饱和脉冲(200 000 lx, 持续时间为 0.8 s)激发可得Fm(最大荧光)。
1.5 EC50的测定
EC50是指半抑制浓度, 利用机率单位法[19,20]计算得出。
1.6 统计分析
利用SPSS11.5软件对实验结果进行统计分析。
2 结果
2.1 重金属胁迫对杜氏盐藻叶绿素荧光各参数的影响
Cu2+浓度及胁迫时间对杜氏盐藻叶绿素荧光参数的影响见图1和表1。双因子方差分析结果(表1)表明, Cu2+浓度、胁迫时间及二者的交互作用(Cu2+浓度×时间)对杜氏盐藻各荧光参数均有显著影响(P<0.05), 其中 Cu2+浓度的影响最显著。荧光参数Fv/Fm、Fv/Fo、Yield、rETR、qP与 Cu2+浓度均呈显著的负相关(表 2), 当 Cu2+浓度范围在 600~800µmol/L, 以上各荧光参数值明显降低。胁迫时间对杜氏盐藻各荧光参数均有显著性影响(P<0.05), 随着胁迫时间的延长, 当 Cu2+浓度范围在 600~800 µmol/L时, Fv/Fm、Fv/Fo、Yield、rETR 和 NPQ 均逐渐降低, 仅qP在96 h时有所上升。
Zn2+浓度及胁迫时间对杜氏盐藻叶绿素荧光参数的影响见图2和表1。双因子方差分析结果(表1)表明, Zn2+浓度、胁迫时间及二者的交互作用(Zn2+浓度×时间)对杜氏盐藻各荧光参数均有显著影响(P<0.05), 其中 Zn2+浓度的影响最显著。荧光参数Fv/Fm、Fv/Fo、Yield、rETR、qP与 Zn2+浓度均呈显著的负相关(表 2), 当 Zn2+浓度范围在 800~3200µmol/L时, qP明显下降, 其余各荧光参数值均随着Zn2+浓度的增加而降低。NPQ则与 Zn2+浓度呈显著的正相关。胁迫时间对杜氏盐藻各荧光参数均有显著影响(P<0.05), 随着胁迫时间的延长, 各荧光参数均逐渐降低。
Cd2+浓度及胁迫时间对杜氏盐藻叶绿素荧光参数的影响见图3和表1。双因子方差分析结果(表1)表明, Cd2+浓度、胁迫时间及二者的交互作用(Cd2+浓度×时间)对杜氏盐藻各荧光参数均有显著影响(P<0.05), 其中 Cd2+浓度的影响最显著。荧光参数Fv/Fm、Fv/Fo、Yield、rETR与 Cd2+浓度均呈显著的负相关(表2), 以上各荧光参数值均随着Cd2+浓度的增加而降低。胁迫时间对杜氏盐藻各荧光参数也有显著影响(P<0.05), 随着胁迫时间的延长, Fv/Fm、Fv/Fo和NPQ先下降后上升, 在48 h时达到最低值,Yield、rETR和qP均逐渐降低。
表 3给出了杜氏盐藻的荧光参数以及叶绿素相对含量与细胞密度之间的相关关系。由表 3可以看出, 在 Cu2+、Zn2+、Cd2+胁迫下(24~96 h), 盐藻的荧光参数(Fv/Fm、Fv/Fo、Yield和 rETR)与细胞密度均呈显著的正相关关系。特别是盐藻的叶绿素相对含量与细胞密度呈极显著的正相关关系, 而且随着胁迫时间的延长, 相关系数逐步增大。说明重金属胁迫下藻细胞生长的抑制也能够从部分荧光参数中得到反映。因此可以利用上述参数的变化来反映盐藻的生长情况及其对重金属胁迫的适应性。但盐藻的荧光参数qP、NPQ与细胞密度的相关性不显著。
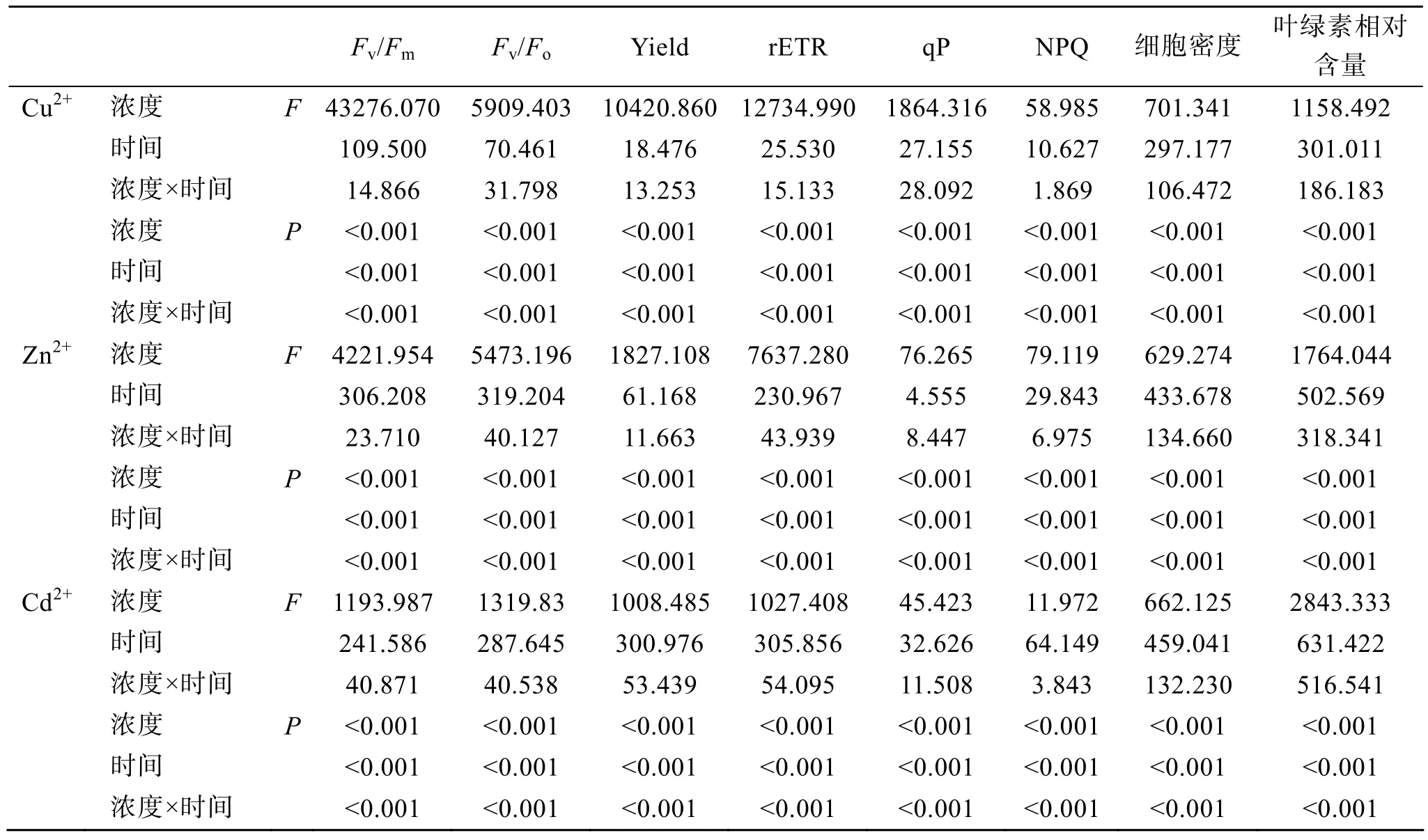
表1 重金属浓度和胁迫时间对杜氏盐藻荧光参数、细胞密度及叶绿素相对含量影响的双因子方差分析结果Tab. 1 Summary of MANOVA on fluorescence parameters, cell density and relative chlorophyll content of D. salina exposed to different heavy metals for different time
2.2 重金属胁迫对杜氏盐藻细胞密度的影响
重金属离子(Cu2+、Zn2+、Cd2+)浓度及胁迫时间对杜氏盐藻细胞密度的影响见图1~3和表1。双因子方差分析结果表明, 重金属离子浓度、胁迫时间及二者的交互作用, 对盐藻的细胞密度均有显著影响(P<0.05), 其中 3种重金属离子浓度的影响均最显著。表 2给出了杜氏盐藻的细胞密度与重金属离子浓度之间的相关关系, 由表 2可以看出, 在 Cu2+、Zn2+、Cd2+胁迫下(24~96 h), 盐藻的细胞密度与3种重金属离子浓度均呈显著的负相关, 随着浓度的增大, 细胞密度逐渐下降。胁迫时间对其细胞密度也有显著影响(P<0.05), 与对照组相比, 随着胁迫时间的延长, 细胞密度下降的幅度逐步增大(表4), 在Cu2+、Zn2+、Cd2+的最大浓度下胁迫96 h后, 藻细胞密度分别下降为对照组的2.60%, 2.75%, 1.98%。
2.3 重金属胁迫对杜氏盐藻叶绿素含量的影响
重金属离子(Cu2+、Zn2+、Cd2+)浓度及胁迫时间对杜氏盐藻叶绿素相对含量的影响见图1~3和表1。双因子方差分析结果表明, 重金属离子浓度、胁迫时间及二者的交互作用, 对盐藻的叶绿素相对含量均有显著影响(P<0.05), 其中3种重金属离子浓度的影响均最显著。表 2给出了杜氏盐藻的叶绿素相对含量与重金属离子浓度之间的相关关系, 由表 2可以看出, 在 Cu2+、Zn2+、Cd2+胁迫下(24~96 h), 盐藻的叶绿素相对含量与 3种重金属离子浓度均呈显著的负相关, 随着浓度的增大, 上述参数逐渐下降。胁迫时间对盐藻的叶绿素相对含量也有显著影响(P<0.05), 与对照组相比, 随着胁迫时间的延长, 叶绿素相对含量下降的幅度逐步增大(表4), 在Cu2+、Zn2+、Cd2+的最大浓度下胁迫96 h后, 叶绿素相对含量分别下降为对照组的0.11%, 1.21%, 0.52%。
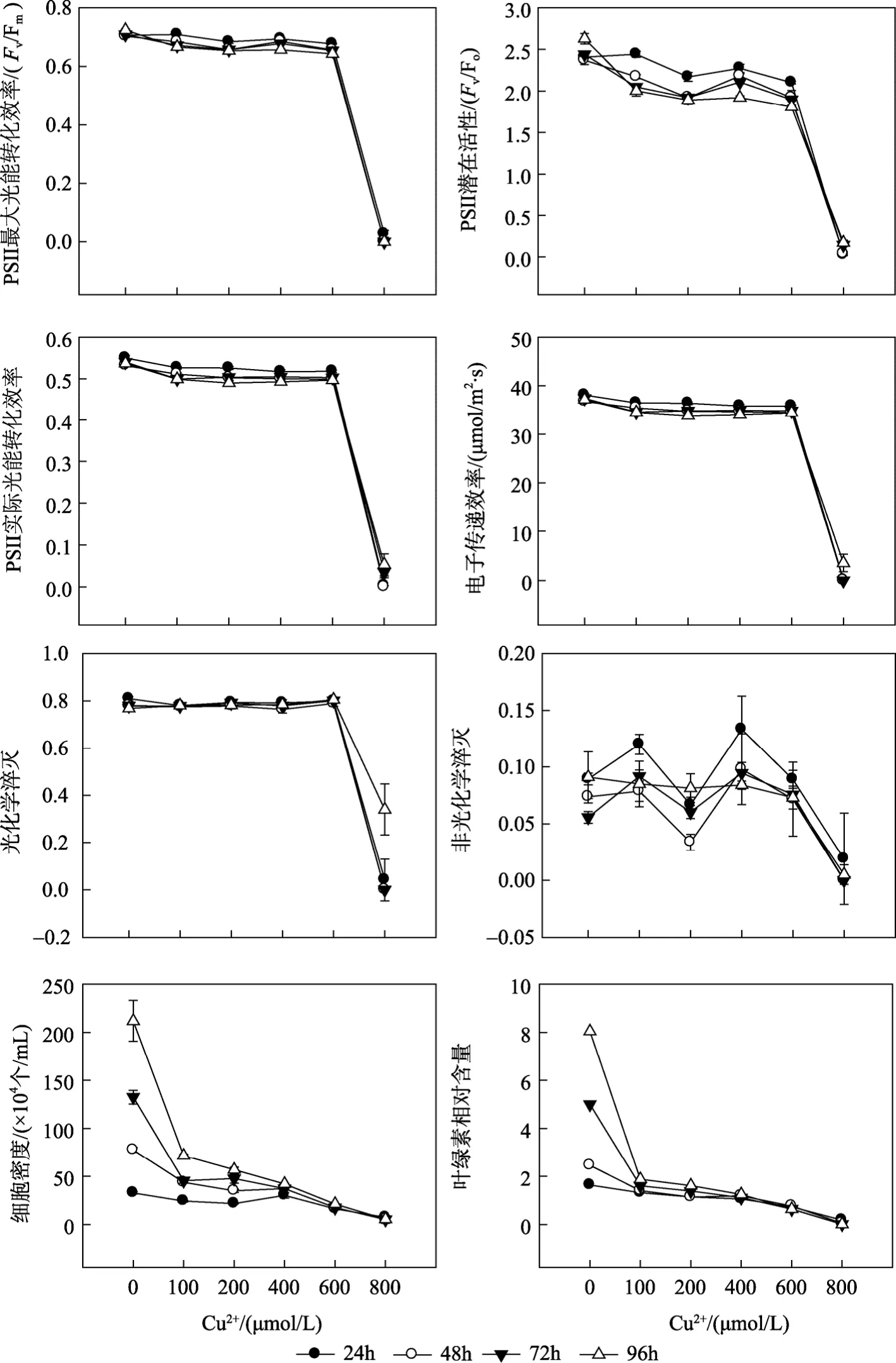
图1 Cu2+胁迫对杜氏盐藻叶绿素荧光参数、细胞密度和叶绿素相对含量的影响Fig. 1 Effects of Cu2+ on fluorescence parameters, cell density and relative chlorophyll content of D. salina
2.4 EC50
表4给出了3种重金属离子胁迫下杜氏盐藻各叶绿素荧光参数(Fv/Fm、Fv/Fo、Yield、叶绿素含量)的 EC50变化情况。由表 5可以看出, 重金属离子(Cu2+、Zn2+、Cd2+)对杜氏盐藻的EC50值与重金属种类有关。Cu2+显示出最低的 EC50值(23.616~506.991µmol/L), 这表明 Cu是对杜氏盐藻毒性最大的重金属离子。Zn2+胁迫下的EC50值最高(315.864~990.376µmol/L), 这表明 Zn2+的毒性最低。Cd2+的毒性介于二者之间(EC50为 24.595~918.333 µmol/L)。因此, 3种重金属对杜氏盐藻毒性的大小顺序为Cu2+>Cd2+>Zn2+。

图2 Zn2+胁迫对杜氏盐藻叶绿素荧光参数、细胞密度和叶绿素相对含量的影响Fig. 2 Effects of Zn2+ on fluorescence parameters, cell density and relative chlorophyll content of D. salina
3 讨论
本实验结果表明, 在不同浓度的 3种重金属离子(Cu2+、Zn2+、Cd2+)胁迫下, 杜氏盐藻各叶绿素荧光参数均有不同程度的下降, 细胞密度和叶绿素相对含量也显著降低。Cu和 Zn是微藻必需的微量元素之一, 它对维持生命体的生长、代谢和酶活性等起着非常重要的作用。本试验也证实了这一点, 在200µmol/L Zn2+(24~72 h)胁迫下, 藻细胞密度分别为对照组的110.80%, 118.15%, 104.40%。但高浓度的Cu和 Zn会使微藻的生长受到抑制。Cu可影响质膜的透性, 导致细胞丢失 K+, 使细胞体积发生变化, 抑制细胞分裂速度, 干扰叶绿体内的光合作用以及ATP的合成, 最终导致细胞死亡[21,22]。Zn不仅抑制相对光合电子传递效率而且使线粒体膜的功能性降低, 叶绿素含量下降, 最终影响藻类的生长[23]。Cd是一种有毒元素, 可抑制微藻 PSII的活性、CO2同化和Calvin循环的酶活性, 使类囊体和叶绿素a/b蛋白复合体天线系统解体[24], 从而使各荧光参数均有下降趋势。通过查找大量文献以及本实验结果可以看出[11,12,23,25,26],Fv/Fm作为反映微藻生长的指标, 具有更高灵敏度和特异性。

图3 Cd2+胁迫对杜氏盐藻叶绿素荧光参数、细胞密度和叶绿素相对含量的影响Fig. 3 Effects of Cd2+ on fluorescence parameters, cell density and relative chlorophyll content of D. salina
通过本实验可以看出, 重金属(Cu2+、Zn2+、Cd2+)对杜氏盐藻各叶绿素荧光参数(Fv/Fm、Fv/Fo、Yield、叶绿素含量)的 EC50值与重金属种类有关, 对杜氏盐藻毒性的大小顺序为 Cu2+>Cd2+>Zn2+, 这与文献[7,8,25~28]报道一致。但与有些研究结果有所差异,例如, Prange[29]的研究结果表明 Zn2+>Cu2+。Satoh[30]报道 Cu2+和 Cd2+对 9种微藻的毒性大小没有显著差异。李彬等[31]对斜生栅藻(Scenedesmus obliquus)进行了研究, EC50顺序为 Cu2+>Zn2+>Cd2+。这种差异可能是由于微藻的不同品系、计算 EC50所用参数(本实验及国外大多数学者是用叶绿素荧光参数计算EC50值, 国内学者多用细胞密度计算EC50值)、实验条件(温度、光照、营养盐、生长时期)等不同引起的。

表2 杜氏盐藻叶绿素荧光参数、细胞密度及叶绿素相对含量与Cu2+、Zn2+、Cd2+浓度的相关系数Tab. 2 The correlation coefficient of chlorophyll fluorescence parameters, cell density and relative chlorophyll content of D. salina with concentrations of Cu2+, Zn2+ and Cd2+
利用叶绿素荧光分析技术可以在对微藻细胞无损伤的情况下快速、灵敏地探测重金属胁迫对微藻的作用并分析其作用机制[32,33]。从实验结果来看, 杜氏盐藻的荧光参数Fv/Fm、Fv/Fo、Yield、rETR对重金属胁迫比较敏感, 上述荧光参数与重金属(Cu2+、Zn2+、Cd2+)浓度均呈显著的负相关关系, 随着重金属浓度的增加而降低, 因此可以利用上述荧光参数的变化来反映杜氏盐藻受重金属胁迫的情况。本实验结果还表明, 杜氏盐藻的荧光参数(Fv/Fm、Fv/Fo、Yield和 rETR)以及叶绿素相对含量均与细胞密度呈显著的正相关关系。因此, 可以通过测定逆境下微藻叶绿素荧光参数的变化, 来评价不同微藻品种对重金属离子等逆境的适应性, 并可作为筛选抗重金属污染微藻品种的参考指标, 能否直接用作抗重金属污染等的鉴定指标, 还需要针对不同的微藻品种进行大量的实验研究, 以确定该法的可靠性和适应性。

表3 杜氏盐藻叶绿素荧光参数及叶绿素相对含量与细胞密度的相关系数Tab. 3 The correlation coefficient of chlorophyll fluorescence parameters and relative chlorophyll content of D. salina with cell density

表4 不同浓度Cu2+、Zn 2+、Cd2+处理24, 48, 72, 96 h后, 杜氏盐藻的细胞密度和叶绿素相对含量相对于对照组的比例Tab. 4 Cell density and chlorophyll content of D. salina (% control) after 24, 48, 72 and 96 h of Cu2+, Zn2+ and Cd2+treatment

表5 不同浓度Cu2+、Zn 2+、Cd2+处理24, 48, 72, 96 h后杜氏盐藻各叶绿素荧光参数(Fv/Fm、Fv/Fo、Yield、叶绿素相对含量)的 EC50 (µmol/L)Tab. 5 EC50 (µmol/L) for the chlorophyll fluorescence parameters (Fv/Fm, Fv/Fo, Yield and relative chlorophyll content)of D. salina after 24, 48, 72 and 96 h of Cu2+, Zn2+ and Cd2+ treatments
[1] Maxwell K, Johnson G N. Chlorophyll fluorescence-a practical guide[J]. J Exp Bot, 2000, 51: 659-668.
[2] Jiang C D, Gao H Y, Zou Q. Changes of donor and accepter side in photosystem Ⅱ complex induced by iron deficiency in attached soybean and maize leaves[J].Photosynthetica, 2003, 41: 267-271.
[3] 邱昌恩, 况琪军, 毕永红, 等. Cd2+对绿球藻生长及生理特性的影响研究[J]. 水生生物学报, 2007, 31(1):142-145.
[4] 阎海, 潘纲, 霍润兰. 铜、锌和锰抑制月形藻生长的毒性效应[J]. 环境科学学报, 2001, 21(3): 328-332.
[5] 杨世勇, 王方, 谢建春. 重金属对植物的毒害及植物的耐性机制[J]. 安徽师范大学学报(自然科学版),2004, 27(1): 71-74.
[6] 周银环, 刘东超. 4种金属元素对绿色巴夫藻生长、叶绿素 a及大小的影响[J]. 湛江海洋大学学报, 2003,23(1): 22-28.
[7] 李坤, 王福强, 孙慎侠, 等. 巴夫金藻耐受 Cu2+、Cd2+毒害作用的研究[J]. 大连大学学报, 2003, 24(4): 92-94.
[8] 李坤, 李琳, 侯和胜, 等. Cu2+、Cd2+、Zn2+对两种单胞藻的毒害作用[J]. 应用与环境生物学报, 2002, 8(4):395-398.
[9] Sacan M T, Balcıoğlu I A. A case study on algal response to raw and treated effluents from an aluminum plating plant and a pharmaceutical plant[J]. Ecotoxicol Environ Saf, 2006, 64: 234-243.
[10] Catriona M O, Macinnis N, Peter J R. Towards a more ecologically relevant assessment of the impact of heavy metals on the photosynthesis of the seagrass,Zostera capricorni[J]. Mar Pollut Bull, 2002, 45: 100-106.
[11] Lu C M, Chau C W, Zhang J H. Acute toxicity of excess mercury on the photosynthetic performance of cyanobacterium,S. platensis-assessment by chlorophyll fluorescence analysis[J]. Chemosphere, 2000, 41:191-196.
[12] Mallick N, Mohn F H. Use of chlorophyll fluorescence in metal-stress research: a case study with the green microalgaScenedesmus[J]. Ecotoxicol Environ Saf,2003, 55: 64-69.
[13] Nielsen H D, Brownlee C, Coelho S M,et al. Inter-population differences in inherited copper tolerance involve photosynthetic adaptation and exclusion mechanisms inFucus serratus[J]. New Phytol, 2003,160: 157-165.
[14] Juneau P, Berdey A E, Popovic R. PAM Fluorometry in the determination of the sensitivity ofChlorella vulgaris,Selenastrum capricornutum, andChlamydomonas reinhardtiito Copper[J]. Arch Environ Contam Toxicol, 2002, 42: 155-164.
[15] Juneau P, Dewez D, Matsui S,et al. Evaluation of different algal species sensitivity to mercury and metolachlor by PAM-fluorometry[J]. Chemosphere, 2001,45: 589-598.
[16] Vismara R, Verni F, Barsanti L,et al. A short flagella mutant ofDunaliella salina(Chlorophyta, Chlorophyceae) [J]. Micron, 2004, 35: 337-344.
[17] 耿德贵, 韩燕, 王义琴, 等. 杜氏盐藻的耐盐机制研究进展和基因工程研究的展望[J]. 植物学通报, 2002,19(3): 290-295.
[18] Guillard R R, Ryther J H. Studies of marine planktonic diatoms. I.Cyclotellanana(Hustedt) andDetonula confervacea(Cleve) Gran [J]. Can J Microbiol, 1962,8: 229-239.
[19] 周永欣, 章宗涉.水生生物毒性试验方法[M]. 北京:农业出版社, 1989.114-122.
[20] 国家海洋局. 海洋检测规范[M].北京:海洋出版社,1991.766.
[21] Ballan D C. Response of the phytoplanktonic algae to Cu and Ag exposure: Vesicular metal bioaccumulation and lack of starch bodies[J]. Biol Cell, 1991,72(1-2):103-112.
[22] Cid A, Herrero C, Torres E, et al. Copper toxicity on the marine microalga Phaeodactylum tricornutum: effects on the photosynthesis and related parameters[J].Aquatic Toxicol, 1995, 31: 165-174.
[23] Plekhanov S E, Chemeris Y K. Early toxic effects of zinc, cobalt, and cadmium on photosynthetic activity of the green alga Chlorella pyenoidosa chick S-39[J]. Biol Bull, 2003, 30(5): 506-511.
[24] 利容千, 王建波. 植物逆境细胞及生理学[M]. 武汉:武汉大学出版社, 2002.307-311.
[25] Ismail M, Tong S, Phang S, et al. A modified toxicity testing method using tropical marine microalgae[J].Environ Monit Assess, 2002, 75: 145-154.
[26] Mallick N, Mohn F H. Use of chlorophyll fluorescence in metal-stress research: a case study with the green microalga Scenedesmus[J]. Ecotoxicol Environ Saf,2003, 55: 64-69.
[27] 张首临, 刘明星, 李国基, 等. 4种重金属离子对海洋三角褐指藻生长影响的研究[J]. 海洋与湖沼, 1995,26(6): 582-585.
[28] 赵素芬, 孙会强. 氮源、磷源及重金属离子对绿色巴夫藻生长的影响[J]. 湛江海洋大学学报, 2005, 25(1):60-63.
[29] Prange J A, Dennison W C. Physiological responses of five seagrass species to trace metals[J]. Mar Pollut Bull, 2000, 41: 327-336.
[30] Satoh A, Vudikaria L Q, Kurano N, et al. Evaluation of the sensitivity of marine microalgae strains to the heavy metals, Cu, As, Sb, Pb and Cd[J]. Environ Int, 2005,31: 713-722.
[31] 李彬, 李培军, 王晶, 等. 重金属污染土壤毒性的斜生栅藻生长抑制实验诊断[J]. 应用生态学报, 2002,13(3): 331-334.
[32] 梁英, 冯力霞, 尹翠玲, 等. 叶绿素荧光技术在微藻环境胁迫研究中的应用现状及前景[J]. 海洋科学,2007, 31(1): 71-76.
[33] 梁英, 王帅, 冯力霞, 等. 重金属胁迫对纤细角毛藻生长及叶绿素荧光动力学的影响[J]. 中国海洋大学学报, 2008, 38(1): 59-67.
Effects of heavy metal exposure on the growth and chlorophyll fluorescence of Dunaliella salina
WANG Shuai1,2, LIANG Ying1, FENG Li-xia1, TIAN Chuan-yuan1
(1. The Key Laboratory of Mariculture of Ministry of Education, Ocean University of China, Qingdao 266003,China; 2. The Key Laboratory of Marine Bioactive Substances, The First Institute of Oceanography,SOA, Qingdao 266061,China)
Dec., 10, 2008
Dunaliella salina ;heavy metal stress; chlorophyll fluorescence
The modulate chlorophyll fluorescence kinetics of Dunaliella salina under different concentrations of heavy metals (Cu2+, Zn2+, Cd2+) and different durations (24, 48, 72 and 96 h) were investigated. The main parameters determined in the present study included the maximal photochemical efficiency of PSII (Fv/Fm), the potential activity of PSII(Fv/Fo), the actual photochemical efficiency of PSII in the light (Yield), the relative electron transport rate (rETR), the photochemical quenching (qP), and the non-photochemical quenching (NPQ). The results showed that the parameters of D. salina Fv/Fm, Fv/Fo, Yield, rETR and qP reduced markedly at 600~800 µmol/L by Cu2+, NPQ first decreased then increased, and declined at 400 µmol/L again. The changed degree of the parameters all reduced with the increasing exposure time except qP rose at 96 h; Fv/Fm, Fv/Fo, Yield and rETR reduced under toxic effect by Zn2+, NPQ first decreased then increased, qP declined clearly just at 800~3200 µmol/L by Zn2+, the parameters all decreased with the increasing exposure time; all of the parameters reduced under toxic effect by Cd2+, Fv/Fm, Fv/Foand NPQ first decreased then increased with the increasing exposure time, the data reach to the lowest at 48 h, Yield, rETR and qP decreased all the time.The cell density and chlorophyll content were also decreased under heavy metal stress. The EC50values indicated that the toxicities followed the order of Cu2+>Cd2+>Zn2+.
Q945.78
A
1000-3096(2010)10-0038-11
2008-12-10;
2009-03-12
“十一五”国家科技支撑计划项目(2006BAD09A03); 中国海洋大学海水养殖教育部重点实验室开放课题(200603)
王帅(1983-), 女, 山东济南人, 实习研究员, 主要从事微藻生理研究, E-mail: wangshuai@fio.org.cn, 电话: 13854206061; 通信作者, 梁英, E-mail: yliang@ouc.edu.cn
(本文编辑: 张培新)
