肌注不同剂量环孢霉素A抑制大鼠角膜移植的免疫排斥反应
2010-10-20焦春娜张晓敏赵少贞
焦春娜,张晓敏,赵少贞
(天津医科大学眼科中心,天津 300070)
在所有器官移植手术中,角膜移植的成功率最高。然而移植后的免疫排斥反应仍是导致角膜移植失败的主要原因[1-2]。环孢霉素A(CsA)是真菌的一种代谢物,是目前常用的免疫抑制剂。国内外很多学者已充分论证了CsA在角膜移植术后降低排斥反应的作用,并且已广泛运用于临床。但在角膜移植动物模型中,CsA肌注剂量有所不同[3-5],本实验建立大鼠穿透性角膜移植动物模型,分析肌肉注射不同剂量环孢霉素A对大鼠角膜移植排斥反应的防治作用,以期为下一步动物实验中该药的使用剂量提供理论依据。
1 材料与方法
1.1 实验动物和药品 选成年雌性清洁级Wistar大鼠 (体重200~220 g)作为供体,Lewis大鼠作为受体。大鼠由北京维通利华实验动物技术有限公司提供。CsA购自中国医学科学院血液病研究所。Brdu试剂盒购自罗氏公司。
1.2 实验分组和手术 将33只Lewis大鼠随机分3组,每组l1只。每只动物仅右眼手术。进行Wistar-Lewis鼠间同种异体角膜移植,术前用10%水合氯醛(3ml/kg)腹腔注射麻醉,散瞳,于受体右眼进行穿透性角膜移植手术,植片直径3.5mm,植床3.0mm,l0.0尼龙线(美国Alcon)间断缝合8~12针,术毕注入空气形成前房。剔除伴有手术并发症(包括白内障、严重前房积脓或术后第2天前房仍不能形成)的大鼠,因这些手术并发症会影响移植结果,且容易导致移植排斥的错误诊断。自手术当天开始,每天肌肉注射给药3次,A组给予CsA[1mg/(kg·d)],B组给予CsA[10mg/(kg·d)],C组给予等量不含药物的PBS,连续用药 10 d。
1.3 临床观察排斥反应及判断标准 每组随机选定6只大鼠用于临床排斥评价,其余动物用于T细胞增殖实验。术后第4天至第21天每天在裂隙灯显微镜下观察术眼角膜,以后每周观察两次,直到100 d。参照Larkin等[6]的评分标准,植片混浊0~4级:0级为完全透明;1级为轻度混浊,虹膜纹理清晰可见;2级为中度混浊,部分虹膜纹理可见;3级为虹膜纹理不可见,但可见瞳孔;4级为完全混浊,瞳孔轮廓不清。植片水肿0~2级:0级为无水肿;1级为中度水肿;2级为伴有植片增厚的显著水肿。植片新生血管0~4级:0级为无新生血管;1级为新生血管在任何象限伸入达到植片半径的25%;2级为新生血管达到植片半径的50%;3级为新生血管达到植片半径的75%;4级为新生血管达到植片半径的中央。移植排斥定义为术后曾经透明的移植片出现中等或严重混浊、水肿以及血管化,其中混浊程度≥3,并且总评分≥5。在100 d后移植片仍能保持透明被视为长期存活。
1.4 角膜组织学检查 各组于术后第10天随机取4只大鼠,过量麻醉后取右眼角膜,进行角膜组织切片的HE染色。
1.5 T细胞增殖实验 每组其余大鼠用于取材,术后10 d处死,收集脾脏,分离单个核细胞,以5×105细胞/孔接种于96孔板,在加有10μg/mlConA的RPMI-1640培养液中,37℃、5%CO2条件下孵育 66 h,然后每孔加入终浓度为10μmol的BrdU培养18 h。培养板离心后干燥细胞,FixDenat溶液孵育30min,抗BrdU-POD孵育90min,显色,酶标仪测定。
1.6 统计学方法 实验数据应用SPSS 11.5统计软件进行分析处理,应用Kaplan-Meier检验比较3组植片平均存活时间,应用单因素方差分析比较3组新生血管和T细胞增殖情况的差异。以P<0.05为有统计学意义。
2 结果
2.1 实验动物数量分析 纳入33只大鼠,其中1只发生前房积脓,2只出现白内障,予以剔除。
2.2 各组受体大鼠角膜植片的存活情况 A、B组角膜植片的存活时间与C组比较均显著延长(P<0.01),B组优于A组(P<0.01)。见表1。
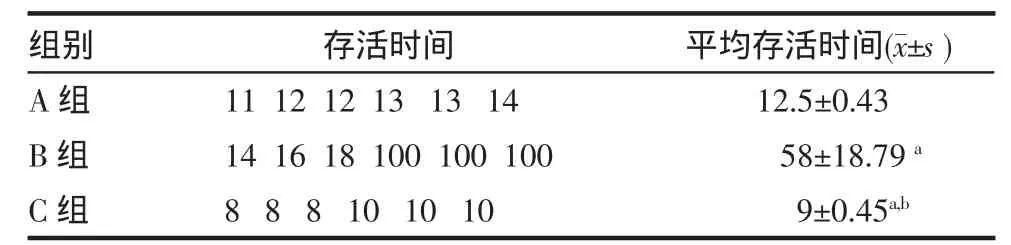
表1 各组受体大鼠角膜植片的存活时间(n=6,d)
2.3 各组角膜新生血管评分比较 对各时间点3组新生血管评分进行统计学分析,A、B组新生血管的评分均低于C组。第6天,C组与A、B组比较差异有统计学意义 (P=0.01),A组与B组无显著性差异(P>0.05)。其余时间点,虽然A组的新生血管评分较C组值低,但差异无统计学意义,B组与A、C组比较差异有显著性(P<0.05),见表2。
表2 3组术后各时间点角膜新生血管评分比较( )

表2 3组术后各时间点角膜新生血管评分比较( )
a P<0.05 vs A 组;b P<0.05 vsB 组
12 d 2.5±1.52 0.816±0.33a 3.17±0.98 b组别A组B组C组6 d 0.17±0.41 0.17±0.41 1.33±1.03 a,b 24 d 3.50±0.84 1.5±1.76 a 4.00±0.00b 18 d 3.33±1.21 1.00±1.26 a 3.83±0.41 b
2.4 各组角膜植片HE染色 见图1。

2.5 各组受体大鼠脾脏T细胞增殖情况 对各组的T细胞增殖作统计学分析,A组(0.49±0.07)、B组(0.16±0.03)与 C 组(0.64±0.10)比较有显著性差异(P<0.01),A组与B组比较差异有统计学意义(P<0.01)。
3 讨论
角膜具有众多特殊的免疫赦免机制,如缺乏血管、淋巴管以及抗原递呈细胞,前房相关免疫偏离(ACAID)以及CD95L的表达等,相比其它器官移植手术,角膜移植排斥反应发生率较低。尽管如此,仍有大约30%的病例会发生排斥反应,最终导致5%~7%的病例移植失败[7-8]。角膜移植排斥反应主要是以CD4+T细胞介导的细胞免疫应答,主要过程如下:抗原递呈细胞(APCs)在促炎性因子、粘附分子以及趋化因子的作用下,由角膜缘以及角膜周边移行到角膜中央,摄取和处理供体抗原,然后转移至引流淋巴结,激活初始T细胞;T细胞增殖,进而分化为效应细胞,攻击角膜内皮,基质以及上皮;角膜的免疫赦免机制被打破,植片基质和内皮受损,最终导致移植失败[9-10]。在角膜移植排斥反应的治疗方面,目前仍然是以糖皮质激素和环孢素A为主。但长时间应用糖皮质激素,可导致全身副作用及青光眼、白内障等局部并发症的发生[11]。一般认为CsA选择性抑制静止期辅助性T淋巴细胞(Th)的分化增殖,抑制T细胞由G0期向G1期转变,从而抑制Th细胞的抗原呈递过程,并抑制白介素2(IL-2)和γ-干扰素的产生,减少角膜移植术后的排斥反应[4]。但CsA分子量大,且为疏水性,眼内通透性差,影响其局部用药的疗效。
在本研究中,体外实验结果显示10mg/(kg·d)CsA与1mg/(kg·d)CsA均能抑制T细胞增殖,但高剂量组效果更为明显。体内实验显示高剂量组新生血管评分低于小剂量CsA治疗组和空白对照组。虽然小剂量组的新生血管评分低于空白对照组,但除在第6天时两者有显著性差异外,其余时间点均无统计学意义。10mg/(kg·d)CsA较其它两组显著延长了角膜移植物的存活。
CsA是一种强效免疫抑制剂,是目前治疗角膜移植术后免疫排斥反应的主要药物。CsA全身用药毒性严重,可能引起肝、肾毒性等副作用,限制了其在临床的应用。临床上主要使用局部滴眼剂的给药方法,普通的滴眼液通透性差,近年被制成眼膏、眼剂、乳剂、胶原罩、脂质体、微粒体、纳米等新型眼用制剂。在角膜移植及其它器官移植动物模型中,CsA全身应用比较多见,但其应用的剂量有所不同。本实验旨在为我们下一步大鼠角膜移植动物模型中该药的使用剂量提供理论依据。
[1]Bourges JL,Lalle PA,VanathiM,et al.Corneal graft rejection[J].SurvOphthalmol,2007,52(4):375
[2]余洪华,陆晓和.CD28/CTLA4-B7协同刺激分子与角膜移植免疫[J].眼科新进展,2005,25(5):476
[3]Dios E,Herreras JM,ScD AM,et al.Efficacy of systemic cyclosporine A and amnioticmembrane on rabbit conjunctival limbal allograft rejection[J].Cornea,2005,24(2):182
[4]Bourges JL,Lallemand F,Agla E,etal.Evaluation of a topical cyclosporine A prodrug on cornealgraft rejection in rats[J].Molecular Vision,2006,12(2):1461
[5]Vítová A,Filipec M,Zajícová A,et al.Prevention of corneal allograft rejection in amousemodelofhigh risk recipients[J].Br JOphthalmol,2004,88(10):1338
[6]Larkin DF,Calder VL,Lightman SL.Identification and characterization ofcells infiltrating thegraftand aqueoushumor in ratcorneal graft rejection[J].Clin Exp Immunol,1997,107(2):381
[7]谢立信,史伟云,王治宇,等.前房植入环孢素A缓释系统抑制鼠高危角膜移植术后的免疫排斥反应 [J].中华眼科杂志,2002,38(7):422
[8]史伟云,谢立信.细胞毒T淋巴细胞相关抗原4免疫球蛋白抑制鼠高危角膜移植免疫排斥反应的实验研究 [J].中华眼科杂志,2004,40(10):696
[9]Lam H,Dana MR.Corneal graft rejection[J].Int 0phthalmol Clin,2009,49(1):31
[10]Chong EM,DanaMR.Graft failure IV.Immunologicmechanismsof corneal transplant rejection[J].IntOphthalmol,2008,28(3):209
[11]Tabbara KF.Pharmacologic strategies in the prevention and treatment of corneal transplant rejection[J].IntOphthalmol,2008,28(3):223
