禽IL-2与传染性法氏囊VP2融合蛋白免疫学特性
2010-10-16王臣赵战勤张春杰刘一尘丁轲李银聚程相朝陈溥言
王臣,赵战勤,张春杰,刘一尘,丁轲,李银聚,程相朝,陈溥言
1 河南科技大学 动物传染病与微生物实验室,洛阳 471003 2 南京农业大学 农业部动物疫病与诊断重点实验室,南京 210095
禽IL-2与传染性法氏囊VP2融合蛋白免疫学特性
王臣1,2,赵战勤1,张春杰1,刘一尘1,丁轲1,李银聚1,程相朝1,陈溥言2
1 河南科技大学 动物传染病与微生物实验室,洛阳 471003 2 南京农业大学 农业部动物疫病与诊断重点实验室,南京 210095
为研究禽细胞因子IL-2与IBDV主要保护性抗原VP2基因融合蛋白的免疫学特性,将重组的rVP2-IL-2融合蛋白免疫鸡,通过IBDV-VP2 ELISA抗体效价、抗体亚型(IgG1和IgG2a)、淋巴细胞增殖、INF-γ和IL-4细胞因子的分泌水平、中和抗体以及动物攻毒试验检测评价其对鸡体免疫水平的影响。抗体滴度测定和淋巴细胞增殖试验结果显示,rVP2-IL-2融合蛋白免疫鸡体的体液和细胞免疫应答水平均明显高于单独的VP2蛋白免疫组。抗体亚型测定结果显示,rVP2-IL-2融合蛋白免疫组鸡体能产生一个平衡的IgG1和IgG2a抗体反应。细胞因子ELISA试验结果表明rVP2-IL-2融合蛋白能有效平衡 Th1(γ-IFN)和 Th2(IL-4)类型的细胞免疫反应。动物攻毒试验 rVp2-IL-2融合蛋白免疫组鸡体获得了85%的保护率,表明构建的rVP2-IL-2融合蛋白对IBDV的攻击具有较好的免疫保护作用。本研究为进一步研制IBD高效的基因工程疫苗奠定了基础。
传染性法氏囊,VP2基因,IL-2,融合蛋白
Abstract:In order to research immunogenicity of the recombinant rVP2-IL-2 fusion protein, we obtained the rVP2-IL-2 fusion protein usingPichia pastorisexpression system, and then evaluated its potential to induce immune responses in chicken.The effect was determined in the form of protective anti-IBDV VP2 titers, antibodies(IgG1 and IgG2a), lymphocyte proliferation, the levels of interferon-γ and interleukin-4 cytokines, and challenge experiment.Antibody titers and proliferation lymphocyte level suggested that the fusion protein could elicit specific humoral immune and cellular immune responses.antibody sub-type results indicated that the rVP2-IL-2 fusion protein induced secretion both of IgG1 and IgG2a.The seem result elicited from cytokines ELISA test, secretion of both of Th1(γ-IFN)and Th2(IL-4)were induced by the rVP2-IL-2 fusion protein.Challenge experiment result shown that chicken immunized the rVP2-IL-2 fusion protein obtained 85% protection.These results confirm that the fusion protein enhances the protection against IBDV through both humoral and cell-mediated immunity, and thus could serve as a candidate for the developmentof IBDV subunit vaccine.
Keywords:infectious bursal disease virus(IBDV),VP2gene, IL-2, fusion protein
传染性法氏囊病(Infectious bursal disease,IBD)是由传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)引起的幼鸡和青年鸡的一种急性、高度接触性传染病,发病率高,病程短。临床上主要表现为间歇性腹泻、厌食、高度虚弱、体重减轻和电解质平衡紊乱。病变特征主要为脱水、肌肉出血、肾脏尿酸盐沉积和法氏囊肿大。尤其是IBDV主要侵害鸡的体液免疫中枢——法氏囊,从而导致免疫抑制,降低机体对其他传染病的免疫反应,使机体对其他病毒病和细菌性疾病的易感性增高[1]。该病的复杂性和潜在的威胁引起了兽医界的广泛关注,并逐渐成为各国兽医科技工作者研究的焦点之一。对于传染性疫病的控制,目前普遍认为免疫接种是简单而又有效地途径。但是实际生产过程中,免疫失败时常发生。分析其原因,除了有关疫苗接种因素外,强毒株、超强毒株和变异株的存在,使疫苗不能提供有效地免疫保护。或者在接种的同时,环境中存在数量较大的野毒株,在机体还未产生高水平抗体之前,就被野毒株感染,这样势必也导致免疫失败。IBDV属于双链双节段RNA病毒,A节段包括两个部分重叠的开放阅读框架(ORF1和ORF2)。ORF1编码的多聚蛋白前体经加工剪切形成 3个成熟的蛋白 VP2、VP4和VP3,VP2不仅是病毒的主要结构蛋白,还是病毒的主要宿主保护性抗原,与病毒的抗原漂移、毒力变异、中和抗体的诱导和细胞凋亡有关[2-3]。
应用细胞因子作为免疫佐剂能提高各种免疫反应的强度和速度。IL-2是一种糖蛋白,能诱导T淋巴细胞的克隆增殖和活化,伴随抗原刺激后产生记忆效应,而且还能和其他淋巴因子协同作用,诱导B淋巴细胞的克隆和增殖,诱导产生抗体的浆细胞和记忆细胞分化。所有这些特点,都是IL-2作为疫苗佐剂的理论依据。
本研究以酵母为载体融合表达 IBDV主要保护抗原 VP2基因和禽细胞因子 IL-2,用重组的rVP2-IL-2靶向融合蛋白免疫鸡,通过对其免疫学特性的检测。评价其对鸡体的特异性细胞免疫和体液免疫水平的影响,为进一步提高 IBDV基因疫苗的免疫效果,开发新型IBDV疫苗奠定基础。
1 材料与方法
1.1 材料及试验动物
酵母表达的重组蛋白 rVP2、rIL-2、rVP2-IL-2为本课题组制备[4-5]。辣根过氧化物酶标记的羊抗鸡IgG购自中山公司。HRP标记的羊抗鸡IgG1和IgG2a购自Caltag Laboratories公司。四甲基偶氮唑盐(MTT)、淋巴细胞分离液为上海生物工程公司产品。细胞因子含量测定ELISA试剂盒购自武汉中美生物工程公司。RPMI-1640培养基、刀豆蛋白 A(ConA)、乙酸豆蔻佛波醇(PMA)、ConA、PMA以RPMI-1640培养液配制成 1 g/L的溶液,MTT以RPMI1640培养液配制成5 g/L的溶液,过滤除菌,−20℃保存备用。IBDV标准强毒株BC6/85购自中国兽药监察所,毒价为10−5.88ELD50/0.2 mL。血清中和试验用毒株、IBDV-L017株为本室由L017鸡胚适应株于鸡胚成纤维细胞上反复传代、驯化而成的细胞适应毒,其毒价为10−6.86/TCID50/0.1 mL。IBD抗原由本室应用多株地方野毒株的法氏囊组织悬液所制备,AGP效价为 1∶64。中等毒力的活疫苗为B87毒株冻干活疫苗。1日龄非免疫罗曼雏公鸡由洛阳市新安县现代化鸡场提供,免疫试验20日龄前经琼扩试验和抗体中和试验检测证实无 IBDV母源抗体。其他试剂均为国产或进口分析纯。
1.2 方法
1.2.1 动物的分组与免疫
将200只20日龄的非免疫罗曼雏公鸡随机分成5组,40只/组,各组均隔离饲养。第1组为阴性对照,免疫200 μL PBS;第2组、第3组、第4组分别免疫200 pmol的rIL-2、rVP2、rVP2-IL-2重组蛋白(用200 μL PBS稀释)。采用胸部肌肉注射方式进行免疫;第5组为B87毒株冻干活疫苗对照,采用滴鼻、点眼的途径免疫200 μL;所有组间隔2周免疫1次,共免疫3次。并分别于免疫接种后第0、7、14、21、28、35、42天时各随机抽取5只心脏采血,分离血清。
1.2.2 抗IBDV血清ELISA抗体效价的测定
抗IBDV血清ELISA抗体效价的测定采用间接ELISA法。以IBDV标准抗原包被酶标板,依次加入不同稀释度的各试验组免疫鸡血清,温育、洗涤,然后加入HRP标记的兔抗鸡IgG,温育、洗涤同上。最后用TMB底物显色,在酶标仪上读取OD450值。
1.2.3 IBDV抗体亚型检测
首免后 7 d、21 d、35 d分离的血清检测IBDV-VP2抗体,用0.05 mol/L carbonate buffer pH 9.6(CBS)稀释重组 IBDV-VP2蛋白至 10 mg/L,加入96孔酶标板中,每孔100 µL,4℃过夜包被,后用PBST洗涤3次。用1%BSA于室温下封闭3 h,PBST洗涤3 次。加入1∶10~1∶105稀释的鸡血清(每孔100 μL)作用1 h,再次以PBST洗涤3次。加入1∶2000稀释的过氧化物酶标记的羊抗鸡 IgG1、IgG2a(每孔 100 μL)作用 1 h,PBST 洗涤 3 次,拍干,加入现配的TMB显色液(每孔100 μL),室温避光反应20 min后,以2 moL/L H2SO4终止反应。在酶标仪上读取 OD450。每个血清稀释度对应一个ELISA OD值,绘制血清稀释度(log scale)对应OD值曲线。通过拟合曲线回归分析half maximal OD时的血清稀释度。计算该血清稀释度的logarithm值来作为实验结果。每个血清滴定重复3次。
1.2.4 中和抗体的测定
常规方法制备鸡胚成纤维细胞,然后按照文献[6]的介绍,采用固定病毒稀释血清的方法,测定中和抗体效价,将 IBDV-L017细胞适应毒株应用Hank's液稀释成含100 TCID50的病毒悬液。将血清应用 Hank's液在 96孔细胞培养板上作倍比系列稀释(1∶10~1∶10 240),按需要分别取不同的稀释度与病毒液进行中和。取每个血清样品的不同稀释度100 µL与等量病毒悬液于96孔反应板各反应孔中,37℃温箱中和1 h。弃去已长满单层细胞的96孔板上的营养液,分别取每个稀释度的病毒血清中和物接种于单层细胞上,20 µL/孔。每个稀释度接5孔,置37℃、CO2培养箱中吸附1 h。吸附后的细胞单层上加维持液,180 µL/孔,置37℃、CO2培养箱中继续培养,每天观察2 次,至96 h,记录细胞病变情况,按Reed-Muench法计算出每个血清样品的中和保护效价,然后计算 5个血清样品中和保护效价的平均数,即为该采血日龄血清的中和抗体效价(GMT 值)。
1.2.5 法氏囊B淋巴细胞增殖试验
参照文献[7]的方法,在96孔微量培养板上,每孔加入50 μL含600 ng/mL PMA的RPMI-1640培养液(对照孔只加RPMI-1640培养液),再取50 μL各法氏囊淋巴细胞悬液于每个孔内(PMA终浓度为300 ng/mL),每个样品加2孔,5% CO2培养箱40℃培养21 h后,加入10 μL MTT(5 g/L)继续培养3 h,再加入10% SDS-0.01 moL/L HCl溶液100 μL,吹打混匀,继续培养 2 h后,以对照孔调零,在酶标仪上测定570 nm时各孔的OD570值。
1.2.6 胸腺T淋巴细胞增殖试验
参照文献[8]和[9]的方法,在 96 孔微量培养板上,每孔加入50 μL含40 mg/L ConA的RPMI-1640培养液(对照孔只加RPMI1640培养液),再取各胸腺淋巴细胞悬液50 μL于每个孔内(ConA终浓度为20 μg/mL),每个样品加 2 孔,5% CO2培养箱 40℃培养48 h后,加入10 μL MTT(5 g/L)继续培养3 h,再加入 10% SDS-0.01 mol/L HCl溶液 100 μL,吹打混匀,继续培养 2 h后,以对照孔调零,在酶标仪上测定570 nm时各孔的OD570值。
1.2.7 血清中IL-4和IFN- γ的测定
二次加强免疫后1 周分离血清检测免疫后鸡血清中IL-4和IFN-γ的含量,应用商品化的鸡细胞因子试剂盒检测。按试剂盒说明书进行操作。每次分析时,使用对照的重组细胞因子标准品绘制标准曲线,通过标准曲线来计算血清样品中细胞因子的含量。
1.2.8 动物攻毒保护试验
最后一次免疫后1周,试验组鸡各取20只,分别攻击中国标准强毒株BC6/85株(100 ELD50/只),同时设置空白对照组隔离饲养,攻毒后连续观察7 d,分别记录各毒株接种鸡7 d内的死亡数,并对7 d后存活鸡进行剖检,称取各法氏囊、脾脏及总体重,计算法氏囊/体重、脾脏/体重,并观察病理剖检变化。
1.2.9 法氏囊病理组织学观察
取10%甲醛固定后的试验鸡法氏囊,常规法石蜡包埋、切片,苏木精-伊红染色,镜检,观察法氏囊的病理组织学变化。
1.2.10 数据分析
采用SPSS 11.5统计软件对实验数据进行分析,实验数据用±s表示,多组间比较应用单因素方差分析(One way-ANOVA),组间两两比较应用最小显著差(LSD)t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 IBDV VP2抗体和抗体亚型检测
各免疫组血清抗体效价动态规律如图1所示。首免后7 d内各试验组所诱导产生的抗IBDV血清ELISA抗体效价较低,且相互之间并无明显差别。各试验组在首免后3周内抗IBDV血清ELISA抗体效价均呈现上升趋势,第 5周抗体水平达到最高,但rVP2免疫组抗IBDV血清ELISA抗体效价明显低于其他各试验组(P<0.05)。rVP2-IL-2组诱导产生的抗IBDV血清ELISA抗体效价在第1周到第5周内均高于rVP2组。且rVP2-IL-2融合蛋白免疫效果接近于疫苗对照组。在整个实验过程中,正常PBS和IL-2对照组未检测到抗IBDV特异性抗体。
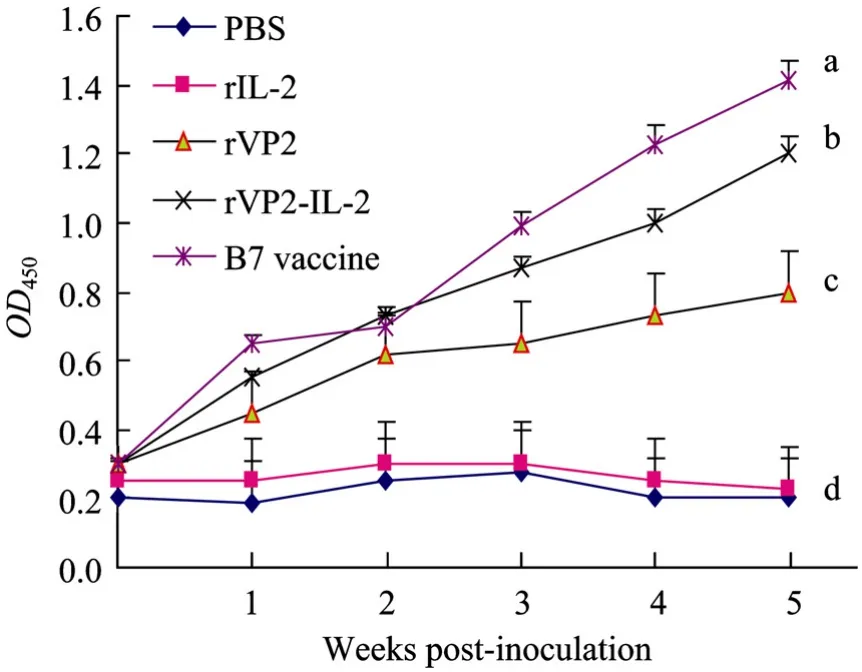
图1 各免疫组外周血抗IBDV血清ELISA抗体效价动态规律观察Fig.1 Peripheral blood anti-IBDV ELISA antibody levels of chickens immunized with different vaccines.Data were expressed as the mean ±standard error(S.E.).Statistically significant differences(P< 0.05)are indicated with different letters.
相对于 IgG1水平和 IgG2a抗体反应(图2A、2B),IgG1抗体是 rVP2免疫组鸡的主要的抗体亚型,然而,使用 rVP2-IL-2融合蛋白免疫组鸡能产生一个平衡的IgG1和IgG2a抗体反应。特别是在第2次加强免疫后。观察到占优势的IgG1和IgG2a抗体的水平,表明IL-2能有助于rVP2-IL-2融合蛋白免疫组鸡体产生一个平衡的IgG1和IgG2a抗体反应。
2.2 MTT分析
从第一次免疫后第 1、3、5周无菌采取各试验鸡的胸腺、法氏囊,检测淋巴细胞的增殖情况。结果显示(图3A),免疫rVP2-IL-2融合蛋白组诱导法氏囊B淋巴细胞增殖能力最强;图3B显示rVP2-IL-2免疫组诱导胸腺T淋巴细胞增殖能力最强,其他组依次为rIL-2免疫组、Vaccine免疫组、rVP2免疫组和PBS对照组。
2.3 病毒中和试验
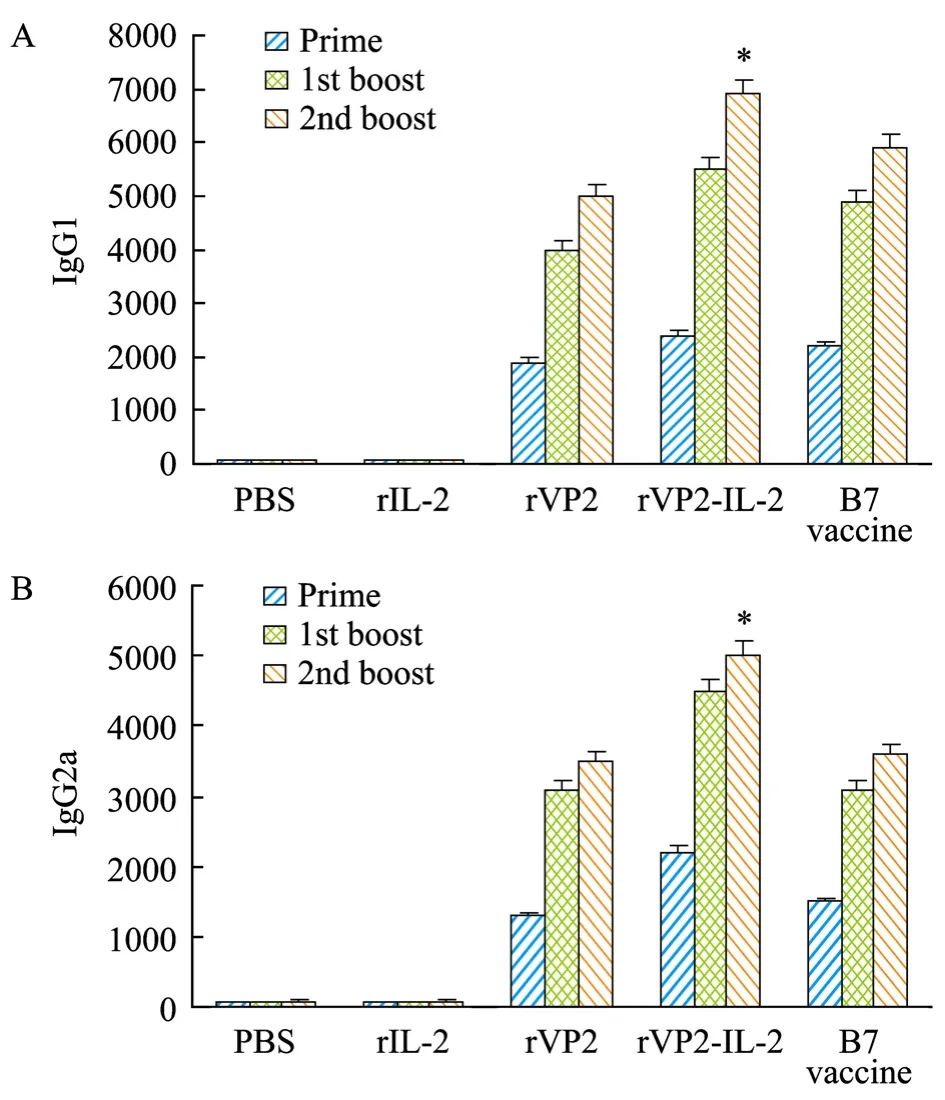
图2 IBDV抗体亚型分析Fig.2 Analysis of IBDV IgG isotypes.Prime-boost-boost vaccinations(day 0, day 14 and day 28)were carried out.On day 7(prime), day 21(first boost)and day 35(second boost)sera were taken and VP2-specific immunoglobulin isotypes were analyzed by ELISA.IgG1 and IgG2a titers(Half-Max titer)±standard deviation assayed in triplicates are given.Data shown are representative of two separate experiments.
各试验组免疫后的中和抗体动态变化规律见图4。各试验组的血清中和抗体效价均随时间的推移而稳定上升,并在免疫后21 d迅速爬升,至42 d达到峰值。rVP2-IL-2免疫组在 28 d后抗体效价显著高于 rVP2组(P<0.05),在整个试验的检测过程中,疫苗组抗体效价显著高于其他各试验组(P<0.05),但rVP2-IL-2免疫组在免疫后42 d抗体效价略低于疫苗组,但仍有明显差异(P<0.05)。
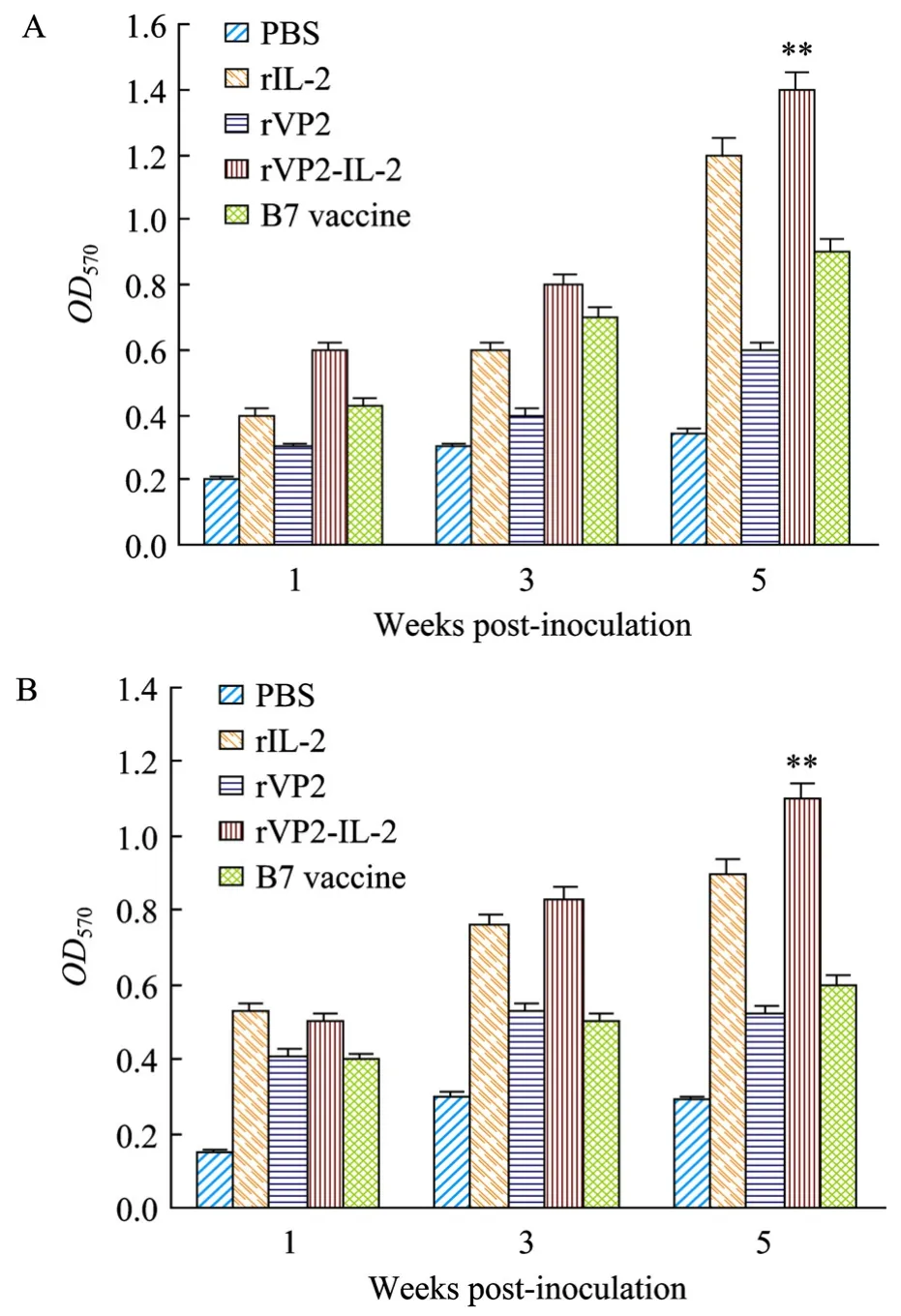
图3 免疫重组蛋白后的淋巴细胞增值情况Fig.3 Lymphocyte proliferation response of chicken after vaccination with vaccines.Data were expressed as the mean±standard error(S.E.).Standard group is rVP2, **P< 0.01,*P< 0.05.
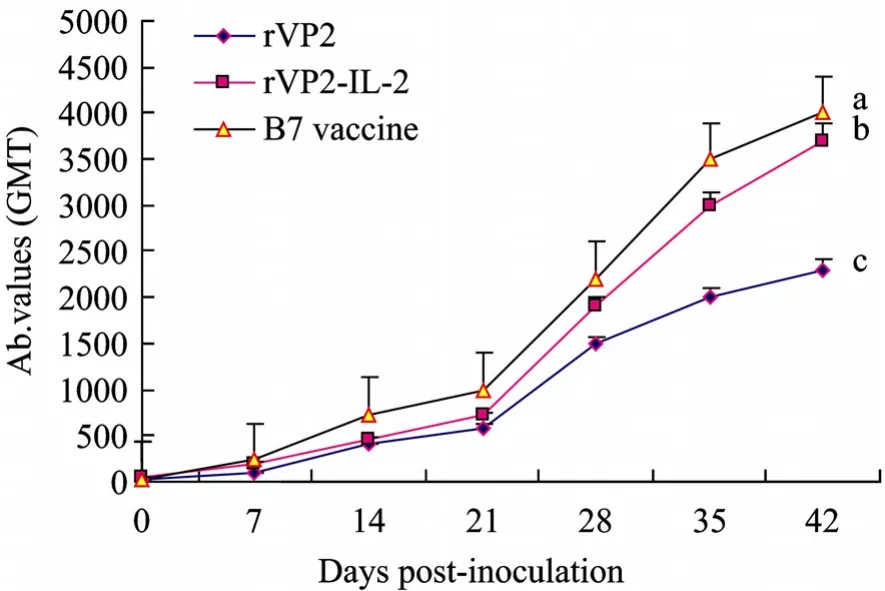
图4 各免疫组诱导的中和抗体动态变化规律Fig.4 Neutralization antibody responses of chickens immunized with vaccines.Data were expressed as the mean ±standard error(SE).Statistically significant differences(P<0.05)are indicated with different letters.
2.4 血清中IL-4和IFN-γ的测定
应用定量ELISA对血清中的IL-4和IFN-γ进行定量分析显示,rVP2-IL-2融合蛋白免疫组诱导IL-4和IFN-γ的分泌在各免疫组最强,差异极显著(P<0.01)。其次是rIL-2免疫组,B7 Vaccine免疫组和 rVP2免疫组诱导两种细胞因子的分泌水平明显低于rIL-2免疫组,差异显著(P<0.05)(图5)。表明 rVP2-IL-2融合蛋白能有效平衡 Th1(γ-IFN)和Th2(IL-4)类型的细胞免疫反应。
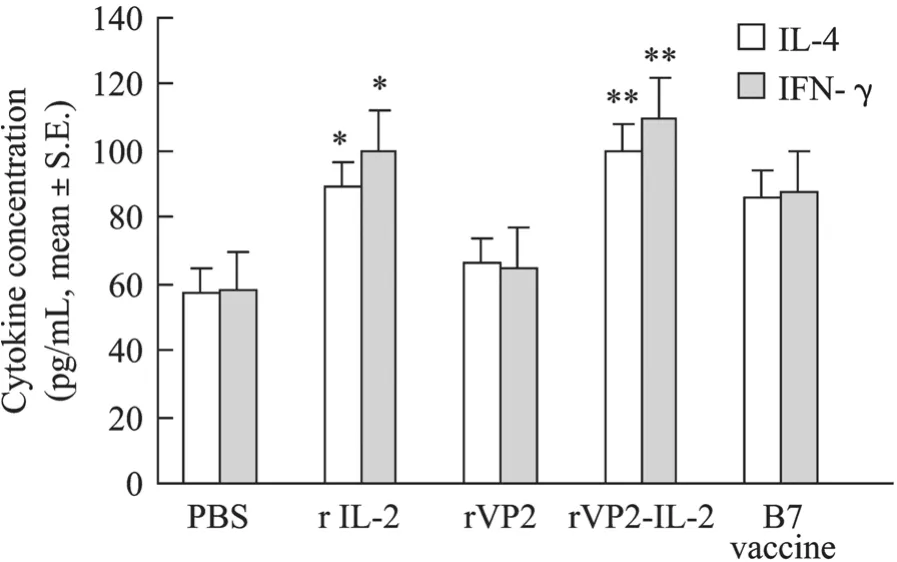
图5 细胞因子检测Fig.5 Cytokine responses to vaccination.Th1 type Cytokine IFN-γ(pg/mL)and Th2 type Cytokine IL-4(pg/mL)expressed as the mean ±standard error.Data shown are representative of four separate experiments.Standard group is rVP2, ** significant asP< 0.01, * significant asP< 0.05.
2.5 攻毒试验结果
各免疫组于最后一次免疫后1 周,分别攻击中国标准强毒株BC6/85株(100 ELD50/只),结果如表1所示,rVP2组的攻毒保护率仅为 60%,而rVP2-IL-2组为85%,说明rVP2-IL-2融合蛋白的免疫保护效果优于单独的VP2蛋白免疫组。攻毒对照组(PBS组、rIL-2组)均出现IBD典型的临床症状、病理变化和组织学病变。
3 讨论
传统的 IBDV疫苗主要是以刺激机体产生持久的中和抗体为特点。灭活苗或亚单位疫苗主要诱导机体的体液免疫而不是细胞免疫。本实验通过抗体滴度测定和淋巴细胞增殖试验结果显示,rVP2-IL-2组诱导产生的抗IBDV血清ELISA抗体效价在第1周到第5 周内均高于rVP2组。且rVP2-IL-2融合蛋白免疫效果接近于疫苗对照组。这说明ChIL-2能与IBDV VP2蛋白发挥相互协同作用,提高VP2诱导的抗IBDV血清ELISA抗体效价。同时,MTT法检测试验鸡 T、B淋巴细胞对ConA、PMA的反应均强于单独的VP2蛋白免疫组,从接种后第7天开始即与单独的 VP2蛋白接种组差异明显(P<0.05)。rVP2-IL-2融合蛋白免疫鸡体的体液免疫应答和细胞免疫应答水平均明显高于单独的 VP2蛋白免疫组,表明细胞因子发挥了明显的免疫佐剂效应。
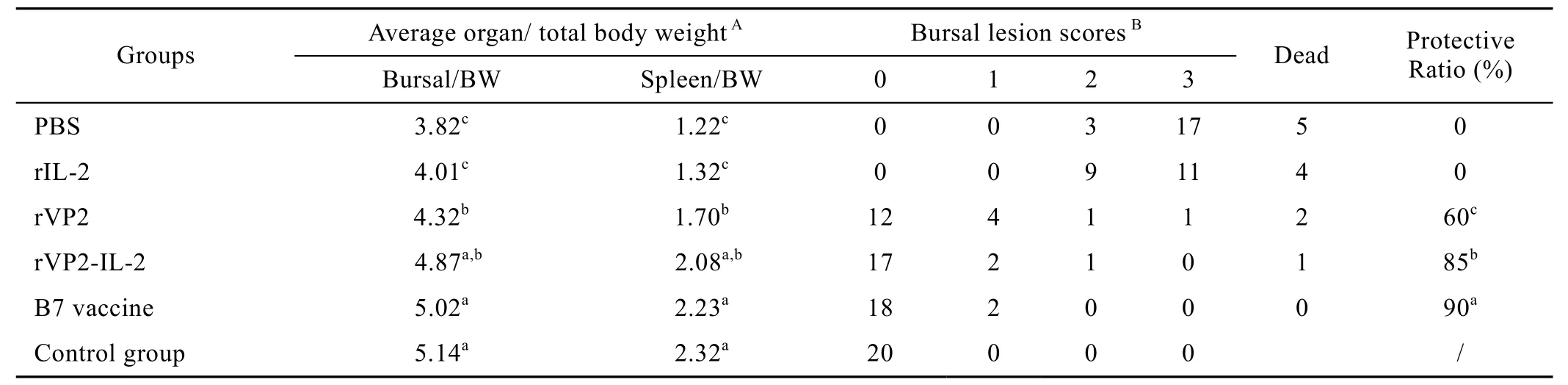
表1 各免疫组对强毒株BC6/85的攻击保护效果比较Table 1 Comparison of protective immune responses of different vaccine immunized chickens challenged by virulent strain BC6/85
抗体亚型测定结果显示,相对于 IgG1水平和IgG2a抗体反应,IgG1抗体是rVP2免疫组鸡的主要的抗体亚型,然而,使用rVP2-IL-2融合蛋白免疫组鸡能产生一个占优势的IgG1和IgG2a抗体的水平。IgG2a是 Th1类免疫反应代表的抗体分子,其类别转换主要由IFN-γ来实现的,IgG2a与巨噬细胞表面高亲和力的FcγR I受体结合,参与巨噬细胞介导的宿主防御反应,巨噬细胞可以直接消除各种异物,杀伤细胞内的病原体和肿瘤细胞。而IgG1抗体主要介导吞噬细胞(如肥大细胞和嗜酸性粒细胞)的防御作用。细胞因子 ELISA试验结果表明 rVP2-IL-2融合蛋白能有效诱导IFN-γ的分泌。提示rVP2-IL-2融合蛋白有可能是通过 IFN-γ水平的升高来平衡IgG1和IgG2a的分泌水平。细胞因子多为辅助性T细胞分泌。辅助性T细胞(Th细胞)是根据功能分类的一个T细胞亚群,按分泌的细胞因子不同分为Th0、Thl、Th2三个亚型,Th0细胞是未成熟的前体细胞,既可分泌Thl类细胞因子又可分泌Th2类细胞因子。Th1 细胞偏向于分泌 IL-2、IFN-γ、TNFα/β,介导细胞免疫反应和CTL 应答,清除细胞内细菌和病毒;Th2细胞偏向于分泌IL-4、IL-5、IL-6和IL-10,协助 B细胞产生 IgE,在体液免疫中起重要作用。Thl、Th2细胞分泌的细胞因子可互相调控生长分化。Thl 细胞分泌的IFN-γ可抑制Th2细胞增殖;Th2细胞分泌的IL-4、IL-10均可下调Thl细胞的活性[10-11],Th1类细胞因子与Th2类细胞因子构成了一个相互影响相互制约的免疫网络[12]。实验中用VP2抗原单独免疫诱导两种细胞因子的分泌水平较低,而rVP2-IL-2融合蛋白能明显提高VP2抗原免疫后两种类型细胞因子的分泌水平,表明 VP2-IL-2融合蛋白能有效平衡Th1和Th2类型的细胞免疫反应。
有研究表明,IBDV-VP2特异性抗体水平往往和保护率呈直接的相关关系[13-14]。本研究中,免疫rVP2-IL-2融合蛋白的鸡群在攻毒前其中和抗体水平比 IBDV活疫苗对照组低,在整个实验过程中,抗IBDV血清ELISA抗体效价也明显低于IBDV活疫苗。但其保护效果却相当。这些结果提示细胞免疫在IBDV疫苗的保护中也起到了关键作用。
本试验构建的 rVP2-IL-2融合蛋白能有效激发鸡体免疫系统产生抵抗 IBDV强毒攻击的反应,鸡体获得了85%的保护率,表明构建的rVP2-IL-2融合蛋白对 IBDV的攻击具有较好的免疫保护作用。本研究为进一步研制高效的基因工程疫苗用于 IBD的防制奠定了基础。
REFERENCES
[1]Cao YC, Yeung WS, Law M,et al.Molecular characterization of seven Chinese isolates of infectious bursal disease virus: classical, very virulent, and variant strains.Avian Dis, 1998, 42(2): 340–351.
[2]Yehuda H, Pitcovski J, Michael A,et al.Viral protein 1 sequence analysis of three infectious bursal disease virus strains: a very virulent virus, its attenuated form, and an attenuated vaccine.Avian Dis, 1999, 43(1): 55–64.
[3]Mundt E.Tissue culture infectivity of different strains of infectious burse virus of determined by distinct amino acids in VP2.J Gen Virol, 1999, 80(8): 2067–2076.
[4]Zhang CJ, Wu TC, Li YJ,et al.Cloning and characterization of the VP2 gene of variable IBDV strain.Chin J Vet Sci, 2004, 24(9): 433–435.张春杰, 吴庭才, 李银聚, 等.IBDV地方变异株VP2基因的克隆与特性鉴定.中国兽医学报, 2004, 24(9):433–435.
[5]Gong T.Study on eukaryotic and prokaryotic the expression of the whole gene and the gene without signal peptide of the chicken interleukin-2.Gansu Agricultural University, 2008.龚婷.鸡IL-2cDNA及其去信号肽cDNA的原核和酵母表达研究.甘肃农业大学, 2008.
[6]Zhang CJ, Cheng XC, Li YJ,et al.Construction of eukaryotic expression plasmids encoding IL-18 and study on its immunoenhancement on infectious bursal disease vaccine.Chin J Immunol, 2004, 20(9): 617–621.张春杰, 程相朝, 李银聚, 等.鸡IL-18真核表达载体的构建及其对IBD灭活疫苗免疫增强作用的研究.中国免疫学杂志, 2004, 20(9): 617–621.
[7]McNeilly F, Walker I, Allan GM,et al.Bursal lymphocyte proliferation in the presence of phorbol myristate acetate:effect of IBDV strains on the proliferation response.Avian Pathol, 1999, 28(3): 301–303.
[8]Mosmann T.Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays.J Immunol Methods, 1983, 65(1/2): 55–63.
[9]Li JR, Yu L, Huang YW,et al.Study on immunogenicity of plasmid DNA encoding polyprotein(VP2/VP4/VP3)of infectious bursal disease virus formulated with ISCOM.Chin J Virol, 2001, 17(4): 341–348.李建荣, 于涟, 黄耀伟, 等.ISCOM 介导的传染性法氏囊病病毒多聚蛋白基因免疫的研究.病毒学报, 2001,17(4): 341–348.
[10]Ferrara JL.Cytokines and the regulation of tolerance.J Clin Invest, 2000, 105(8): 1043–1044.
[11]Roncarolo MG, Levings MK.The role of different subsets of T regulatory cells in controlling autoimmunity.Curr Opin Immunol, 2000, 12(6): 676–683.
[12]Agrawal S, Agrawal A, Doughty B,et al.Cutting edge:different Toll-like receptor agonists instruct dendritic cells to induce distinct Th responses via differential modulation of extracellular signal-regulated kinase-mitogen-activated protein kinase and c-Fos.J Immunol, 2003, 171(10):4984–4989.
[13]Liu Y,Wei Y,Wu X,et al.Preparation of ChIL-2 and IBDV VP2 fusion protein by baculovirus expression system.Cell Mol Immunol, 2005, 2(3): 231–235.
[14]Nakamura T, Otaki Y, Lin Z,et al.Direct correlation between the titer of infectious bursal disease virus VP2 specific antibody and protection.Avian Dis, 1994, 38(2):251–255.
Influence of fusion protein of IBDV VP2 and chicken Interleukin-2 on immune response in chicken
Chen Wang1,2, Zhanqin Zhao1, Chunjie Zhang1, Yichen Liu1, Ke Ding1, Yinju Li1,Xiangchao Cheng1, and Puyan Chen2
1 College of Animal Science and Technology, Henan University of Science and Technology, Luoyang 471003, China 2 Key Laboratory of Animal Disease Diagnosis and Immunology, Nanjing Agricultural University, Nanjing 210095, China
Received:October 10, 2009;Accepted:March 15, 2010
Supported by:Scientific and Technological Project of Henan Province(No.0424050010), Doctor Foundation of Henan University of Science and Technology(No.09001397).
Corresponding author:Chunjie Zhang.Tel/Fax: +86-379-64282905; E-mail: cjzhang@sina.com河南省科技攻关项目(No.0424050010),河南科技大学博士基金项目(No.09001397)资助。
