运动对慢性应激抑郁模型大鼠行为学及体重的影响1)
2010-09-15魏宏文矫玮张有志赵楠薛瑞
魏宏文,矫玮,张有志,赵楠,薛瑞
(1.北京体育大学 运动康复系,北京 100084;2.军事医学科学院 毒物药物研究所,北京 100850)
·运动人体科学·
运动对慢性应激抑郁模型大鼠行为学及体重的影响1)
魏宏文1,矫玮2,张有志2,赵楠2,薛瑞2
(1.北京体育大学 运动康复系,北京 100084;2.军事医学科学院 毒物药物研究所,北京 100850)
为了观察运动对慢性应激抑郁模型大鼠行为学及体重的影响,通过慢性不可预知性应激(CUS)复制抑郁模型大鼠,以经典抗抑郁剂氟西汀(Flu)作为对照,观察中等强度跑台训练(MIR)、小强度跑台训练(LIR)对抑郁模型大鼠巧克力牛奶快感缺乏实验、开场实验、新奇抑制摄食实验的行为学表现和体重的影响。结果:(1)行为学研究:CUS明显使大鼠巧克力牛奶偏嗜度下降、自发活动减少、新奇环境中的摄食潜伏期延长;氟西汀可以明显对抗上述改变。慢性应激伴随进行运动具有与氟西汀一致的抗抑郁样行为作用。(2)体重变化:CUS显著抑制大鼠体重的增长,Flu、Flu+MIR、Flu+LIR均未能改善CUS大鼠体重增长的缓慢。MIR、LIR能够改善CUS大鼠体重增长缓慢的情况,每周体重与CUS组相比没有显著性差异。结果证明:抑郁模型大鼠出现快感缺乏、自发活动下降、摄食潜伏期延长的抑郁样行为表现和体重增长缓慢的躯体症状。运动对CUS大鼠具有与抗抑郁药氟西汀一致的抗抑郁行为学效应。
运动生理学;运动医学;慢性应激抑郁模型;行为学;体重;动物实验
抑郁症(depression)属于情感性精神障碍(mood disorders),是一种以明显而持久的心境低落为主要特征的综合征,其高发病率、高复发率和高自杀率对社会造成了极大危害。世界卫生组织(WHO)预计,到2020年,抑郁症将在全球疾病负担排名中居第2位[1]。目前治疗抑郁症的药物普遍起效较慢,有效率也只有60%~70%,且部分难治性抑郁症更是目前治疗的难点[2]。
研究显示,抑郁症发生与长期缺乏健身锻炼有关,不参加运动本身就是导致抑郁症的重要因素[3]。经常从事体力活动的人患精神疾病的比率明显低于很少进行体力活动的人[4]。近年来临床在治疗精神类疾病的过程中发现,运动疗法用于精神疾病和脑疾病的治疗与康复显现出良好的效果[5],而且运动与抗抑郁病药物相结合对治疗抑郁病比单一药物疗法有效[6-7]。但这些研究仍停留在一般的问卷调查或诊疗观察上,缺乏运动抗抑郁作用的机制研究。
慢性不可预知性应激(Chronic Unpredictable Stress,CUS)是近年来国内外应用最为广泛的抑郁动物模型之一,它可模拟抑郁的核心症状——快感缺乏(anhedonia),目前被广泛运用于抑郁症的病理生理机制、抗抑郁药物研发及作用机制的研究[8]。本研究通过复制CUS大鼠模型,观察运动对CUS模型大鼠行为学表现和体重的影响,以经典抗抑郁剂氟西汀(Fluoxetine,Flu)作为对照,旨在探讨运动的抗抑郁样的作用。
1 材料与方法
1.1 实验动物
65只成年 SD雄性大鼠,SPF级,购入时体重150~160 g,购自维通利华实验动物有限公司,许可证编号:SCXK(京)2007-0001。大鼠每笼4只群养,自由摄食饮水,室温22~24℃,相对湿度(50±10)%,自然昼夜节律光照。
1.2 主要仪器设备
DSPT-202动物跑台(杭州段氏,中国),VIDEOMEX-V 图像运动解析系统(Columbus Instruments,美国),大鼠穿梭箱反应仪(Med Associate,美国),噪声仪(中国)。
1.3 实验设计
1)实验流程。
大鼠购入后安静饲养3 d后,进行1周跑台适应性训练,接着进行为期4周的慢性不可预知性应激。期间针对不同的组别,分别伴随给予氟西汀、跑台训练干预措施,每周测定体重,并在慢性应激结束后进行开场实验[9]、巧克力牛奶快感缺失实验[10]、新奇抑制摄食实验[11]。
2)动物筛选及分组。
适应性跑台训练负荷安排:坡度=0,跑速=5~10~15 m/min,10~15~20 min/次,1 次/d×6 d。训练期间不使用电击装置驱赶大鼠,以避免对大鼠施加不良应激[11]。
将筛选出来的大鼠,根据体重均衡分为7组,每组8只。各组之间体重差异没有显著性(P>0.05)。各组具体情况见表1。

表1 动物分组情况
3)大鼠慢性应激模型的建立。
[9,11,13]方法,并尽量使应激程序符合不可预知性的特点,连续4周每天下午时间给予大鼠采用1~2种如下刺激:禁食24 h、禁水24 h、潮湿饲养(200 mL水加150 g垫料)+孤养24 h、鼠笼45°倾斜24 h、夹尾1 min、电击(0.8 mA,电击每分钟间隔15 s,共30 min)、通宵照明12 h、白噪音(110 dB)1 h、10℃冰水游泳6 min、制动1~2 h。
4)药物干预。
Flu组、Flu+LIR组、Flu+MIR组每次应激前1 h给予氟西汀(Fluoxetine Hydrochloride,批号000530,白色粉末,纯度>99%,由常州第四制药厂惠赠),灌胃给药(10 mg/kg),给药体积2 mL/kg,1次/d。其余组大鼠灌胃给予相应体积的生理盐水。
5)跑台训练。
每天08:30~12:30进行跑台运动。具体训练负荷安排见表2。
1.4 统计学分析

表2 大鼠跑台训练负荷安排
2 结果及分析
2.1 跑台训练筛选情况
大约至少有10%的大鼠天生不会跑动或者不愿意跑动[12]。所以,在大鼠购入后安静饲养 3 d后进行 1周的跑台适应性训练,剔除了9只不愿意跑动的大鼠。
2.2 巧克力牛奶快感缺失实验
由于液体摄入量与体重大小有关,所以各液体摄入量以每kg体重计算。实验日从20︰00开始进行测试,测定2 h内大鼠摄入液体的相对质量。结果显示(表3):各组大鼠液体摄入总量没有显著性差异(P>0.05);除CUS组外,其他各组大鼠巧克力牛奶摄入量均显著多于水摄入量(P<0.05~0.001);与 Control相比,CUS组水摄入量显著增加(P<0.001),巧克力牛奶偏嗜度显著下降(P<0.05);Flu组、MIR组均使CUS大鼠巧克力牛奶摄入量显著增加(P<0.05),水摄入量显著减少(P<0.01),巧克力牛奶偏嗜度显著增加(P<0.01);LIR组 CUS大鼠水摄入量显著减少(P<0.01),巧克力牛奶偏嗜度升高(P<0.01);Flu+LIR和Flu+MIR干预均能够显著升高巧克力牛奶偏嗜度(P<0.05~0.01)。
表3 慢性应激及氟西汀、运动伴随干预对大鼠巧克力牛奶快感缺失(±s)的影响

表3 慢性应激及氟西汀、运动伴随干预对大鼠巧克力牛奶快感缺失(±s)的影响
组别 n/只 ωtot/(g·kg-1) ω(巧克力牛奶)/(g·kg-1) ω(H2O)/(g·kg-1) 巧克力牛奶偏好/%Control 8 4.5±2.1 3.8±2.32)0.7±0.4 77.8±23.0 CUS 8 5.5±1.7 2.9±1.6 2.6±1.14)49.7±22.33)Flu 8 7.1±2.0 5.6±1.52)6)1.5±0.86)78.5±8.36)LIR 8 5.6±2.3 4.5±2.02)1.1±0.66)79.3±7.16)MIR 8 6.9±2.3 5.4±2.02)6)1.5±0.56)77.1±6.76)Flu+LIR 8 6.1±1.4 4.6±1.42)1.5±0.86)75.2±12.66)Flu+MIR 8 5.4±1.3 3.6±1.51)1.8±0.9 64.7±15.55)
与同组内水比较:1)P<0.05,2)P<0.01;与Control组比较:3)P<0.05,4)P<0.01;与CUS比较:5)P<0.05,6)P<0.01
2.3 自发活动
将大鼠放入不同于饲养环境的新环境时,首先表现为对新异环境的探究行为,经过l5 s对新异环境的适应和熟悉,然后开始自发活动测试。
采用 Videomex-V图像运动解析系统测定大鼠自发活动,结果显示(见表 4),与 Control组相比,CUS组大鼠自发活动减少,表现为测定时间内的活动总路程显著减少(P<0.001),Flu组、MIR组、Flu+LIR组、Flu+MIR组均能够显著增加 CUS大鼠活动距离(P<0.05~0.01)。
2.4 摄食潜伏期
结果显示(见表4),与Control相比,CUS组大鼠在新奇环境中的摄食潜伏期明显延长(P<0.001);Flu、LIR、MIR、Flu+LIR、Flu+MIR干预均能够显著缩短CUS大鼠摄食潜伏期(P<0.001)。
表4 慢性应激及佛西丁、运动伴随干预对大鼠自发活动和摄食潜伏期(±s)的影响
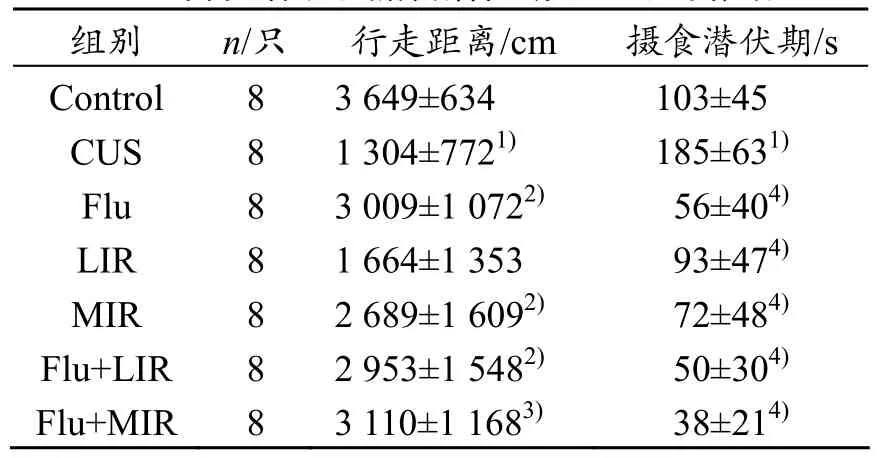
表4 慢性应激及佛西丁、运动伴随干预对大鼠自发活动和摄食潜伏期(±s)的影响
与Control比较:1)P<0.001;与CUS比较:2)P<0.05,3)P<0.01,4)P<0.001
组别 n/只 行走距离/cm 摄食潜伏期/s Control CUS Flu LIR MIR Flu+LIR Flu+MIR 8 8 8 8 8 8 8 3 649±634 1 304±7721)3 009±1 0722)1 664±1 353 2 689±1 6092)2 953±1 5482)3 110±1 1683)103±45 185±631)56±404)93±474)72±484)50±304)38±214)
2.5 体重
结果显示(见表5):CUS开始前各组大鼠体重差异无显著性(P>0.05),符合实验的基本要求。慢性应激对大鼠体重有明显影响,CUS组大鼠在2周后体重开始显著低于 Control组(P<0.05),并且一直延续到慢性应激的第3周(P<0.05)和第4周(P<0.05);Flu伴随干预不但未能改善CUS大鼠体重的增长缓慢,反而有下降加重的趋势,表现为从慢性应激2周后开始到慢性应激结束后,每周体重均显著低于CUS组(P<0.05~0.01),提示长期给予氟西汀可能有一定的控制体重增长的作用;LIR和MIR干预均能够改善CUS大鼠体重增长缓慢的情况,而且对抗 CUS抑制体重增长的情况优于Flu组,表现为LIR组、MIR组与CUS组相比,在整个实验期体重差异均没有显著性(P>0.05),LIR组体重在4周后,MIR组在3周后、4周后体重显著高于Flu组(P<0.05);Flu+LIR和Flu+MIR干预也未能明显改善CUS大鼠体重增长缓慢的情况,表现为从慢性应激2周后开始到慢性应激结束后,每周体重均显著低于CUS组(P<0.05~0.001),再次提示长期给予氟西汀的控制体重的作用;Flu+LIR组、Flu+MIR组在慢性应激3周后开始到慢性应激结束,体重均分别显著低于 LIR组、MIR组(P<0.05),也再次提示长期给予氟西汀控制体重的作用。
表5 慢性应激及氟西汀、运动伴随干预对大鼠体重(±s)的影响 g

表5 慢性应激及氟西汀、运动伴随干预对大鼠体重(±s)的影响 g
与Control比较:1)P<0.05;与CUS组比较:2)P<0.05,3)P<0.01;与Ful组比较:4)P<0.05;与LIR组比较,5)P<0.05;与MIR比较:6)P<0.05
组别 n/只 第0周 第1周 第2周 第3周 第4周Control CUS Flu LIR MIR Flu+LIR Flu+MIR 8 8 8 8 8 8 8 212±6 214±4 214±9 213±6 210±7 214±8 211±8 281±13 279±11 267±13 269±9 269±11 266±11 264±17 314±32 288±151)270±112)276±12 279±11 261±173)266±252)365±34 342±221)311±133)326±20 333±134)302±165)311±263)6)405±38 365±261)326±273)353±244)362±184)325±203)5)339±282)6)
3 讨论
在应激致抑郁的动物模型中,开场实验、糖水消耗量、体重变化是经典的反映动物抑郁行为学及躯体症状的指标[14]。根据文献,并结合本实验室的以往研究成果[9,11,13]和实验条件,本研究选取巧克力牛奶快感缺乏实验、开场实验、新奇抑制摄食实验这3个行为学测验,结合大鼠体重的变化,来综合评价造模的效果。
3.1 巧克力牛奶快感缺乏实验
CUS抑郁模型脑内奖赏系统一些神经元结构受损,导致快乐体验能力的缺乏[15]。动物对甜觉奖赏的反应性下降是最简单、最易于观察的指标,因此目前国外大多数学者采用液体消耗实验中糖水消耗量和糖水偏爱百分比来作为测量快感缺乏的有效客观指标[8-9,11,13,15],也有研究用巧克力牛奶快感缺乏实验(chocolate milk anhedonia test,CMAT)[10]、甜味食物摄取量(sweet food intake)或甜味食物摄取比值(rate of sweet food intake)、美味食物摄取(palatable food intake)、颅内自我刺激(brain stimulation reward)、位置偏爱实验(place preference conditioning procedure)等实验来测量[16]。
传统的糖水消耗实验由于存在许多繁琐的步骤[8],如:需要进行糖水基线训练和测试,大约有10%~15%的动物不能获得稳定的糖水摄入基线,而且还有同样比例的应激动物经过3周应激后糖水摄入量并没有清晰和稳定的减少,这些动物需要淘汰;在实验时要进行控制饮食等复杂的工作。还有文献报道,大鼠糖水摄入量(或糖水偏嗜度)在慢性应激后没有下降,有的抗抑郁药也不能恢复慢性应激动物下降的糖水摄入量[17]。尽管上述局限性可能与研究者所采用的动物品系、应激程序和糖水实验方法的不同有关,但从另一方面提示了糖水消耗实验的方法不够稳定和敏感,这在很大程度上限制了该实验在抑郁症研究领域的应用。
CMAT是另外一种反映动物快感缺乏的实验,该方法不需要事先进行液体消耗的训练,只需要进行一次性测试,具有快速、简便的特点[10]。
本研究结果表明,在液体摄入总量没有差异的情况下,CUS大鼠摄入了较多的水,而Control组大鼠摄入了较多的巧克力牛奶,相对于Control组大鼠而言,CUS组大鼠对对巧克力牛奶“没有兴趣”,提示其出现了“快感缺乏”。大鼠巧克力牛奶饮用量的下降不能单纯地解释为液体饮用的下降(即渴觉的下降),因为动物总液体消耗量并无明显改变,而巧克力牛奶摄入量、巧克力牛奶偏嗜度显著下降,提示本研究的CUS模型表现出了动物对幸福事件反应能力的下降。
结果还表明,CUS伴随给予氟西汀,进行中、小强度运动跑台训练,以及氟西汀分别联合中、小强度运动跑台训练,均能够显著提升CUS大鼠对巧克力牛奶的“兴趣”,“快感缺乏”显著减少。表明CUS大鼠出现了抑郁症的核心症状——快感缺乏,而运动、氟西汀均能够改善此核心症状。
3.2 开场实验
本实验采用 Videomex-V图像运动解析系统测定动物的自发活动(spontaneous motor activity),该系统能够自动识别动物的运动轨迹,减少了实验工作量,更重要的是提高了实验数据的精度和可靠性。结果显示,CUS使大鼠自发活动减少,表现为测定时间内的活动总路程显著减少,与本研究室[8,10,12]以及国外文献报道一致[17]。CUS伴随给予氟西汀、进行中等强度跑台训练、氟西汀分别联合中、小强度跑台训练均能够显著增加 CUS大鼠活动距离。表明跑台运动能够使 CUS大鼠维持一定的自发活动,减少抑郁样行为。
3.3 新奇抑制摄食实验
新奇抑制摄食实验(novelty-suppressed feeding,NSF)是动物禁食后在饥饿状态下新奇的环境中产生摄食和对新环境恐惧的矛盾冲突,长期给予抗抑郁药物可使动物的冲突反应降低,表现为开始摄食的潜伏期缩短,该模型目前被广泛应用于抗抑郁剂以及抗焦虑药物的长期效应评价[11]。
本研究结果表明,与Control相比,CUS组大鼠在新奇环境中的摄食潜伏期明显延长,慢性应激伴随给予氟西汀能够显著缩短CUS大鼠摄食潜伏期,这与本研究室以往研究结果[9,11]一致。
运动对NSF实验影响的报道较少。自由转轮运动显著缩短了正常小鼠摄食潜伏期,但对LID小鼠(一种以血清 IGF-1较低为特点的突变小鼠)摄食潜伏期没有显著影响[19]。目前尚未见运动对CUS大鼠NSF影响的文献。
本研究显示,CUS伴随进行中、小强度跑台训练,氟西汀分别联合中、小强度跑台训练,均能够显著缩短CUS大鼠摄食潜伏期。表明运动,以及抗抑郁药联合运动,均能够缩短抑郁模型大鼠摄食潜伏期,运动在该模型上显示出较好的抗抑郁样作用,而且运动进一步加强了氟西汀在新奇抑制摄食模型上的抗抑郁作用。
3.4 体重
体重的变化可以看作是抑郁大鼠模型量化的躯体症状和体征,抑郁大鼠体重增长缓慢,这与抑郁症患者的食欲降低、消瘦相类似[8]。
本研究对大鼠每周测定一次体重,结果发现,CUS对大鼠体重有明显影响,CUS组大鼠在2周后体重开始显著低于Control组,并且一直延续到慢性应激的第3周和第4周;慢性应激伴随给予氟西汀,未能改善CUS大鼠体重的增长缓慢,表现为从慢性应激2周后开始到慢性应激结束后,每周体重均显著低于CUS组;CUS伴随进行中、小等强度跑台运动,能够改善CUS大鼠体重增长缓慢的情况,而且对抗CUS抑制体重增长的情况优于慢性应激伴随给予氟西汀,表现为 LIR组、MIR组与CUS组相比,在整个实验期体重差异均没有显著性,LIR组体重在4周后,MIR组在3周、4周后体重还显著高于Flu组;CUS伴随给予氟西汀并分别联合中、小强度跑台训练,也未能明显改善CUS大鼠体重增长缓慢的情况,表现为从慢性应激2周后开始到慢性应激结束后,每周体重均显著低于CUS组;Flu+LIR组、Flu+MIR组在慢性应激3周后开始到慢性应激结束,体重均分别显著低于LIR组、MIR组。
由于本实验对大鼠进行群养(4只/笼),群养大鼠进食过程中经常有食料遗撒现象,而且慢性应激程序中有禁食、禁水的项目,故无法精确计量每只大鼠的进食量。因此,慢性应激导致大鼠体重增长缓慢,本研究分析可能与HPA轴有关:下丘脑分泌的CHR不但可以刺激垂体释放 ACTH,而且是调节能量平衡和体重的重要因子。慢性应激导致大鼠体重增长缓慢,可能是HPA轴被激活,下丘脑分泌的CHR引起食欲减退,以及在应激条件下能量消耗增加,两种因素双重作用的结果[20]。而慢性应激伴随给予氟西汀进一步降低大鼠体重的原因,与氟西汀的药理作用有关。氟西汀属于择性5-HT再摄取抑制剂,其主要药理作用在于选择性地抑制 CNS突触前细胞对 5-HT的再摄取,可以通过增加大脑自身的5-HT供给来纠正这种神经递质的缺乏,从而能够有效控制抑郁症的症状。动物实验表明增加突触间隙 5-HT或直接刺激5-HT2C受体可减少进食,反之则增加进食[21]。因此,氟西汀通过升高突触间隙的5-HT水平,减少了大鼠的进食,进而导致体重下降。
我们也发现与本研究结果类似的报道[11,22],即:抗抑郁药物能够有效改善甚至逆转CUS大鼠抑郁样行为,但是不能改善其体重的缓慢增长。因此,我们存在这样的疑惑:尽管抑郁模型大鼠表现出体重增长幅度减少或体重下降已经得到许多研究的验证,但是当氟西汀能够有效改善抑郁模型大鼠的行为学异常时,为何不能逆转其体重下降?是因为本研究的大鼠在总共为期5周(1周适应期,4周慢性应激期)的实验后(已达 10周龄)已错过了生长发育的最佳时期,慢性应激对其生长发育造成不可逆的抑制,从而使抗抑郁药物不能恢复其体重增长,还是抗抑郁药物在发挥抗抑郁作用的同时,也作用于神经内分泌系统的某个靶点,对大鼠体重增长产生抑制作用?这有待于后续工作的深入研究。
本研究结果还说明,慢性应激伴随进行跑台训练,对于大鼠体重增长缓慢有一定的改善作用,对于保持动物的体重有一定的效益。原因可能是适量运动部分平衡了HPA轴的功能,还有可能是运动促进机体新陈代谢,增加了大鼠的食欲,后者引起体重的增长。这有待于今后进一步的验证。
参考文献:
[1] World Health Organization. Annual report. Mental health:new hopes,new perspectives[M]. Geneva,Switzerland:WHO,2001.
[2] 路英智. 抑郁障碍[M]. 海口:南海出版社,2005.[3] 李香华,钟兴永. 体育健身旅游与抑郁症[J]. 中国临床康复,2005,9(36):85-86.
[4] Netz Y,Wu M J,Becker B J,et al. Physical activity and psychological well-being in advanced age:a meta-analysis of intervention studies[J]. Psychol Aging,2005,20(2):272-284.
[5] Peter S. Effects of physical exercise on anxiety,depression and sensitivity to stress:a unifying theory[J].linical Psychology Review,2001,21(1):33.
[6] Amelia R N,Tony H,Ronald R,et al. Physical activity-antidepressant treatment combination:impact on brain-derived Neurotrophic factor and behavior in an animal model[J]. Behavioural Brain Research,2001,120(1):87-95.
[7] 李长春,焦电波,杨辉. 运动对促进抑郁症康复的研究[J]. 军事体育进修学院学报,2008,27(1):87-89.
[8] 张汉霆. 抑郁症的研究方法[G]//吴俊芳. 现代神经科学研究方法. 北京:中国协和医科大学出版社,2005:982.
[9] 张黎明. 抗抑郁剂调控海马细胞骨架的功能研究[D]. 北京:中国人民解放军军事医学科学院,2008.
[10] Roegge C S,Timofeeva O A,Seidler F J,et al.Developmental diazinon neurotoxicity in rats:later effects on emotional response[J]. Brain Res Bull,2008,75(1):166-172.
[11] 安磊. 小补心汤总黄酮抗抑郁的神经生物学机制研究[D]. 北京:中国协和医科大学&中国医学科学院,2008.
[12] Kevin C Kregel. Resource book for the design of animal exercise protocols[M]. American Physiological Society,2006.
[13] 张有志. 小补心汤总黄酮抗抑郁作用及其机制研究[D]. 北京:中国人民解放军军事医学科学院,2004.
[14] 胡良平. Windows SAS 6.12 & 8.0 实用统计分析教程[M]. 北京:军事医学科学出版社,2001.
[15] Paul Willner. Chronic mild stress (CMS) revisited:consistency and behavioural-neurobiological concordance in the effects of CMS[J]. Neuropsychobiology,2005,52:90-110.
[16] 张均田. 现代药理学实验方法[M]. 北京:医科大学中国协和医科大学联合出版社,1998:1060-1062.
[17] Muscat R,Willner P. Suppression of sucrose drinking by chronic mild unpredictable stress:a methodological analysis[J]. Neurosci Biobehav Rev,1992,16:507-517.
[18] Stephanie C D,Kerri A H,Brigitta G,et al. Effects of chronic Fluoxetine in animal models of anxiety and depression[J]. Neuropsychopharmacology,2004,29:1321-1330.
[19] Trejo J L,Llorens M V,Torres A I. The effects of exercise on spatial learning and anxiety-like behavior are mediated by an IGF-1-dependent mechanism related to hippocampal neurogenesis[J]. Mol Cell Neurosci,2008,37(2):402-411.
[20] 崔冬雪. 游泳锻炼对实验性抑郁症大鼠神经内分泌及行为学的影响[D]. 上海:华东师范大学,2005.
[21] 杨成龙,蔡文治,夏伟君. 氟西汀对氯氮平所致体质量增加的干预研究[J]. 现代中西医结合杂志,2006,15(15):2027-2028.
[22] 刘晓军,谭庆荣,王百忍,等. 氟西汀和阿米替林对大鼠强迫游泳中的行为结构及体质量的影响[J].中国行为医学科学,2006,l5(5):420-421.
Effects of exercising on the ethological expressions and body weight of chronic stress induced depression model rats
WEI Hong-wen1,JIAO Wei1,ZHANG You-zhi2,ZHAO Nan2,XUE Rui2
(1.Sports Rehabilitation Depatrment,Beijing Sport University,Beijing 100084,China;2.Institute of Pharmacology and Toxicology,Academy of Military Medical Sciencet,Beijing 100850,China)
In order to observe the effects of exercising on the ethological expressions and body weight of chronic stress induced depression model rats, the authors replicated depression model rats by means of chronic unpredictable stress (CUS),used fluoxetine (Flu, a classical antidepressant) as a control, observed the effects of medium intensity treadmill running (MIR)and low intensity treadmill running (LIR) on the ethological expressions and body weight of depression model rats in chocolate milk anhedonia experiment, start experiment and novelty inhibition ingestion experiment, and revealed the following findings: 1) ethological study: CUS could significantly lower the degree of addiction of the rats to chocolate milk, reduce their spontaneous activity, and prolong their ingestion latent period in a novel environment; fluoxetine could significant counteract the said changes; with the continuance of exercising, chronic stress had fluoxetine consistent anti depression like behavior functions; 2) body weight change: CUS significantly inhibited the increase of body weight of the rats, Flu, Flu+MIR and Flu+LIR were all unable to improve the slow increase of body weight of CUS rats; MIR and LIR can improve the condition of slow increase of body weight of CUS rats; their weekly body weight had no significant difference as compared with the rats in the CUS group. The said findings proved the followings: depression model rats showed body symptoms of slow body weight increase and depression like ethological expressions such as anhedonia, spontaneous activity slowdown and ingestion latent period prolongation; exercising has fluoxetine consistent anti depression ethological effects on CUS rats.
sports psychology;sports medicine;chronic stress induced depression model;ethology;body weight;animal experiment
G804.2
A
1006-7116(2010)11-0100-06
2010-07-10
魏宏文(1972-),男,讲师,博士,研究方向:运动健康与康复。1)按国家标准“体重”应为“体质量”,为方便阅读,这里用习惯量名称。
