电针足三里、曲池对脑缺血再灌注损伤大鼠β-EP、Glu蛋白表达的影响
2010-09-12蔡玉颖刘志顺王奇峰谈太鹏
蔡玉颖,刘志顺,王 顺,王奇峰,谈太鹏,蒋 花
(1.中国中医科学院广安门医院 针灸科,北京 100053;2.黑龙江省中医研究院 针灸科,黑龙江 哈尔滨 150036)
脑缺血再灌注损伤是缺血性脑卒中的主要病理机制,脑血流中断和再灌注使脑细胞产生损伤是一个快速的级联反应,病理级联反应的恶性循环导致机体处于持续的恶性应激刺激状态,从而引起神经-内分泌-免疫(NEI)网络功能的紊乱,继而加重脑缺血再灌注损伤。神经递质的紊乱是脑缺血再灌注损伤的重要环节,其中脑啡肽中 β-EP和兴奋性神经递质Glu与脑缺血再灌注损伤密切相关。本实验采用免疫组织化学技术检测下丘脑组织中 β-EP、Glu蛋白表达水平,从神经递质角度研究电针经穴通过调控下丘脑中β-EP、Glu蛋白表达水平而发挥对脑缺血再灌注损伤后脑保护作用的机制。
1 材料与方法
1.1 材料
免疫组化 β-EP、Glu试剂盒,武汉博士德公司;免疫组化二抗试剂盒,北京中杉金桥生物技术公司;研究用生物显微镜,日本 OLYMPUS BX60;轮转式组织切片机,德国Leica 2135型;生物组织包埋机,天津爱华BMJ-1型;Motic Med6.0数码医学图像分析系统,厦门麦克奥迪;KWD-808Ⅱ型电针仪,常州市武进长城医疗器械有限公司。
1.2 动物与分组
健康Wistar雄性大鼠,体重 250g~300g,由长春高新医学动物实验研究中心提供,动物许可证号SCKY-(吉)2003-0004。大鼠按体重随机分为正常组、假手术组、模型组、电针非经穴组(模型 +电针非经穴)和电针经穴组(模型+电针经穴)5组,每组均分为1d、3d、7d 3个时间点,每时间点6只动物。模型判断标准按照 Zea-Longa[1]报道的4分制进行,评分在1~3分的大鼠认为模型制作成功,排除实验中死亡者与造模后不符合模型判断标准者。
1.3 造模方法
采用改良线栓法[1]制备大鼠 MCAO再灌注模型。大鼠称重,按300mg/kg腹腔注射10%水合氯醛麻醉。仰卧位固定于手术台上,备皮消毒后沿颈部正中切开皮肤,沿胸锁乳突肌内缘分离肌肉和筋膜,分离右侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),结扎 CCA下端,同时结扎右侧ECA,然后用动脉夹夹住 ICA远端以暂时止血,在CCA近颈内、颈外动脉分叉处剪一小口,将尼龙线插入ICA,稍稍结扎CCA分叉插线处,然后撤掉ICA远端动脉夹,将尼龙线顺势缓缓送入,越过翼腭动脉直至颅内大脑前动脉近端,深度为18mm~20mm,以阻断该侧大脑中动脉血流导致脑缺血。2 h后轻轻提拉所留线头实现大脑中动脉再灌注则造模完成。假手术组除不插入线栓外,其余同模型组。
1.4 治疗方法
1.4.1 选穴 大鼠针灸穴位定位参考《实验针灸学》[2]附录中常用实验动物的针灸穴位。曲池穴位于桡骨近端关节外侧前方凹陷中;足三里穴位于膝关节后外侧,腓骨小头下约5mm;非曲池穴位于平行曲池外侧旁开5mm;非足三里穴位于平行足三里外侧旁开5mm。
1.4.2 操作方法 电针经穴组:大鼠取俯卧位固定,注意固定鼠尾。定穴消毒后,针刺双侧曲池、足三里穴,调整好刺激参数,连接刺激电极,针柄接电针治疗仪,一极接曲池穴,另一极接同侧足三里穴,疏密波,频率2/30Hz,电流强度1mA,大鼠以触须、耳朵微动为度。于再灌注6h后开始针刺,每天针刺1次,连续针刺,每次30min,取材前2h再针刺1次。
电针非经穴组:针刺双侧非曲池、非足三里穴,其他治疗同电针经穴组。正常组、假手术组和模型组动物只捆绑固定,不针刺。
1.5 指标检测
1.5.1 标本采集与处理 实验结束后,按300mg/kg腹腔注射10%水合氯醛麻醉,从心尖部沿左心室插入灌注管至升主动脉入口,剪开右心耳,先用0.9%生理盐水150ml快速灌注,再用预冷的4%多聚甲醛(0.1mol/L磷酸盐缓冲液配制)200ml~300ml灌注,先快后慢,直至鼠尾翘起,身体逐渐僵硬,颜色变白为止。迅速断头取脑,取下丘脑放入4%多聚甲醛固定液中固定过夜,常规脱水、透明、石蜡包埋、石蜡切片,待测。
1.5.2 指标检测方法 采用免疫组织化学法检测下丘脑β-EP、Glu蛋白表达水平,步骤如下:(1)组织切片脱蜡至水;(2)EDTA微波修复抗原;(3)3%H2O2去离子水孵育10min,阻断内源性过氧化物酶。PBS冲洗 2min×3次;(4)滴加一抗(1∶50),4℃过夜,PBS冲洗2min×3次;(5)生物素化兔抗 IgG,37℃孵育30min,PBS冲洗 2min×3次;(6)DAB显色,显微镜下控制显色程度;(7)蒸馏水充分冲洗;(8)苏木素复染、脱水、透明;(9)中性树脂封片。
1.5.3 结果判定与分析方法 阳性表达细胞胞浆呈棕黄色,阴性细胞核呈蓝色。采用 Motic Med6.0图像分析系统,每组每时间点各选6张切片,每张切片在400倍下随机选取6个非重叠视野,按照512×512像素分布摄入图像并保存病理图像分析系统内,选择免疫组化分析模块,通过灰度调节区分视野内阳性信号面积,计算阳性目标总面积与统计场总面积比值,取阳性目标面密度平均值进行统计学分析。
1.6 统计方法
2 结果
2.1 电针经穴对脑缺血再灌注损伤大鼠 β-EP蛋白表达的影响
表1、图1~图13显示,正常组与假手术组各时间点β-EP蛋白表达均无显著性差异(P>0.05);模型组缺血再灌注ld,β-EP蛋白表达明显升高,持续7d仍维持较高水平,与同时间点正常组、假手术组比较具有显著性差异(P<0.01);电针经穴组与同时间点模型组、电针非经穴组比较,β-EP蛋白表达明显增高(P<0.01,P<0.05)。
表1 各组脑缺血再灌注损伤大鼠β-EP蛋白表达的比较±s)
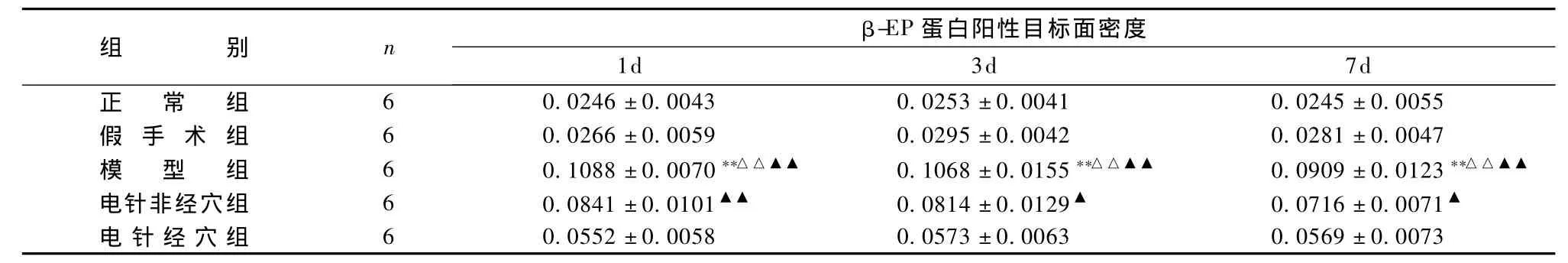
表1 各组脑缺血再灌注损伤大鼠β-EP蛋白表达的比较±s)
注:与同时间点正常组比较:**P<0.01;与同时间点假手术组比较:△△P<0.01;与同时间点电针经穴组比较:▲P<0.05,▲▲P<0.01
组β-EP 1d 3d 7d正 常 组 6 0.0246±0.0043 0.0253±0.0041 0.0245±0.0055别n蛋白阳性目标面密度假 手 术 组 6 0.0266±0.0059 0.0295±0.0042 0.0281±0.0047模 型 组 6 0.1088 ±0.0070**△△▲▲ 0.1068 ±0.0155**△△▲▲ 0.0909 ±0.0123**△△▲▲电针非经穴组 6 0.0841±0.0101▲▲ 0.0814±0.0129▲ 0.0716±0.0071▲电针经穴组 6 0.0552±0.0058 0.0573±0.0063 0.0569±0.0073
图1 正常组(×400)
图2 假手术组1d(×400)
图3 假手术组3d(×400)
图4 假手术组7d(×400)
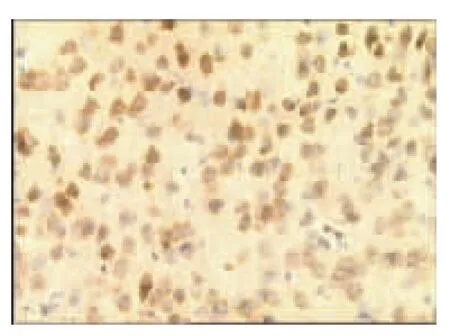
图5 模型组1d(×400)
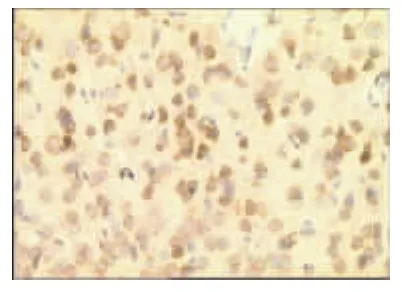
图6 模型组3d(×400)
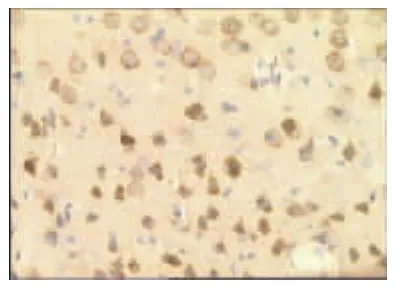
图7 模型组7d(×400)
图8 电针非经穴组 1d(×400)
图9 电针非经穴组 3d(×400)
图10 电针非经穴组 7d(×400)
图11 电针经穴组1d(×400)
图12 电针经穴组3d(×400)
图13 电针经穴组7d(×400)
2.2 电针经穴对脑缺血再灌注损伤大鼠Glu蛋白表达的影响
表2、图14~26显示,正常组与假手术组各时间点Glu蛋白表达均无显著性差异(P>0.05);模型组缺血再灌注ld,Glu蛋白表达明显升高,持续7d仍维持较高水平,与同时间点正常组、假手术组比较均有显著性差异(P<0.01);电针经穴组与同时间点模型组、电针非经穴组比较均有显著性差异(P<0.01,P<0.05)。
表2 各组脑缺血再灌注损伤大鼠Glu蛋白表达的比较±s)
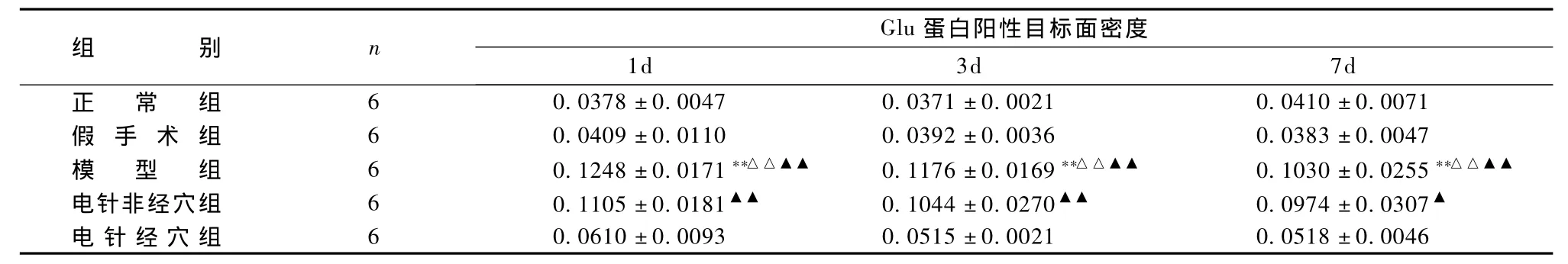
表2 各组脑缺血再灌注损伤大鼠Glu蛋白表达的比较±s)
注:与同时间点正常组比较:**P<0.01;与同时间点假手术组比较:△△P<0.01;与同时间点电针经穴组比较:▲P<0.05,▲▲P<0.01
组Glu 蛋白阳性目标面密度1d 3d 7d正 常 组 6 0.0378±0.0047 0.0371±0.0021 0.0410±0.0071别n假 手 术 组 6 0.0409±0.0110 0.0392±0.0036 0.0383±0.0047模 型 组 6 0.1248 ±0.0171**△△▲▲ 0.1176 ±0.0169**△△▲▲ 0.1030 ±0.0255**△△▲▲电针非经穴组 6 0.1105±0.0181▲▲ 0.1044±0.0270▲▲ 0.0974±0.0307▲电针经穴组 6 0.0610±0.0093 0.0515±0.0021 0.0518±0.0046
图14 正常组(×400)
图15 假手术组1d(×400)
图16 假手术组3d(×400)
图17 假手术组7d(×400)
图18 模型组1d(×400)
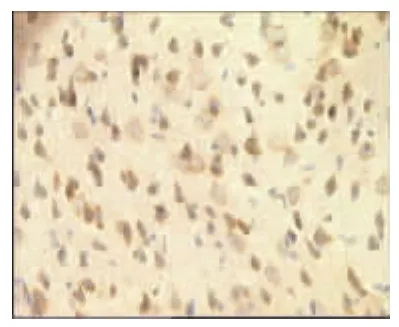
图19 模型组3d(×400)
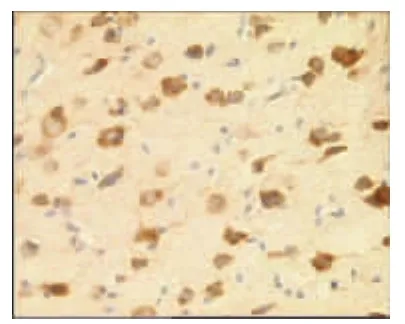
图20 模型组7d(×400)
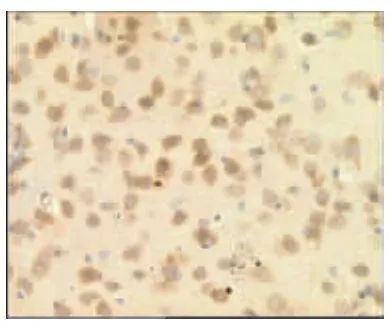
图21 电针非经穴组 1d(×400)
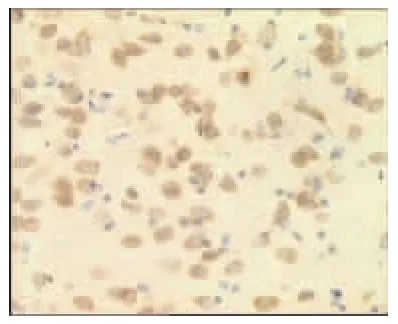
图22 电针非经穴组3d(×400)
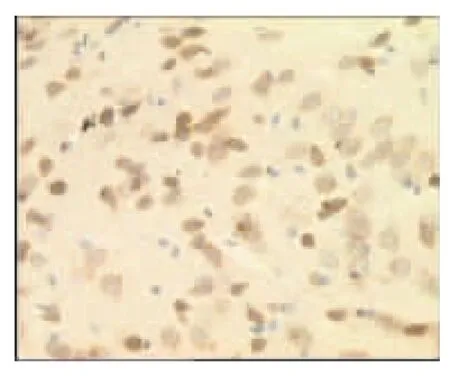
图23 电针非经穴组7d(×400)
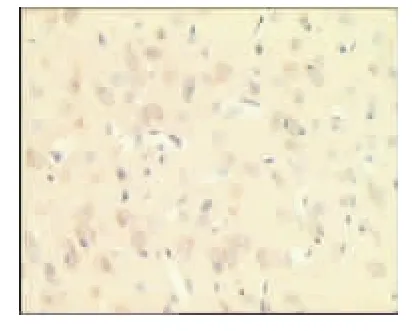
图24 电针经穴组1d(×400)
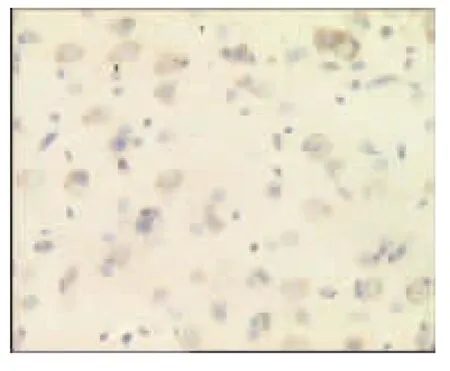
图26 电针经穴组7d(×400)
3 讨论
脑缺血再灌注损伤是指脑缺血一定时间恢复血液灌注后,脑组织细胞损伤反而进行性加重的病理现象。脑缺血再灌注损伤病理级联反应的恶性循环导致机体处于持续的恶性应激刺激状态,从而引起NEI网络功能的紊乱,进一步加重脑缺血再灌注损伤[3]。神经系统、内分泌系统和免疫系统共同组成一个网络状的结构和功能体系,三大系统具有共同的生化基础,三者各具特点又密切相关,共同调控和整合机体内、外环境的平衡。下丘脑是NEI网络的高级整合中枢,为探讨脑缺血再灌注损伤后下丘脑神经递质的变化,本实验将下丘脑作为实验观测的主要部位,以期揭示脑缺血再灌注损伤后下丘脑神经递质 β-EP、Glu蛋白表达的变化规律。
β-EP是神经细胞产生的具有广泛生物学活性的内源性阿片肽,广泛存在于垂体、下丘脑、大脑皮层、海马回、脑干、血浆和脑脊液中,其中以下丘脑和垂体含量最高。可通过神经分泌、旁分泌和内分泌三种途径分别起到神经激素、神经递质或神经调变物的作用,参与多种生理功能的调节,同时也参与许多疾病和应激的病理过程。近年研究表明:脑缺血时 β-EP释放是造成卒中病理损害的重要环节[4],使用阿片受体拮抗剂纳络酮治疗脑卒中有效以来[5、6],证明内啡肽拮抗剂可减轻、阻止甚至逆转由内啡肽所造成脑缺血再灌注损伤,拮抗 β-EP活性,减少内源性 β-EP的释放,降低脑组织总钙和氧自由基水平,减少梗死体积,防止缺血性损害扩展。
Glu是脑组织中含量较高的一种重要氨基酸,同时也是一种重要的中枢神经系统兴奋性递质。自1971年 olney首次提出“兴奋性毒性”解释缺血后Glu升高所引发的病理生理变化后,普遍认为氧和糖供应减少引起的神经元死亡,是因于细胞外兴奋性氨基酸(EAA)递质剧增的结果,特别是 Glu。EAA指Glu和天冬氨酸(Asp),脑缺血再灌注时,大量的Glu使神经元持续去极化,增加了神经元内Glu的大量释放;又因脑缺血后ATP消耗,依赖能量而重吸收Glu的机制衰竭,影响Glu摄取功能,甚至出现Glu向细胞外液转移,如此恶性循环,突触间隙持续高浓度的Glu就引起兴奋性神经毒性,造成损伤[7]。
本研究结果显示,与正常组、假手术组比较,模型组各时间点 β-EP、Glu蛋白表达均明显增高,表明下丘脑β-EP、Glu蛋白表达水平与脑缺血再灌注损伤密切相关。电针经穴组与同时间点模型组比较,β-EP、Glu蛋白表达明显降低,表明电针经穴对脑缺血再灌注损伤大鼠下丘脑 β-EP、Glu蛋白表达具有明显的调节作用。电针经穴组与同时间点电针非经穴组比较,β-EP、Glu蛋白表达明显降低,表明电针经穴对脑缺血再灌注损伤大鼠下丘脑 β-EP、Glu蛋白表达的调节具有相对特异性。
脑缺血再灌注损伤可使下丘脑神经递质调节功能紊乱,进一步导致NEI网络功能紊乱而加重脑缺血再灌注损伤,电针经穴具有调节脑缺血再灌注损伤大鼠下丘脑 β-EP、Glu蛋白表达的作用,从而进一步调控NEI网络功能紊乱而发挥脑缺血再灌注损伤脑保护作用。总之,电针经穴对脑缺血再灌注损伤的保护作用机制可能与电针经穴调节下丘脑β-EP、Glu蛋白表达水平有关。
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[2]李忠仁.实验针灸学.中国中医药出版社[M].北京:中国中医药出版社,2003.327-329.
[3]蔡玉颖,刘志顺,王顺,等.电针经穴对脑缺血再灌注损伤大鼠 HPA轴相关激素的影响[J].针刺研究,2009,34(5):297-303.
[4]付慧芳,陈瑞,于培兰,等.高压氧对大鼠短暂脑缺血降钙素基因相关肽和 β-内啡肽的影响[J].首都医科大学学报,2005,26(4):435-437.
[5]王涛,陈莉,文亮.纳洛酮对减轻全脑缺血再灌注后神经元损伤作用的实验研究[J].中国急救医学,2001,2(4):196-198.
[6]赵丽哪,吕佳宏.纳洛酮对大鼠局灶性脑缺血再灌注损伤后脑组织梗塞体积的影响[J].黑龙江医药科学,2006,29(3):73.
[7]吴喆,赵宇阳,康秋君,等.谷氨酸代谢变化与脑缺血损伤[J].中国实用医药,2008,3(2):101-103.
