富营养水体中2种水生植物的根际微生物群落特征
2010-09-09陆开宏胡智勇梁晶晶朱津永宁波大学应用海洋生物技术教育部重点实验室浙江宁波315211
陆开宏,胡智勇,梁晶晶,朱津永 (宁波大学应用海洋生物技术教育部重点实验室,浙江 宁波 315211)
富营养水体中2种水生植物的根际微生物群落特征
陆开宏*,胡智勇,梁晶晶,朱津永 (宁波大学应用海洋生物技术教育部重点实验室,浙江 宁波 315211)
选取宁波市城区内河2个营养类型水体日湖(中-富营养类型)和卧彩江(重富营养类型),于2008年8~11月,利用MIDI Sherlock MIS系统和其他传统方法,跟踪监测了2个水体内2种常见水生净化植物粉绿狐尾藻(Myriophyllum aquaticum)、喜旱莲子草(Alternanthera philoxeroides)根际微生物的种类、数量及其季节变化,分析了水体主要水质参数、水体微生物与植物根际微生物之间的相关性.结果表明,水生植物根际效应显著,不同月份植物根际微生物数量均要显著高于水体环境;植物种类对植物根际微生物影响显著,在日湖水体,狐尾藻根际微生物数量要显著高于喜旱莲子草;在卧彩江,2种植物根际细菌数量无显著差异,放线菌、真菌数量差异显著,植物根际微生物数量与水体环境因子之间具有一定的相关性,调查期间,日湖水温、TN、TP、Chla与植物根际微生物数量间均无显著相关,仅COD与喜旱莲子草根际细菌数量显著负相关;在卧彩江,TP与粉绿狐尾藻、喜旱莲子草根际放线菌数量显著负相关,其余水质参数与根际微生物数量均无显著相关.植物根际优势菌种以假单胞菌属(Pseudomonas)、微球菌属(Micrococcus)、黄杆菌属(Chryseobacterium)、不动杆菌属(Acinetobacter)等有机物降解微生物为主,环境因素的变化和植物种类的不同也导致了葡萄球菌属(Staphylococcus),食酸菌属(Acidovorax)、节杆菌属(Arthrobacter)等特有菌种的出现.对植物根际微生物群落结构进行聚类分析表明,除日湖喜旱莲子草根际微生物群落结构在夏、秋两个季节相似性较高外,其余几个处理的根际微生物群落结构相似性在21.60%~51.57%.日湖植物根际微生物多样性夏季高于秋季,而卧彩江中夏季低于秋季;日湖中2种植物之间无论夏秋均无显著差异,而在卧彩江,夏季喜旱莲子草要显著高于粉绿狐尾藻,秋季则完全相反,据此说明植物根际微生物多样性受水体富营养化程度和植物种类等多重因素的影响.
富营养水体;粉绿狐尾藻;喜旱莲子草;根际微生物;群落结构
Abstract:Rhizosphere microorganisms in Myriophyllum aquaticum and Alternanthera philoxeroides were identified and enumerated using Sherlock Microbial Identification System (Sherlock MIS), followed by correlation analyses with environmental factors in Lake Rihu (medium-eutrophic) and River Wocaijiang (high-eutrophic) in Ningbo from August to November 2008. Effects of plant rhizosphere on microbial community composition were significant. The abundance of microbes in the rhizosphere of macrophytes was significantly higher than that in the water column in each month. Community composition of rhizosphere microorganism differed significantly between plant species. In Lake Rihu, the number of microbes in the rhizosphere of M. aquaticum was significantly higher than that of A. philoxeroides. There was no significant difference between the abundances of bacteria in the rhizosphere of two plants, while the abundances of rhizosphere actinomyces and fungi differed significantly between two plant species in River Wocaijiang. Correlations between population size of rhizosphere microbe and environmental factors varied greatly among plant species or sampling sites. Abundance of microbes in the rhizosphere of A. philoxeroides was negatively correlated to chemical oxygen demand (COD), while there was no significant correlation with water temperature, total nitrogen (TN), total phosphate (TP) and Chl.a in Lake Rihu. The number of rhizosphere microbes showed a negative correlation with TP and no significant correlation with other environmental factors in River Wocaijiang. The dominant microbial genera in the rhizosphere of the two macrophytes were Pseudomonas, Micrococcus, Chryseobacterium, Acinetobacter etc. Some other specific functional
microbes, e.g. Staphylococcus, Acidovorax, Arthrobacter, were also found in the rhizospheres due to the heterogeneity of environmental conditions and plants. Cluster analyses using Primer 5.0 showed that the similarity of the community structure between summer and autumn was significantly higher than those between the rest seasons where similarities were more dynamic with the value of 21.60%~51.57% in the rhizosphere A. philoxeroides. Diversity of rhizosphere microorganisms was higher in summer than that in autumn in Lake Rihu. In contrast, rhizosphere microbiota was more diverse in autumn than in summer in River Wocaijiang. There was no significant difference of diversity of rhizosphere microbiota between two plants in Lake Rihu. In River Wocaijiang, the diversity of rhizosphere microorganisms of M. aquaticum was higher than that of A. philoxeroides in summer and with the opposite results in autumn. The results obtained in this study indicated that the rhizosphere microbial community structure was affected significantly by the environmental factors and plant species.
Key words:eutrophic water;Myriophyllum aquaticum;Alternanthera philoxeroides;rhizosphere microorganisms;community structure
水生植物对水体环境的修复除植物本身对氮、磷等污染物的吸收作用外,其根际微生物的作用不容忽视.有机物的降解和氮化合物的脱氮、磷化合物的转化等主要是由植物根区的微生物活动来完成[1],根际微生物在植物的营养循环、根部环境的维持、有害污染物的降解以及植物的生长代谢方面发挥着重要的作用[2-3].在天然水体中,水生植物根区与非根区的微生物种类和数量存在较大差异,如湿地基质表面和植物根区的功能性微生物种类和数量相对较多,并且能表现出较高的根际效应[4-6].尤其是细菌,由于其在根际环境中对各种根分泌物的利用率和敏感性远远超过放线菌、真菌、藻类和原生动物等,它们在根际微生物中最为活跃并占主导地位,能与植物根系联合生存并定殖和保持在根部[7],表现出强烈的根际效应.因此,研究水生植物处理污水系统中植物根际微生物的群落结构及其变化,对深入探讨水生植物的净化功能及机理具有十分重要的意义.通常植物种类、季节变化等对植物根际微生物具有很大影响
[8-9],这是否导致水生植物净化效果的明显差异值得探讨.
本实验通过对宁波市日湖、卧彩江2个不同富营养类型水体内2种常见水生净化植物-粉绿狐尾藻(Myriophyllum aquaticum)和喜旱莲子草(Alternanthera philoxeroides)根际微生物的跟踪调查,并结合主要水化学指标的监测,研究不同营养类型水体植物根际微生物的群落结构变化,以期为进一步分析根际微生物与水生植物在污水净化系统中的联合作用机理,强化水生植物的水质净化效果积累基础资料.
1 材料与方法
1.1水生植物根样采集
卧彩江为宁波城区内河,常年接纳大量生活污水,夏季(6~9月)常暴发蓝藻水华,并有间歇性黑臭现象.日湖为宁波城区公园水体,有机污染较严重,但无黑臭现象.2008年8~11月,在2个水体分别选择2个采样点,逐月采集水体中的粉绿狐尾藻和喜旱莲子草新鲜植株根系,以无菌操作方法各采集2~3棵植物根样,约5g,分别置于无菌10mL离心管中.同时以无菌操作采集2个水体水样,在0℃条件下与根样一起立即送回实验室进行分析.
1.2理化因子的测定与分析
水温、pH值、溶解氧(DO)等用多功能水质分析仪(Hydrolab Datasonde 4α,美国)现场测定,叶绿素a浓度(Chla)用叶绿素水下荧光分析仪(bbe FluoroProbe,德国)测定.总氮(TN)采用碱性过硫酸钾消解紫外分光光度法测定,总磷(TP)采用钼酸铵分光光度法测定,化学耗氧量(COD)采用碱性高锰酸钾法测定[10].
1.3微生物数量测定
采用漩涡振荡法分离植物根际微生物.将取自同一水体2个采样点的同种植物根样定量后一并放入10mL离心管中,加无菌水至10mL刻度线,手持离心管,使管底与漩涡振荡器接触,并与其成90°角,设转速为1000r/min,持续振荡15min.
植物根际微生物数量的测定参照文献[11],采用稀释平板法,28℃恒温培养48h后计数,细菌、放线菌和真菌的培养分别采用牛肉膏蛋白胨培养基、高氏一号培养基和马丁氏培养基.采用MIDI Sherlock微生物鉴定系统分别对8月和11月的微生物进行了种类鉴定[12].
1.4数据处理
利用Shannom-Wiener(H′)多样性指数评价植物根际环境的微生物多样性.式中:N为所有单菌落数量;Ni为属(种)i的单菌落数量; S为所有属(种)数.

数据处理及方差分析在SPSS13.0统计软件上进行.其中细菌、放线菌和真菌数量经对数变换后再进行方差分析及多重比较.根际微生物数量与水质参数之间相关性在SPSS软件中进行分析(采用Pearson系数).利用PRIMER 5.0软件对根际微生物群落结构进行聚类分析.
2 结果与分析
2.1根际微生物数量及其动态
调查季节内,2种水生植物根际微生物数量均以细菌所占比例最大,其次是放线菌,真菌数量最少(表1、表2).2个水体中水生植物根际效应都非常明显,各个月份水生植物根际微生物数量均显著高于水体微生物数量,日湖和卧彩江植物根际微生物量要比水体分别高2~3个和1~2个数量级.

表1 日湖、卧彩江水体不同时期微生物数量(×106CFU/mL)Table 1 Microbe population in the water with various months(×106CFU/mL)

表2 水生植物根际不同时期微生物数量(×106CFU/gDW)Table 2 Microbe population in the rhizosphere of acquatic plants with various months(×106CFU/gDW)

表3 日湖、卧彩江水温、TN、TP、COD、Chla变化Table 3 Variations of WT, TN, TP, COD and Chla concentrations in Rihu Laker and Wocaijiang River
日湖粉绿狐尾藻根际细菌数量要显著高于喜旱莲子草(P<0.05),而放线菌、真菌的数量在2种植物之间无显著差异(P>0.05);在卧彩江,粉绿狐尾藻与喜旱莲子草的根际细菌数量无显著差异(P>0.05),而喜旱莲子草根际的放线菌数量要显著高于粉绿狐尾藻(P<0.05),真菌数量在2种植物间亦有显著差异(P<0.05).
就不同月份而言,日湖植物根际微生物数量在10月份最高,卧彩江则以11月份最盛,2个水体中均9月数量最少.总体而言,秋季(10、11月)植物根际微生物数量要显著高于夏季(8、9月)(P<0.05).
2.2植物根际微生物数量与主要环境因子的相关性
监测了2个水体8~11月份水温、TN、TP、COD和Chla等主要理化指标(表3).2个水体间水温和Chla浓度差异不显著(P>0.05),TN、TP、COD差异极显著 (P<0.01),卧彩江富营养程度要显著高于日湖,其中日湖水体属中-富营养型,卧彩江则为重富营养类型[13].8~11月,日湖和卧彩江水温、TN、TP、Chla均呈逐渐下降趋势,COD含量从8~10月逐渐下降,而在11月份又有所回升,这可能与11月份水体中部分植物的枯萎和腐烂降解有关.
相关性分析表明,植物根际微生物数量虽有明显的季节差异,但与水温之间无显著相关关系.日湖中,TN、TP与植物根际微生物数量间无显著相关;而卧彩江中,TP与粉绿狐尾藻(r=-0.983, P<0.05)、喜旱莲子草(r=-0.992,P<0.05)的根际放线菌数量显著负相关,TN与植物根际微生物数量则无显著相关.日湖中COD与水体微生物数量(r=-0.994, P<0.05)、喜旱莲子草根际细菌数量(r=-0.955, P<0.05)同样呈显著负相关.2个水体中水体微生物数量和植物根际微生物数量间呈显著正相关,而水体Chla浓度与植物根际微生物数量无显著相关性.

表4 日湖水体及水生植物根际微生物群落结构差异Table 4 Differences of microbial community structure between rhizosphere of macrophytes and water column in Lake Rihu
2.3根际微生物群落特征
8月,日湖植物根际优势微生物主要为微球菌属(Micrococcus)、假单胞菌属(Pseudomonas)、葡萄球菌属(Staphylococcus)、节杆菌属(Arthrobacter),其中微球菌属、假单胞菌属是水体和2种植物的共有种;卧彩江植物根际优势种也包括微球菌属、葡萄球菌属,但也出现了食酸菌属(Acidovorax)、芽孢杆菌属(Bacillus)、黄杆菌属(Sphingomonas),尤其在粉绿狐尾藻根际,优势微生物种类差异较大,假单胞菌属、微球菌属、食酸菌属是水体和2种植物的共有种.至秋末11月,假单胞菌属依然是2种植物根际的主要优势种类之一,且是水体和2种植物的共有种,与夏季不同,根际优势种中出现不动杆菌属(Acinetobacter)、黄杆菌属.由于不同植物根系环境的特殊性,2种植物在不同季节均出现一些特有种(表4,表5).

表5 卧彩江水体及水生植物根际微生物群落结构差异Table 5 Differences of microbial community structure between rhizosphere of macrophytes and water column in River Wocaijiang
应用水生植物在两个季节的根际微生物种类作统计变量进行聚类分析可以清晰地看出不同情形之间的亲疏程度(图1).8月、11月日湖喜旱莲子草根际微生物群落结构相似性为75.94%,受季节变化影响最小,而其他样品的根际微生物群落结构在8月、11月的相似性为31.55%~33.86%,受到季节变化的影响显著.同一水体内由于植物种类差异导致根际微生物群落结构的差异,8月份日湖和卧彩江内狐尾藻与喜旱莲子草根际微生物群落结构相似性分别为41.28%和51.57%,11月份则仅分别为38.57%和21.60%;同样,同种植物由于水体环境差异也导致根际微生物群落结构的不同,8月和11月日湖和卧彩江内狐尾藻根际微生物群落结构的相似性分别为47.28%和21.60%,喜旱莲子草根际微生物群落结构的相似性则更小,分别为27.53%和24.83%.
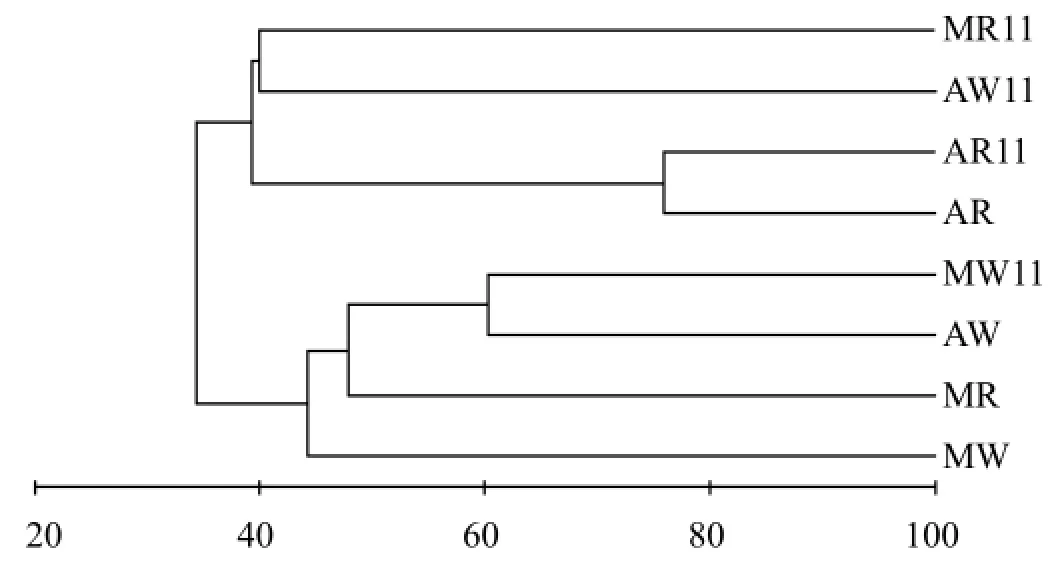
图1 水体及水生植物根际微生物聚类分析Fig.1 Cluster analysis of population of microbes in rhizosphere of aquatic plants and water
由表6可见,8月份日湖水体和水生植物根际微生物多样性处于同一水平,卧彩江则以喜旱莲子草根际微生物多样性最高, 11月份日湖水体微生物和植物根际微生物的多样性较8月份都有所降低,而卧彩江则比8月份有所提高,且植物根际微生物多样性显著高于水体微生物.总体而言,夏季水质相对较好的日湖植物根际微生物多样性要高于时有恶臭的卧彩江,而在秋末,随着卧彩江水质状况的改善,其微生物多样性要高于营养水平较低的日湖水体.

表6 水体及植物根际微生物Shannon-Wiener多样性指数(H′)变化Table 6 The Shannon-Wiener diversity index of microbes in rhizosphere of aquatic plants and water
3 讨论
3.1水生植物根际微生物与环境的相互关系
水生植物根际微生物数量的分布受到水温、植物生长状况和代谢活动、水体营养盐浓度等各种因子的影响,导致不同植物间根际微生物的数量有所差异.由于微生物的生长繁殖及活性受到温度变化的显著影响,同时植物在不同季节的生长状况和代谢活动不同,对有机质的吸收利用存在差异,导致植物根际微生物群落的变化,并影响植物对污水中污染物的去除效果[14].研究结果表明,10、11月份植物根际细菌、放线菌和真菌数量都要高于8、9月份数量,这与梁威等[15]对人工湿地植物根区微生物季节变化的研究结果相同.9月底,卧彩江内的主要植物类群粉绿狐尾藻开始枯萎,11月份多数狐尾藻趋于死亡,释放出的有机物质对水体造成二次污染,对微生物的数量变化产生了较大程度的影响.而真菌能生长在死亡或腐烂的植物上,引起纤维素、木质素果胶等的分解[8],因此真菌数量在秋季有所增加.
有研究表明[14],微生物活动是构建湿地净化污水系统中TN、COD的主要去除途径,植物根际微生物的数量分布和水体环境因子变化之间具有相关性,而TP、TSS等与微生物数量间没有显著的相关性.在本试验中,日湖内TN与植物根际微生物呈正相关,说明TN的去除和植物根际微生物有一定的联系,同时这与水体富营养化程度有关,在卧彩江未出现类似情况,可能是由于TN浓度过高,已超出微生物对其的正常响应.TP、COD与植物根际微生物呈负相关,这可能是因为9月底水生植物优势种粉绿狐尾藻已开始枯萎,11月份部分狐尾藻已经死亡进而释放出氮、磷及有机物质,对水体造成二次污染,导致11月份TP、COD浓度都要高于10月份,并因此呈现根际微生物数量与TP、COD的负相关关系,这种情况在重度富营养化水体卧彩江中表现尤为明显.利用水生植物净化污染水体的过程中,微生物是污水净化的主要参与者,对整个净化生态系统具有重要的影响,但微生物所能发挥的作用受到水体环境条件的综合影响,在富营养水体中,水温、TN等对微生物数量的影响较为显著,而在重度富营养型水体中,水体中溶解气体等环境因子可能成为更加重要的制约因素.
3.2水生植物根际微生物群落特征
水生植物根际微生物多样性受植物类型、植物长势、水体富营养程度等多种因素的影响,同时由于根系的分泌物和脱落物对微生物具有选择和富集的作用,必然导致植物根际微生物群落多样性的变化[16].对植物根际微生物群落结构的聚类分析结果显示,植物根际微生物群落结构受到水体环境条件、植物种类影响显著.冯胜等[17]对太湖的研究表明,水体中细菌的群落结构随着水体富营养化程度的改变产生明显变化,细菌数量呈现随水体营养水平增加而上升的趋势,细菌群落多样性随水体营养水平增加呈现显著的下降趋势,超富营养和接近超富营养湖区的水体中细菌群落多样性最低.Katleen等[18]对4个不同营养水平浅水湖泊中微生物种群多样性变化研究结果表明,随着湖泊营养水平的改变,水体中细菌的群落结构发生了明显变化.王晓丹等[19]对表流和潜流湿地细菌多样性进行研究后同样发现,随着水体有机负荷的增加,微生物的生长受到抑制,生长速度减慢,多样性减少.8月份,卧彩江水体微生物多样性明显低于日湖,原因可能是卧彩江有机污染严重,并经常发生恶臭,限制了中污和寡污带微生物的生长繁殖,同时,卧彩江频繁的藻类水华暴发和衰败,可能对根际微生物群落也产生了一定的影响[20].11月份,虽然水温的回落不利于微生物的生长,但2个水体富营养化程度较8月份都有所降低,N、P等无机营养盐因子成为微生物生长的主要限制因子,同时大量藻类、水生植物分泌物及残体等容易被微生物吸收的溶解性有机物,可能为细菌的生长提供了丰富的营养[21],因而促进了多种微生物的增长.
根际微生物群落特征受到植物根系形态结构与生长特点不同的影响.喜旱莲子草属挺水植物,喜固着基质生长,须根短较密;粉绿狐尾藻属浮叶植物,茎根长而发达;这些均能导致根际微生物种类与数量的不同.本研究分析结果显示,植物种类不同对其根际微生物群落结构的影响要超过其他因素的影响.各个时期植物根际优势种也存在显著差异,有研究认为[22],假单胞菌和芽孢杆菌为土壤典型的发酵类型微生物,它们对植物根系的分泌物和脱落物反应迅速,生长繁殖很快,从植物根际中可以广泛的分离出来,因而通常具有很高的分离率.沈耀良等[23]研究表明,不同类型湿地基质具有不同的优势菌属:人工芦苇湿地中的优势菌属主要有3大类,分别是假单胞杆菌属、产碱杆菌属及黄杆菌属,与天然的芦苇湿地相比,人工湿地中的优势微生物种群组成与其基本相同,这几种优势菌属的微生物生长快速,加之其体内大多含有降解质粒,所以它们是废水中有物污染物降解的主要微生物种群.本研究中,8月份和11月份日湖、卧彩江植物根际都分离到假单胞菌的结果与此相符.对污水净化湿地模拟系统的研究表明[24],湿地微生物优势种主要为耐污能力较强的埃希氏菌属和以碳氢化合物为主要营养来源的假单胞菌属,尤其是假单胞菌在去除碳源污染物方面起着重要的作用.李辉等[25]对人工湿地中氨化细菌去除有机氮的效果研究后认为,人工湿地去除有机氮主要由于氨化细菌的作用,而芽孢杆菌属、假单胞菌属为人工湿地中氨化细菌的优势菌属.结构是功能的反映,在污水处理系统中,首先是芽孢杆菌类对大分子结构的有机物进行破坏,继而由假单胞菌类、大肠菌类等利用这些被破坏的物质,并作进一步地降解.詹发萃等[26]对凤眼莲根区微生物异养细菌群落特征研究后发现,其优势种类主要为气单胞菌属、微球菌属、假单胞菌属、土壤杆菌属和芽饱杆菌属.李科德等[27]也认为假单胞菌属、产碱杆菌属和黄杆菌属等快生型细菌在有机污染物的分解代谢中起着十分重要的作用.本研究结果与该结论在一定程度上吻合,卧彩江和日湖2种水生植物的根际微生物主要优势种为假单胞菌、黄杆菌和微球菌等,说明它们的存在可能促进水体有机物的降解.8 月份,植物根系优势菌种包括食酸菌属、黄杆菌属、节杆菌属等,均属常见具有脱硝作用菌种,适宜的环境条件刺激了这几类菌群的生长.综上所述,植物根际微生物与植物种类、根系类型和水体条件等均有密切关系.
值得一提的是,本研究在采用MIDI Sherlock微生物鉴定系统对微生物进行种类鉴定的过程中,仍需依赖于传统的微生物培养法.由于这种方法人为限定了一些培养条件,无法全面反映微生物生长的自然条件,常常造成某些微生物的富集生长,而另一些微生物缺失,可能导致部分微生物资源遗漏.
4 结论
4.1粉绿狐尾藻和喜旱莲子草根际效应明显,不同月份植物根际微生物数量均要显著高于水体环境,根际微生物数量均以细菌所占比例最大,其次为放线菌,真菌数量最少;根际微生物数量受植物种类、植物生长状态、水体营养盐浓度和其他多种环境因子的综合影响.
4.22种水生植物根际优势菌种均以假单胞菌属、微球菌属、黄杆菌属、不动杆菌属等有机物降解微生物为主,但不同植物和水体环境的植物根际微生物群落结构有较大差异.植物根际微生物多样性受环境条件和植物种类等多重因素的影响,水体高度富营养化和恶臭、蓝藻水华等极端环境会导致植物根际微生物多样性下降,但适度的水体富营养水平有利于更多微生物种类的分布与生长.
[1] Stottmeister U, Wießner A, Kuschk P, et al. Effects of plants and microorganisms in constructed wetlands for wastewater treatment [J]. Biotechnology Advances, 2003,22:93–117.
[2] Elsgaard L, Petersen S O, Debosz K. Effects and risk assessment of linear alkylbenzene sulfonates in agricultural soil.1. Short-term effects on soil microbiology [J]. Environmental Toxicology and Chemistry, 2001,20(8):1656-1663.
[3] Filip Z. International approach to assessing soil quality by ecologically-related biological parameters [J]. Agriculture Ecosystems and Environment, 2002,88(2):689-712.
[4] Ottová V, Balcarová J, Vymazal J. Microbial characteristics of constructed wetlands [J]. Water Science and Technology, 1997, 35(5):117-123.
[5] Machate T, Noll H, Behrens H, et al. Degradation of phenanthrene and hydraulic characteristics in a constructed wetland [J]. Water Research, 1997,31(3):554-560.
[6] 吴 伟,胡庚东,金兰仙,等.浮床植物系统对池塘水体微生物的动态影响 [J]. 中国环境科学, 2008,28(9):791-795.
[7] 李潞滨,刘 敏,杨淑贞,等.毛竹根际可培养微生物种群多样性分析 [J]. 微生物学报, 2008,48(6):772-779.
[8] 项学敏,宋春霞,李彦生,等.湿地植物芦苇和香蒲根际微生物特性研究 [J]. 环境保护科学, 2004,24:35-38.
[9] Liang W, Wu Z B, Cheng S P, et al. Roles of substrate microorganisms and urease activities in wastewater purification in a constructed wetland system [J]. Ecological Engineering, 2003. 21:191-195.
[10] 魏复盛.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 2002.
[11] 范秀荣,李广武,沈 萍.微生物学实验 [M]. 北京:高等教育出版社, 1980.
[12] Sherlock Microbial Identification System, Version 415, MIS Operating Manual [M]. Newark, DE: MIDI, Inc, 2002.
[13] 金相灿.中国湖泊环境 [M]. 北京:海洋出版社, 1995.
[14] 梁 威,吴振斌,詹发萃,等.人工湿地植物根区微生物与净化效果的季节变化 [J]. 湖泊科学, 2004,16(4):312-317.
[15] 梁 威,吴振斌,周巧红,等.构建湿地基质微生物与净化效果及相关分析 [J]. 中国环境科学, 2002,22(3):282-285.
[16] Wasaki J, Rothe A, Kania A. Root exudation, Phosphorus acquisition and microbial diversity in the rhizosphere of white lup ine as affected by phosphorus supply and atmospheric carbon dioxide concentration [J]. Journal of Environmental Quality, 2005, 34(6):2157-2167.
[17] 冯 胜,秦伯强,高 光.细菌群落结构对水体富营养化的响应[J]. 环境科学学报, 2007,27(11):1823-1829.
[18] Katleen V G, Tom V, Nele V. Characterization of bacterial communities in four freshwater lakes differing in nutrient load and food web structure [J]. FEMS Microbiology Ecology, 2005, 53:205-220.
[19] 王晓丹,翟振华,赵 爽,等.北京翠湖表流和潜流湿地对细菌多样性的影响 [J]. 环境科学, 2009,30(1):280-288.
[20] Yannarell A C, KentA D, Lauster G L, et al. Temporal patterns in bacterial communities in three temperate lakes of different trophic status [J]. Microbial Ecology, 2004,46:391-405.
[21] Baines S B, Pace M L. The production of dissolved organic matter by phytoplankton and its importance to bacteria patterns across marine and freshwater systems [J]. LimnolOceanogr, 1991, 36:1078-1090.
[22] 湛方栋,陆引罡,关国经,等.烤烟根际微生物群落结构及其动态变化的研究 [J]. 土壤学报, 2005,42(3):488-494.
[23] 沈耀良,王宝贞.人工湿地系统的除污机理 [J]. 江苏环境科技, 1997,3:1-6.
[24] 陈博谦,尹澄清.污水净化湿地模拟系统中细菌和藻类的生态分布研究 [J]. 生态学报, 1998,18(6):634-639.
[25] 李 辉,徐新阳,李培军,等.人工湿地中氨化细菌去除有机氮的效果 [J]. 环境工程学报, 2008,2(8):1044-1047.
[26] 詹发萃,邓家齐,夏宜琤,等.凤眼莲根区异养细菌的群落特征与异养活性的研究 [J]. 水生生物学报, 1993,17(2):150-156.
[27] 李科德,胡正嘉.芦苇床系统净化污水的机理 [J]. 中国环境科学, 1995,15(2):140-144.
Characteristics of rhizosphere microbial community structure of two aquatic plants in eutrophic waters.
LUKai-hong*, HU Zhi-yong, LIANG Jing-jing,ZHU Jin-yong (Key Laboratory of Applied Marine Biotechnology, Ministry of Education, Ningbo University, Ningbo 315211, China). China Environmental Science, 2010,30(11):1508~1515
X172
A
1000-6923(2010)11-1508-08
陆开宏(1964-),男,浙江余姚人,教授,博士,主要从事水污染生态学研究.发表论文60余篇.
2010-02-21
国家“863”项目(2007AA10Z409);国家自然科学基金资助项目(30771658);浙江省自然科学基金资助项目(Z505319)
* 责任作者, 教授, lukaihong@nbu.edu.cn
