负载LMP-1基因的树突状细胞诱导CTL对鼻咽癌细胞的杀伤效应*
2010-08-14徐瑞凤尤长宣吕成伟罗荣城廖旺军
徐瑞凤, 石 敏, 尤长宣, 吕成伟, 罗荣城, 廖旺军
(南方医科大学南方医院肿瘤中心, 广东 广州 510515)
目前,以放化疗相结合的综合治疗是鼻咽癌(nasopharyngeal carcinoma,NPC)的有效治疗手段,但仍有约40%-50%患者出现局部复发和远处转移。对于治疗失败的患者,寻找新的治疗方法显得尤为重要。研究表明NPC患者的树突状细胞(Dendritic cells,DC)数目有限,免疫功能低下,无法有效地处理和递呈肿瘤抗原可能是肿瘤逃避机体免疫监视的主要原因[1]。以DC疫苗为代表的细胞免疫治疗给常规放化疗治疗失败的NPC患者带来了希望。然而如何安全、高效的将目的基因转染DC是制备DC疫苗的瓶颈之一。本实验探讨超声及微泡造影剂介导基因转染DC的有效性,并进一步观察LMP-1为靶点的DC疫苗对LMP-1阳性NPC细胞株C666-1的体外杀伤作用。
1 材料与方法
1 材料与仪器:重组人白细胞介素2(IL-2)、重组人白细胞介素4(IL-4)、重组人白细胞介素7(IL-7)、重组人粒细胞-巨噬细胞克隆刺激因子(GM-CSF)、肿瘤坏死因子(TNF-α)购自Sigma公司;AIM-V培养基购自GIBCO公司;淋巴细胞分离液购自天津血液研究所;质粒提取试剂盒购自Invitrogen公司;超声微泡造影剂声诺维(Sono Vue)为意大利Bracco公司产品。荧光标记鼠抗人单克隆抗体CD80、CD83、CD86、CD40、H LA-DR为美国BD公司产品。绿色荧光蛋白(GFP)质粒pEGFP-C3-LMP-1、NPC细胞株C666-1、Ecoli DH5α菌株由本室保存。仪器:超声诊断仪为Sequoia 512彩色多普勒诊断仪购自Siemens公司;流式细胞仪FACSCalibur为美国BD公司产品;荧光显微镜IX71购自Olympus公司。
1.2 方 法
1.2.1 外周血DC和淋巴细胞(PBL)的分离与培养:无菌抽取人外周血,外周血来自与C666-1细胞HLA配型相近的健康志愿者,采用密度梯度离心法分离外周血单个核细胞,培养于6孔板中。贴壁5h后轻轻洗去悬浮细胞,贴壁细胞即为DC的前体细胞,加入含GM-CSF(终浓度为800 U/mL)、IL-4(终浓度为1000 U/mL)的AIM-V 培养基,隔天半换液。第5、6天加入TNF-α(终浓度为100 U/ml),第7天获得悬浮细胞。上述洗去的悬浮细胞即为PBL,培养于含IL-2(终浓度为20U/mL)的AIM-V培养基中,隔天半量换液。
1.2.2 质粒/微泡造影剂混合物的制备及质粒pEGFP-C3-LMP1转染DC:使用前向每支微泡造影剂SonoVue中加入5mL生理盐水,轻轻振荡混匀,置4℃冰箱静置30 min。6孔板加入微泡-质粒混合液,其中每孔加入10ul质粒pEGFP-C3-LMP1(1ug/uL)。实验分为4组:①单纯质粒组(A组):加入质粒;②超声照射组(B组):质粒+超声辐照;③微泡造影剂组(C组):质粒+微泡造影剂;④超声+微泡造影剂组(D组):质粒+微泡造影剂+超声辐照。辐照时探头放置于培养板下方,加少量耦合剂,使探头紧贴培养板底部照射。本实验的超声照射条件统一设为频率1.5MHz,机械指数1.0,为照射时间1min,微泡造影剂浓度为20%。另将体外培养的DC分为两组用于检测DC表面表型的表达及体外杀伤实验:①空白对照组,单纯培养的DC;②基因转染组,具体实验方法同上述D组。
1.2.3 流式细胞仪评价GFP质粒的转染效率及检测DC表面分子表型的表达。
1.2.3.1 流式细胞仪评价GFP质粒的转染效率:上述各种实验条件处理后的细胞,立即置于培养箱中培养6h后更换为新鲜的AIM-V培养基,分别于12h、24h、48h在荧光显微镜下观察细胞内GFP表达情况并摄片。48h后收集细胞,流式细胞仪检测各组细胞GFP的表达情况,每组测10000个细胞,GFP阳性细胞的阳性率即为转染率。
1.2.3.2 流式细胞仪检测DC表面分子表型的表达:分别取基因转染组及空白对照组的DC,用流式细胞仪检测其表面表型 CD80 、CD83 、CD86 、CD40 、H LADR的表达情况。
1.2.4 混合淋巴细胞反应(MLR):上述基因转染组及空白对照组培养第7天的DC与PBL按1:20的比例混合,培养于含GM-CSF(终浓度为800 U/mL)、IL-2(终浓度为20 U/mL)、IL-7(终浓度为 20ng/mL)的AIM-V培养基,隔天半量换液,共培养7天,获得CTL。
1.2.5 MTT法测CTL对LMP1阳性的NPC细胞株C666-1的体外杀伤作用:NPC细胞株C666-1培养于含10%胎牛血清的1640培养基的培养瓶中。取对数生长期的C666-1细胞作为靶细胞,另将体外培养的DC分为两组:①空白对照组,单纯培养的DC;②基因转染组,具体实验方法同上述D组。将效应细胞与靶细胞按10:1的比例接种于96孔板中,终体积为200 uL。同时设单独效应细胞和靶细胞对照。效应细胞与靶细胞共培养24h后,每孔加入10 uL M TT(终浓度为5mg/mL),继续培养4h后收集细胞,1000r/min离心 10 min,弃上清,加入 150uL DMSO,低速振荡10 min,待蓝色结晶物充分溶解后,用酶联免疫检测仪在490 nm处检测各孔的吸光值A。CT L杀伤效率=[1-(效靶A值-效应细胞A值)/靶细胞A值]×100%。
1.3 统计学分析:采用SPSS 13.0软件进行统计学分析,计量资料以±s表示。组间比较采用完全随机设计资料的方差分析,P<0.05表示差异有统计学意义。
2 结 果
2.1 荧光显微镜下观察GFP在DC内表达:超声辐照12h后,细胞内开始有GFP表达,荧光强度以48h最亮,以后逐渐减弱,不同组别DC内GFP的表达不同。
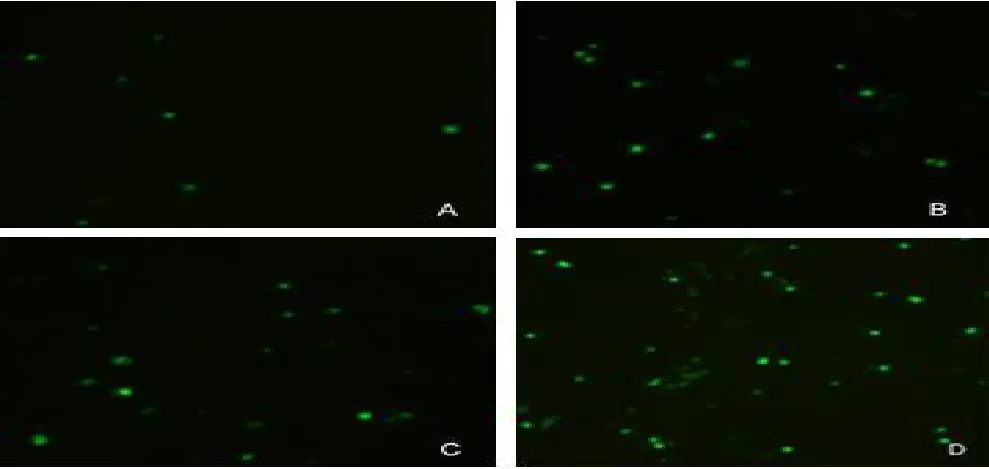
图1 A-D分别为A,B,C,D组DC内GFP的表达情况(×250)
2.2 流式细胞仪检测转染效率,见表1。
表1 各组别基因转染效率的比较(%,±s)

表1 各组别基因转染效率的比较(%,±s)
注:D组和其余3组间均有显著性差异(P<0.01),A、B、C组间差异无统计学意义(P>0.05)。
实验分组 转染效率A组 2.13±0.43 B组 3.90±0.81 C组 2.41±0.53 D组 14.86±2.36
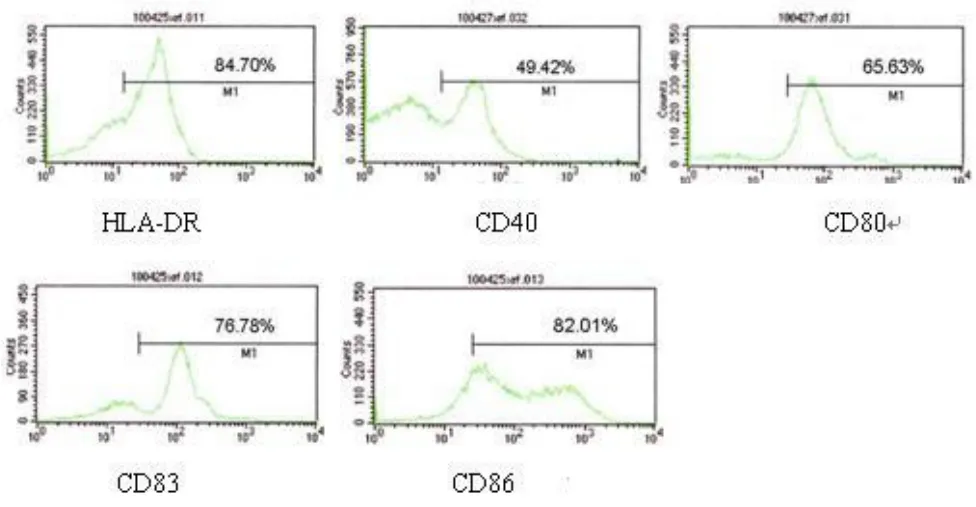
图2 A基因转染组DC表面标志的表达
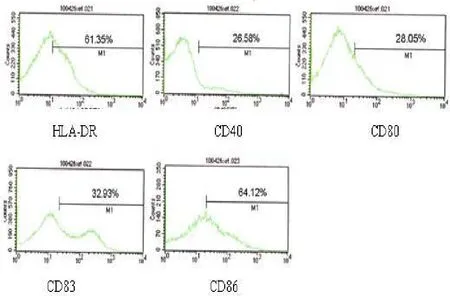
图2 B空白对照组DC表面标志的表达
2.3 流式细胞仪分析DC表面免疫表型的表达:FACS结果显示,基因转染组成熟DC表面的分子标志 HLA-DR、CD40、CD80、CD83、CD86 的比例分别为 84.70%、49.42%、65.63%、76.78%、82.01%,均高于对照组DC的 61.35%、26.85%、28.05%、32.93%、64.12%(见图2)。
2.4 致敏DC诱导的CT L对NPC细胞的杀伤作用:基因转染组的DC所诱导的CT L对表达LMP-1的C666-1细胞有明显的杀伤作用,其杀伤效率为(41.72±3.53)%,而空白对照组杀伤效率为(7.62±2.36)%,两组之间差异具有统计学意义(P<0.01)。
3 讨 论
制备DC疫苗的关键步骤是如何将基因导入细胞,目前常用的基因载体有病毒载体和非病毒载体。病毒载体转染效率较高,转染后基因表达相对稳定,但病毒自身的免疫原性和潜在的致瘤致畸作用限制了其临床应用。非病毒载体转染方法如脂质体转染法、电穿孔法、超声穿孔等转染效率不稳定,但其因安全性较高、耐受性较好、操作简便、可使基因靶向转染、药物靶向释放而越来越受到青睐。
微泡造影剂的主要成分微泡是由气体构成的核心和糖类、蛋白质、脂质或多聚化合物构成的外壳组成。在超声照射下,微泡造影剂破裂所产生的空化效应引起细胞膜通透性增加,促使质粒DNA进入细胞内,从而显著的提高基因的转染率[2,3]。微泡造影剂最早被用于心脏血管的显影,随着微泡造影剂及超声造影技术的发展,目前已广泛应用于肝脏、肾脏、胃肠等器官的显影。近年来开始在基因转染及携带药物靶向性治疗肿瘤方面进行微泡造影剂的研究。
据报道,超声联合微泡造影剂在肝癌细胞、血管内皮细胞、宫颈癌细胞、胰腺癌细胞等多个体外培养的细胞株中成功地促进了基因转染[4,5]。然而超声联合微泡造影剂促进基因转染DC的研究甚少。本研究探讨了超声联合微泡造影剂介导基因转染DC的有效性及与传统非病毒转染方法脂质体转染法的比较。结果显示裸质粒组、单独微泡造影剂组、超声辐照组基因转染效率较低。当超声联合微泡造影剂时,转染效率则大大提高,和国内外报道相符。Lawrie A等[6]的研究显示,和裸质粒转染相比,超声辐照可使基因转染效率提高10倍,如联合微泡造影剂,则基因转染效率提高3000倍。和既往的研究相比,超声联合微泡造影剂介导的基因转染效率远远低于病毒载体,略低于脂质体。但微泡造影剂转染法有前两者无可比拟的优势,即经体表对特定的器官和组织辅以一定的能量照射,微泡造影剂所携带的基因或药物可在体内局部释放,从而达到靶向性目的,可能会取得更高的杀瘤活性。
成熟DC能有效激活初始型T细胞,处于启动、调控并维持免疫应答的中心环节。成熟DC的鉴定,除了其典型的形态学外,还需综合其表面标志CD80、CD83、CD86、CD40 、H LA-DR 等的表达情况。其中共刺激分子CD40、CD80、CD86是成熟DC发挥功能的主要标志。超声微泡造影剂联合脂质体介导的基因转染组 DC表面标志的表达高于空白对照组,其中CD80、CD83、CD86的表达与Ying Pan等[7]的报道基本一致。研究结果说明基因转染DC后并无影响DC的成熟和DC的功能。
EB病毒(EBV)与NPC的发生密切相关,LMP-1目前被广泛认为是EBV的致瘤基因,在NPC的发生、发展和转移中起重要作用[8]。然而LMP-1作为NPC生物治疗靶点的研究较少。Gottschalk S等[9]的研究表明LMP-1转染后的DC可以使鼻咽癌患者外周血中LMP-1特异性的CT L增高500-3800倍,而针对LMP-1为靶点的后续的体外杀伤实验未见相应报道。本研究选取LMP-1作为转染基因,结果显示LMP-1转染组DC所诱导的CTL对表达LMP-1的C666-1细胞杀伤效率,明显高于对照组。这一研究结果表明,DC在GM-CSF、IL-4、TNF-α的刺激下及肿瘤抗原的修饰下,发挥了良好的抗原递呈作用,有效地激活CTL发挥杀伤作用。而空白对照组因没有肿瘤相关抗原递呈,从而无法诱导T细胞产生特异性的免疫反应,因而对靶细胞的杀伤效率较低。
综上所述,本研究结果表明超声联合微泡造影剂可增强基因转染DC,以DC/CT L为基础的细胞免疫是一种有效的抗肿瘤方法。目前该转染方法基因转染效率尚不稳定,对于不同的细胞株、不同的基因转染效率相差较大,且超声作用的最佳参数也不尽相同。超声微泡造影剂用于基因转染尚处于起步阶段,但具有其它基因方法所不具备的优势。相信随着超声作用参数的进一步优化和造影技术的深入研究,超声联合微泡造影剂在肿瘤治疗中将会有广阔的应用前景。
[1]Gabrilovich DI,Ciernik IF,Carbone DP.Dendritic cells in antitumor immune responses.I.Defective antigen presentation in tumor-bearing hosts[J].Cell Immunol,1996,170(1):101-110.
[2]Sundaram J,Mellein BR,Mitragotri S.An experimental and theoretical analysis of ultrasound induced permeabilization of cell membranes[J].Biophys,2003,84(5):3087-3101.
[3]Juffermans LJ,Meijering DB,Van Wamel A,et al.Ultrasound and microbubble-targeted delivery of therapeutic compounds:ICIN Report Project 49:Drug and gene delivery through ultrasound and microbubbles[J].Neth Heart,2009,17(2):82-86.
[4]Lawrie A,Brisken AF,Francis SE.Ultrasound enhances reporter gene expression after transfection of vascular cells in vitro[J].Circulation,1999,99(20):2617-2620.
[5]Guo DP,Li XY,Sun P,et al.Ultrasound-targeted microbubble destruction improves the low density lipoprotein receptor gene expression in HepG2 cells[J].Biochem Biophys Res Commn,2001,343(2):470-474.
[6]Lawrie A,Brisken AF,Francis SE,et a1.Microbubble enchanced ultrasound for vascular delivery[J].Gene Ther.2000,7(23):2023-2027.
[7]Pan Y,Zhang J,Zhou L,et al.In vitro anti-tumor immune response induced by dendritic cells transfected with EBV-LM P2 recombinant adenovirus[J].Biochem Biophys Res Commn,2006,347(3):551-557.
[8]Zheng H,Li LL,Hu DS,et al.Role of Epstein-Barr virus encoded latent membrane protein 1 in the carcinogenesis of nasopharyngeal carcinoma[J].Cell Mol Immunol,2007,4(3):185-196.
[9]Gottschalk S,Edwards OL,Sili U.Generating CT Ls against the subdominant Epstein-Barrvirus LMP1 antigen for the adoptive immunotherapy of EBV-associated malignancies[J].Blood,2003,101(5):1905-1912.
