非小细胞肺癌中EGFR和K-ras基因突变与蛋白表达相关性的研究
2010-08-14栾焕玲孙蕾娜董娜郭燕孙保存战忠利
栾焕玲 孙蕾娜 董娜 郭燕 孙保存 战忠利
天津医科大学附属肿瘤医院病理科,天津市肿瘤防治重点实验室,天津市肺癌诊治中心,天津 300060
近年来,肺癌的发病率和死亡率迅速上升,已跃居我国甚至世界恶性肿瘤的首位。虽然当前治疗技术有了很大提高,但5年生存率并没有明显改善。研究证实表皮生长因子受体(epidermal growth factor receptor,EGFR)的酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)在非小细胞肺癌(non-small cell lung cancer,NSCLC),尤其在肺腺癌的治疗中已取得较好的疗效,但肺癌患者对EGFR-TKI的敏感性与EGFR基因突变密切相关[1]。对于EGFR蛋白表达水平与EGFR-TKI敏感人群的选择,以及与EGFR基因突变的相关性目前尚存在争议[2-3]。K-ras基因是EGFR途径下游的一个重要的信号分子,它的突变可以导致EGFRTKI原发性耐药,是预后不良的指标。而目前关于K-ras蛋白表达与基因突变相关性研究还很少,两者之间的相关性有待进一步探讨。
1 材料和方法
1.1 病例样本及患者资料 留取2009年3月—2009年8月间天津医科大学附属肿瘤医院行手术切除的200例NSCLC患者的肿瘤新鲜组织标本,冰冻保存。所有肿瘤组织均制备组织切片并行HE染色,并由2 名病理医师采用双盲法确诊为NSCLC。其中男性117例,女性83例;年龄20~79岁;有吸烟史者120例;腺癌111例,鳞癌68例,腺鳞癌8例,大细胞癌9例,肉瘤样癌4例;85例患者存在淋巴结转移。
1.2 试剂 EGFR兔抗人单克隆抗体,购自北京中杉金桥生物技术有限公司;K-ras鼠抗人单克隆抗体,购自福州迈新生物技术开发公司。
1.3 方法
1.3.1 序列检测 取肿瘤组织约25~30 mg,机械剪碎。采用E.Z.N.ATMTissue DNA Kit(购自Omega公司)提取基因组DNA,实验步骤,按照操作说明书。而后取1 μL DNA样本,行1%琼脂糖凝胶鉴定DNA样本进行质量检查以及浓度估计。
采用PCR方法扩增EGFR基因的4个外显子(18、19、20和21)和K-ras基因第2外显子,引物序列见表1。PCR反应体系总体积为20 μL:1’ HotStar-Taq缓冲液,2.0 mmol/L Mg2+,0.2 mmol/L dNTP,上、下游引物各0.2 μmol/L,HotStarTaq聚合酶(Qiagen Inc.)1 u和10 ng模板DNA。PCR反应条件为:94 ℃ 15 s、56 ℃30 s、72 ℃ 1 min,共35个循环,最后72 ℃延伸2 min。PCR产物经纯化后,用ABI 3130XL测序仪进行序列分析(基因测序工作由上海天昊生物科技有限公司负责)。用Polyphred软件分析,并结合人工校对后比较测序结果与基因库中EGFR基因序列(NM_005228.3)的差异。

表1 PCR法检测EGFR 18-21外显子和K-ras第1外显子特异性引物序列Tab.1 Specific primers of EGFR 18-21 exons and K-ras exon 1 in PCR detection
1.3.2 免疫组织化学检测 所有标本均经10%甲醛溶液固定,石蜡包埋,按4 μm连续切片,烘干。采用SP法行EGFR和K-ras蛋白检测(2种抗体稀释度均为1∶100)并设立阴性对照。EGFR蛋白着色定位于细胞质和细胞膜上,评分根据着色的细胞所占百分比和染色强度综合评价,≤10%记为(-);>10%者淡黄色记为(+),棕黄色记为(++),棕褐色记为(+++)。K-ras蛋白定位于细胞核,评分也是根据着色的阳性细胞百分比和染色强度综合评价。阳性细胞百分比:0为0分,≤25%为1分,26%~50%为2分,51%~75%为3分和>75%为4分。染色强度以多数细胞的显色反应为准,无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。将两项指标评分相加,根据总分数划分为4级,即0~1分(-);2~3分(+);4~5分(++);6~7分(+++)。将(-)和(+)记为阴性,将(++)和(+++)记为阳性。
1.4 统计处理 采用SPSS 17.0统计软件进行数据分析。各项比较均采用χ2检验,双侧检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 基因突变及其与临床病理学特征之间的关系
2.1.1 测序检测基因突变 200例样本中,66例携带有EGFR基因突变(33%),其中外显子18发生突变的有3例,外显子19发生突变的有37例,外显子20发生突变的有2例,外显子21发生突变的27例,有3例患者同时携带有两个外显子的突变,分别为19和21、18和20以及18和21号外显子同时突变(图1)。
11例携带有K-ras基因突变,突变率5.5%,均为点突变,其中10例位于第12密码子,1例位于第13密码子吗,其中G12A 6例(最常见),G12C 2例,G12S 2例,G13V 1例。在本次研究中尚未发现同时携带有EGFR和K-ras 2个基因发生突变的样本。
2.1.2 基因突变与临床病理学特征之间的相关性 200例NSCLC患者中,EGFR基因发生突变的总例数为66(33%),其中腺鳞癌突变率为87.5%,腺癌为50.5%,明显高于鳞癌2的.9%、大细胞癌的1例(11.1%)和肉瘤样癌0例(0%)(P<0.05)。细支气管肺泡癌(bronchioloalveolar carcinoma,BAC)和含BAC成分的混合型腺癌突变率为61.3%,明显高于不含BAC成分的腺癌27.8%(P<0.05)。女性患者突变率51.8%,明显高于男性患者的19.7%(P<0.05)。<65岁年龄组突变率41.2%,明显高于≥65岁年龄组17.4%(P<0.05)。无吸烟史患者突变率52.5%,明显高于有吸烟史患者20.0%(P<0.05)。EGFR基因突变和有无淋巴结转移之间并无统计学差异(P>0.05,表2)。
K-ras总突变例数11例(5.5%),其中腺癌7例;9例为吸烟者;8例为男性。
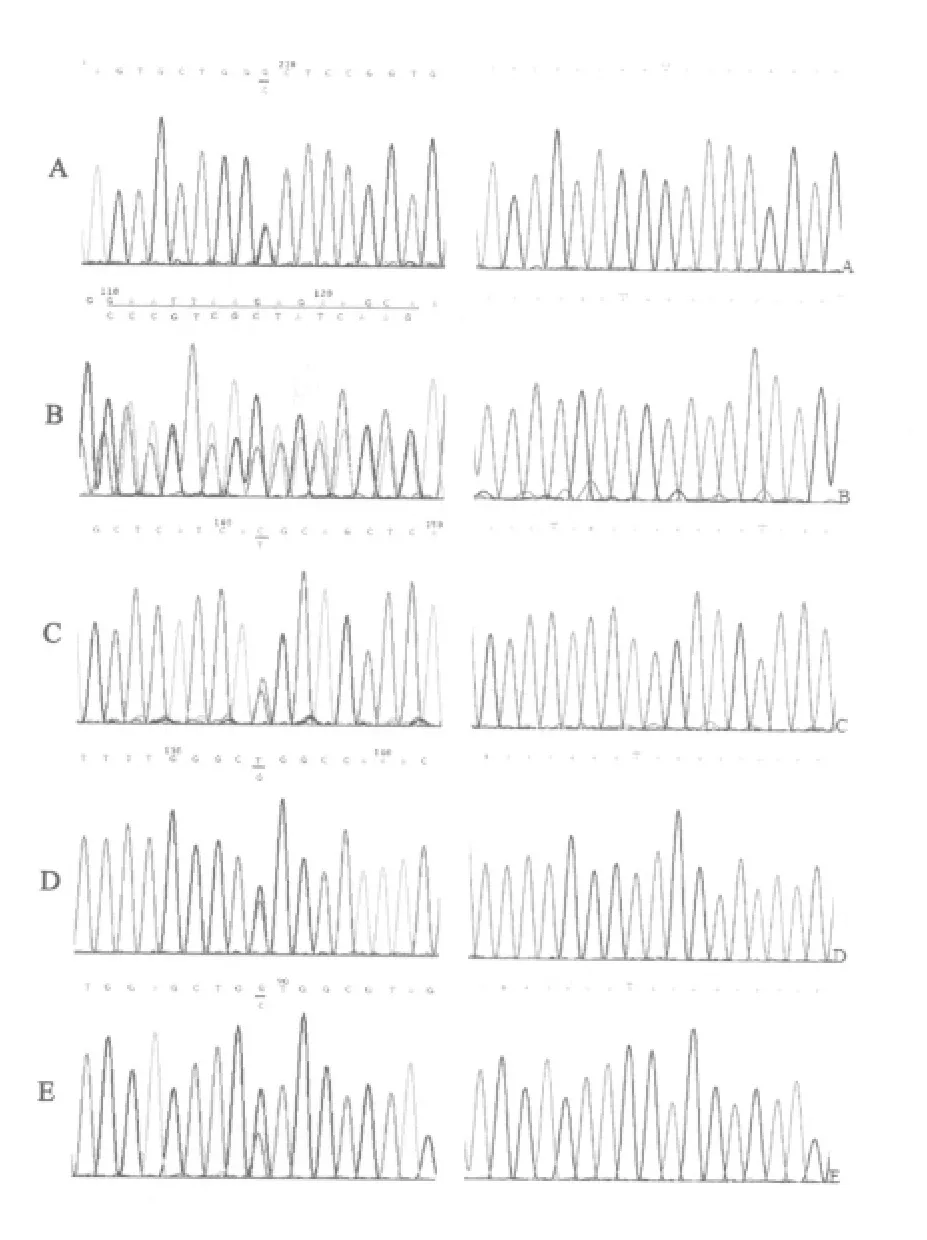
图1 基因突变测序分析Fig.1 Sequencing analysis of gene mutation
2.2 EGFR和K-ras蛋白表达与临床病理学特征之间的关系 免疫组织化学检测结果显示,EGFR阳性表达的为32例(16.0%)。其中无吸烟史者阳性表达20例(25.0%),明显高于有吸烟史者12例(10.0%)(P<0.05);5种病理类型之间经比较,差异有统计学意义(P<0.05);但与患者的年龄、性别和有无淋巴结转移无明显相关(P>0.05,表2,图2A)。
K-ras阳性表达的为105例(52.5%),5种病理类型之间经比较,差异无统计学意义(P>0.05)。与患者的年龄、性别、吸烟史和有无淋巴结转移之间,差异亦无统计学意义(P>0.05,图2B)。
2.3 蛋白表达与基因突变的关系 EGFR蛋白表达与总的基因突变例数以及18、20和21号外显子的突变,经统计分析,结果显示差异均无统计学意义(P>0.05);但和19号外显子的突变,差异有统计学意义(P=0.043),19外显子有突变者EGFR蛋白阳性率为27.0%,19外显子无突变者阳性率为13.5%。统计学分析显示,K-ras蛋白的表达与其基因突变无相关性(P>0.05)。
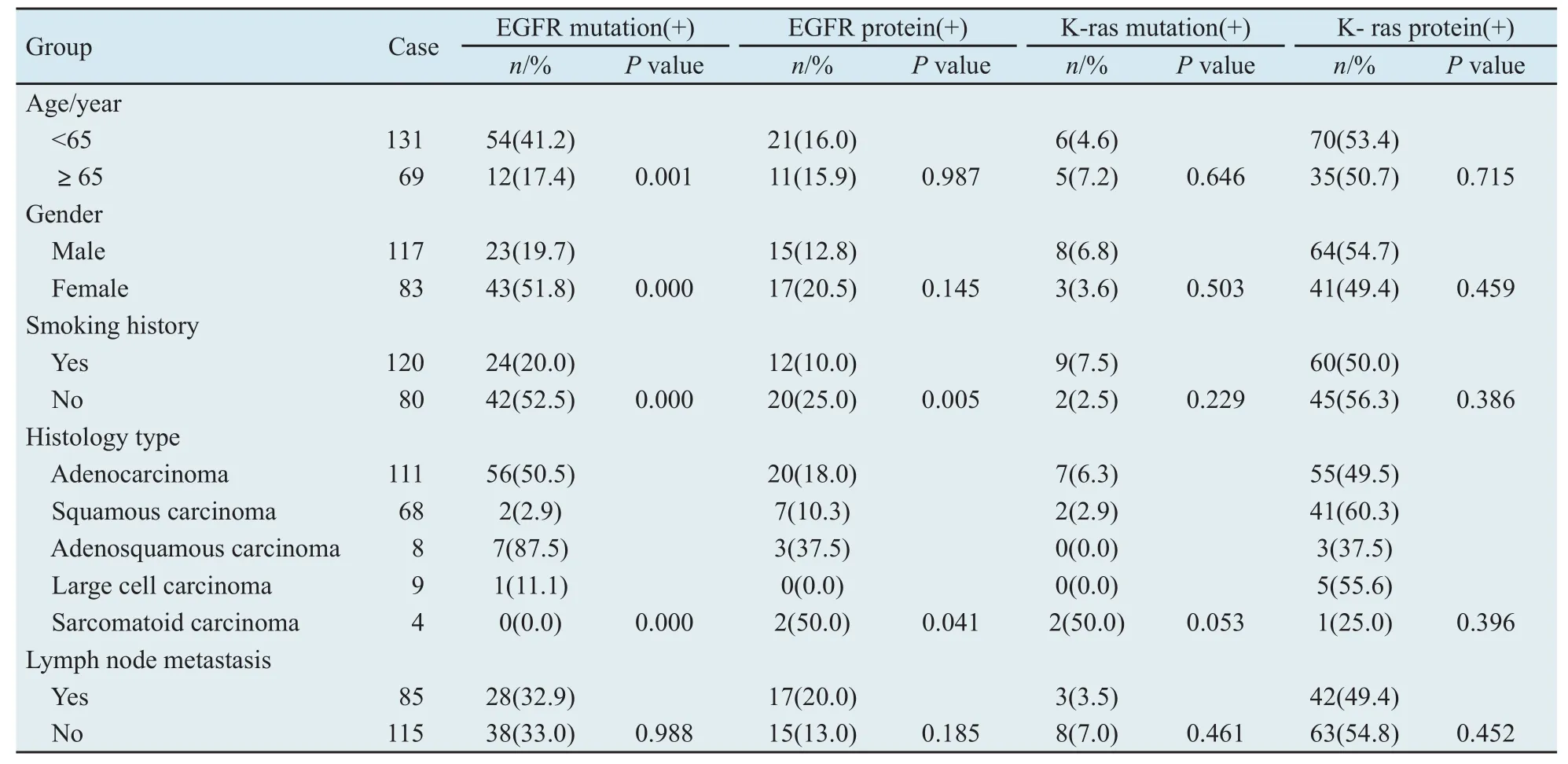
表2 EGFR、K-ras基因突变和蛋白表达情况与各临床病理参数对比分析Tab.2 The comparative analysis of EGFR, K-ras gene mutations and protein expression with clinicopathological parameters(χ2 test)

图2 EGFR和 K-ras蛋白在非小细胞肺癌组织中的表达Fig.2 Expression of EGFR and K-ras protein in non-small cell lung cancer tissues(DAB, ×400)
2.4 基因突变和蛋白表达与吉非替尼治疗效果的关系 随机调查25例服用吉非替尼的患者(Ⅲ期患者5例,其余20例皆为Ⅳ期,随访时间自2009年3月起,截止到2009年11月30日),其中15例检测出携带EGFR突变,12例(其中8例EGFR蛋白表达阴性,4例蛋白阳性病例中3例突变位于19号外显子)患者有效(80%);10例未发现EGFR突变的患者为2例有效(20%),经比较两者差异有统计学意义(P=0.005)。对蛋白表达的统计分析显示,EGFR表达阳性者有效率为66.7%,阴性者有效率为52.6%,两者之间差异无统计学意义(P=0.661)。25例患者中无K-ras基因突变者;K-ras蛋白阳性表达者,有效率为54.5%,阴性表达者有效率为57.1%,两者之间差异同样无统计学意义(P=1.000)。
3 讨 论
多项研究显示EGFR基因突变与EGFR-TKI敏感性呈显著正相关,EGFR突变型患者对EGFR-TKI应答率可达65%~83%,而野生型患者仅10%~15%。Tamura等[1]对ⅢB/Ⅳ期NSCLC患者的研究证实EGFR突变患者对吉非替尼应答率可达75%,疾病控制率达96%,无进展中位生存期11.5个月,1年生存率79%。本研究中同样发现EGFR基因突变者对吉非替尼有效率达到80%,而野生型则仅为20%,提示 EGFR基因突变是选择接收EGFR-TKI吉非替尼治疗的重要指标之一。
本研究中检测发现,EGFR基因突变率为33%,显著高于北美地区的3%~25%和南欧地区的10%~24%[4]。突变的发生主要集中发生在EGFR基因19和21外显子中,分别占到总突变的56%和41%;19外显子大都为框架缺失突变;21外显子都为L858R点突变;统计结果显示,在女性、非吸烟者和腺癌(特别是BAC及含有BAC的混合型腺癌)患者中发生率更高,这与以往的文献报道一致[5]。同时发现<65岁年龄组EGFR基因突变率明显高于≥65岁年龄组患者(P<0.05),说明较年轻患者EGFR基因突变率更高,对EGFR-TKI更敏感。另外,本研究发现腺鳞癌突变率达87.5%,高于腺癌的50.5%,这可能与腺鳞癌例数少(8例)有关。Kang等[6]利用激光纤维切割的方法将腺鳞癌中腺癌和鳞癌分离,随后分别检测两者EGFR基因突变的情况,结果显示两种不同类型的肿瘤组织之间EGFR基因突变状态是一致的,说明两者很可能起源于同一祖细胞;还发现腺鳞癌患者EGFR基因的突变率以及临床特征与腺癌相一致(即腺鳞癌EGFR基因突变率也主要发生于女性和非吸烟者中),表明腺鳞癌对EGFR-TKI敏感人群的选择可以参照腺癌。
据文献报道,EGFR蛋白在NSCLC中阳性表达率大多在50%以上,而本研究结果显示仅为16%,但这与Dacic等[7]在NSCLC中的研究结果相似(15.9%)。导致差异的原因可能有:抗体选择不同,评分标准不一和评分的主观性等。EGFR蛋白表达能否用于指导EGFRTKI应用尚存在争议。多项研究显示EGFR蛋白表达与基因突变之间不存在一致性[8-10]。但也有少量研究显示,服用EGFR-TKI的患者,蛋白过表达组生存期要比阴性组长[3],且在EGFR基因突变与EGFR-TKI相关性未发现之前,临床医生主要就是根据是否有EGFR蛋白表达来指导应用EGFR-TKI的。本研究显示,EGFR蛋白过表达与EGFR基因总突变之间无相关性,但与19号外显子突变存在显著正相关(其机制尚不清楚)。12例(EGFR突变型)服用吉非替尼有效的NSCLC患者中蛋白阴性8例,而阳性表达只有4例,另外,治疗无效患者中还有2例蛋白表达阳性。在这种情况下如果选用蛋白表达来指导吉非替尼的话,将有8例理论上有效的患者不能接受吉非替尼治疗,而有2例理论上无效的患者接受过度治疗,从而造成医疗资源浪费和患者经济损失。因此笔者认为基因检测是指导EGFR-TKIs最优先选择的手段。只有当基因检测受到限制或检测失败时,蛋白表达才可在一定程度上用于指导。
本研究显示K-ras基因突变可导致患者对EGFR-TKI的原发性耐药,是预后不良的指标[11]。本研究检测结果显示,K-ras基因的突变率仅为5.5%,显著低于西方人群的19.0%[12]。且K-ras基因突变更多见于男性和吸烟患者,与文献报道一致。目前尚没有发现同时携带EGFR和K-ras基因突变的病例,说明二者的存在是相互排斥的。因此K-ras基因突变状况的检测对于指导EGFR-TKIs的使用也是必要的。本组研究中K-ras蛋白阳性表达率为52.5%,与K-ras基因突变之间不存在相关性(P=0.27)。对25例服用吉非替尼患者的研究结果显示,K-ras蛋白的表达与吉非替尼疗效间无相关性。
综上所述,现阶段预测EGFR-TKI疗效的指标主要有:EGFR基因突变状态,EGFR基因拷贝数和EGFR蛋白表达。前两者已经被多项实验证实与EGFR-TKI敏感性呈显著正相关。而EGFR表达与EGFR-TKI的相关性,目前尚存在争议,需进一步证实研究。
[1] Tamura K, Okamoto I, Kashii T, et al. Multicentre prospective phase Ⅱ trial of gefitinib for advanced non-small cell lung cancer with epidermal growth factor receptor mutations:results of the West Japan Thoracic Oncology Group trial(WJTOG0403) [J]. Br J Cancer, 2008, 98(5): 907-914.
[2] Parra HS, Cavina R, Latteri F, et al. Analysis of epidermal growth factor receptor expression as a predictive factor for response to gefitinib ('Iressa', ZD1839) in non-small cell lung cancer [J]. Br J Cancer, 2004, 91(2): 208-212.
[3] Tsao MS, Sakurada A, Cutz JC, et al. Erlotinib in lung cancer:molecular and clinical predictors of outcome [J]. N Engl J Med, 2005, 353(2): 133-144.
[4] Pinter F, Papay J, Almasi A, et al. Epidermal growth factor receptor (EGFR) high gene copy number and activating mutations in lung adenocarcinomas are not consistently accompanied by positivity for EGFR protein by standard immunohistochemistry [J]. J Mol Diagn, 2008, 10(2): 160-168.
[5] Kim KS, Jeong JY, Kim YC, et al. Predictors of the response to gefitinib in refractory non-small cell lung cancer [J]. Clin Cancer Res, 2005, 11(6): 2244-2251.
[6] Kang SM, Kang HJ, Shin JH, et al. Identical epidermal growth factor receptor mutations in adenocarcinomatous and squamous cell carcinomatous components of adenosquamous carcinoma of the lung [J]. Cancer, 2007, 109(3): 581-587.
[7] Dacic S, Flanagan M, Cieply K, et al. Significance of EGFR protein expression and gene amplification in non-small cell lung carcinoma [J]. Am J Clin Pathol, 2006, 125(6): 860-865.
[8] Macarenco RS, Uphoff TS, Gilmer HF, et al. Salivary glandtype lung carcinomas: an EGFR immunohistochemical,molecular genetic, and mutational analysis study [J]. Mod Pathol, 2008, 21(9): 1168-1175.
[9] Li AR, Chitale D, Riely GJ, et al. EGFR mutations in lung adenocarcinomas: clinical testing experience and relationship to EGFR gene copy number and immunohistochemical expression [J]. J Mol Diagn, 2008, 10(3): 242-248.
[10] 孙光远,赵学维, 李兵, 等. EGFR在女性非小细胞肺癌中的表达及其临床意义[J]. 中国癌症杂志, 2007, 17(5):380-384.
[11] Sun GY, Zhao XW, Li B, et al. The expression of EGFR and its clinical significance in the female non-small cell lung cancer[J]. Cancer Journal of Chinese, 2007, 17(5): 380-384.
[12] Massarelli E, Marileila Varella-Garcia M, Tang X, et al. K-ras mutation is an important predictor of resistance to therapy with epidermal growth factor receptor tyrosine kinase inhibitors in non-small cell lung cancer [J]. Clin Cancer Res, 2007,13(10): 2890-2896.
[13] Marchetti A, Milella M, Felicioni L, et al. Clinical implications of K-ras mutations in lung cancer patients treated with tyrosine kinase inhibitors: An important role for mutations in minor clones [J]. Neoplasia, 2009, 11(10): 1084-1092.
