早中期慢性肾脏病患者颈动脉内中膜增厚及粥样斑块的危险因素研究
2010-07-16朱昭章桑晓红
朱昭章,桑晓红
本文要点
1 肾小球滤过率、血尿酸、纤维蛋白原、收缩压、年龄是早中期 CKD患者发生动脉粥样硬化的独立危险因素。
2 早中期 CKD患者已发生动脉粥样硬化,其心血管疾病的发生可能比以往认识的更早,对 CKD患者心血管疾病的防治应从早期开始。
慢性肾脏病 (CKD)患者是发生动脉粥样硬化性疾病的高危人群,其心脑血管疾病的患病率及相关的病死率均远远高于普通人群。颈动脉是评估动脉粥样硬化的特殊部位,可以反映全身的粥样硬化情况。本研究通过探讨 1~4期 CKD患者发生颈动脉粥样斑块及内中膜增厚的危险因素,为 CKD患者动脉粥样硬化性疾病的早期预防提供线索。
1 资料与方法
1.1 一般资料 选择 2006年 1月—2009年 6月在新疆医科大学第一附属医院住院病房诊治的 CKD 1~4期患者 217例为研究对象。CKD的诊断遵循慢性肾脏病及透析的临床实践指南(K/DOQI):(1)肾脏损伤 (肾脏结构或功能异常)≥3个月,可以有或无肾小球滤过率 (GFR)下降,可表现为病理学检查异常或肾损伤的指标 (包括血、尿成分)异常或影像学检查异常;(2)GFR<60 ml·min-1·m-2≥3个月,有或无肾脏损伤证据。采用中国修订的 MDRD公式计算 eGFR,eGFR(ml· min-1· 1.73 m-2)=175×{〔Scr(μmol/L)/
88.4 〕-1.234} ×年龄-0.179×0.79(女性)。其中 CKD 1期 18例(占 8.29%),CKD 2期 25例 (占 11.52%),CKD 3期 74例(占 34.10%),CKD 4期 100例 (占 46.09%)。原发病包括慢性肾小球肾炎 52例 (占 23.96%)、高血压及缺血性肾损害67例 (30.88%)、糖尿病肾病 57例 (占 26.27%)、继发性肾小球肾炎 (乙肝相关肾炎、狼疮性肾炎、紫癜性肾炎等)30例 (占 13.82%)、 其他原因 11例 (占 5.07%)。
1.2 方法
1.2.1 颈动脉多普勒超声检查 由专人操作,检测仪器为HP4500型彩色多普勒超声诊断仪,使用血管超宽频探头,频率为 7.5 MHz。检查部位包括双侧颈总、颈内动脉,颈动脉内中膜厚度 (IMT)于颈总动脉分叉近端 1 cm处后壁测量或IMT最厚处,左右颈总动脉各测量 3次,取平均值,以平均IMT≥0.85 mm为异常,以 IMT或最大 IMT>1.2 mm为斑块。1.2.2 收集一般资料 记录所有研究对象的性别 (Gender)、年龄 (Age)、体质指数 (BMI,kg/m2)、收缩压 (SBP)、舒张压 (DBP)等。
1.2.3 血液生化指标检测 留取空腹静脉血,分离血清,用自动生化分析仪测定血清肌酐 (Scr)、血尿酸 (UA)、空腹血糖 (FPG)、总胆固醇 (TC)、三酰甘油 (TG)、高密度脂蛋白 (HDL)、低密度脂蛋白 (LDL)、清蛋白 (ALB)、纤维蛋白原 (FIB)、血清钙 (Ca)、血清磷 (Ph),计算钙磷乘积(Ca×Ph)。
1.3 统计学方法 采用 SPSS 11.5统计软件,计量资料以 (x±s)表示。IMT、颈动脉斑块与各因素之间的关系采用 Pearson相关或 Spearman相关进行分析,有无颈动脉 IMT异常及有无颈动脉斑块与各因素间的相关性采用非条件 Logistic逐步回归进行分析。检验显著性取 α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 患者的一般情况 217例患者中男 119例,女 98例;平均年龄 (56±11)岁;BMI(21.0±5.7)kg/m2;血压:SBP(147±28)mm Hg(1 mm Hg=0.133 kPa),DBP(95±11)mm Hg;血脂:TC(4.17±1.04)mmol/L,TG(1.46±0.63)mmol/L,HDL(1.03±0.43)mmol/L,LDL(2.31±0.75)mmol/L;FPG(5.7±1.8)mmol/L,ALB(35.7±3.8)g/L,UA(399.0±97.3)mmol/L,FI B(4.9±1.2)g/L;血 Ca(2.14±0.20)mmol/L,血 Ph(1.89±0.64)mmol/L,Ca×Ph(3.20±1.27)mmol/L;eGFR(62.9±27.4)ml·min-1·1.73 m-2。
2.2 颈动脉 IMT增厚及粥样斑块的影响因素 相关分析显示,IMT与年龄、SBP、FI B、FPG、UA及血 Ph呈正相关,而与 eGFR呈负相关 (见表 1)。颈动脉斑块与年龄、FI B、FPG、UA及血 Ph呈正相关,而与 eGFR呈负相关 (见表 2)。
2.3 颈动脉 IMT增厚及粥样斑块的影响因素 Logistic回归分析结果 进一步将以上各相关因素放入多因素逐步回归模型中(分级依据:eGFR按 CKD分级、FPG<6.1 mmol/L和≥6.1 mmol/L、血 UA<420.0 mmol/L和 ≥420 mmol/L、FI B<4.0 g/L和≥4.0 g/L、血 Ph<1.6 mmol/L和 ≥1.6 mmol/L、年龄<60岁和≥60岁、SBP<140 mm Hg和≥140 mm Hg),从结果中可以看出,随着 CKD分级的加重,发生颈动脉 IMT增厚的相对危险度增大,其相对危险度为 1.244;血 UA增高、FI B增高、SBP升高、高龄更易发生颈动脉 IMT增厚 (相对危险度分别为 1.310、1.856、1.874、1.211)。而随着 CKD分级的加重,发生颈动脉斑块的相对危险度也增大,其相对危险度为1.220;FIB增高、高龄发生颈动脉斑块的相对危险度分别为1.345、1.221(见表 3、表 4)。
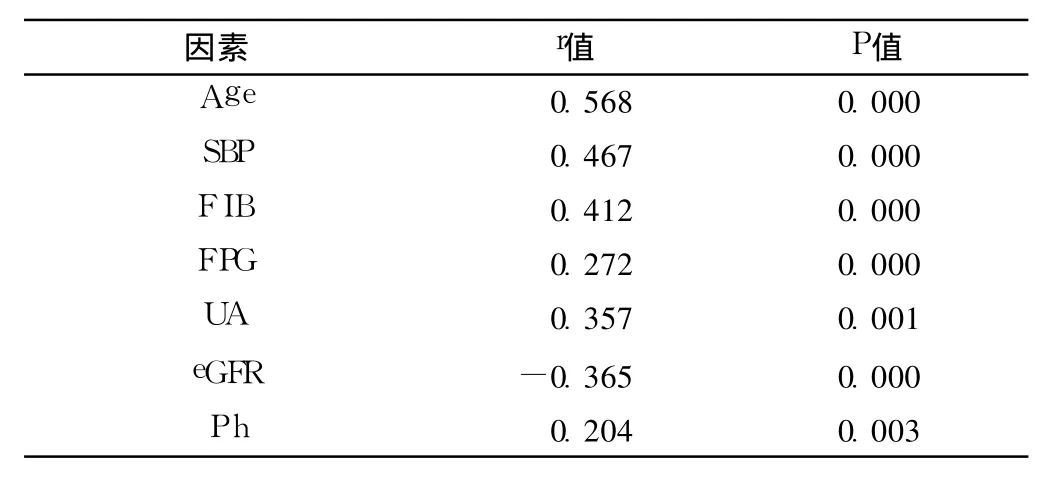
表 1 颈动脉 IMT的影响因素Table 1 Influential factors of carotid arteries intimia-media thickness
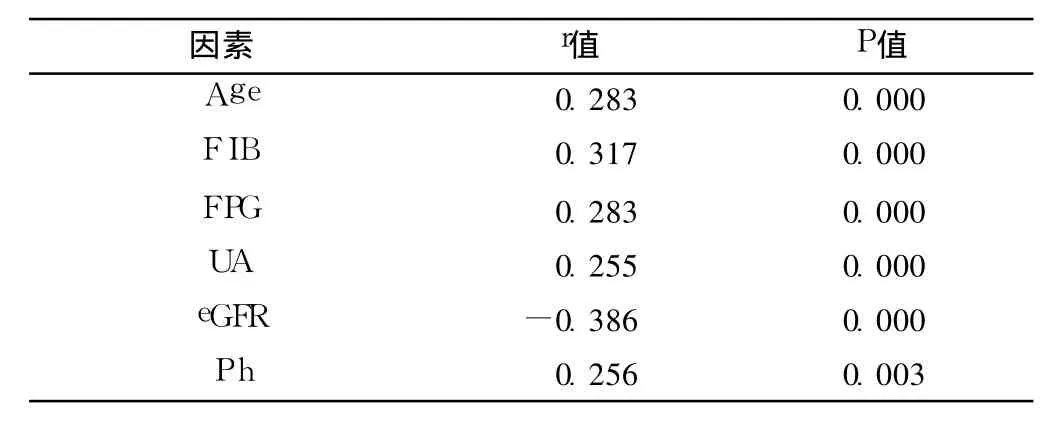
表 2 颈动脉斑块的影响因素Table 2 Influential factors of carotid arteries atheromatous plaques
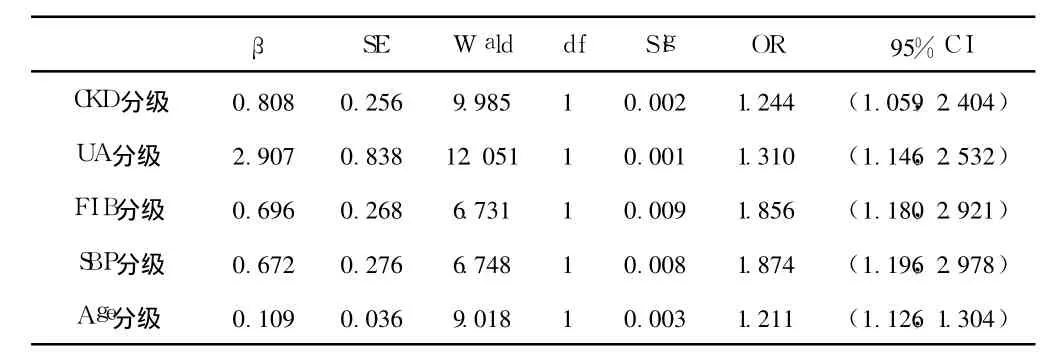
表 3 颈动脉IMT与其相关因素 Logistic回归分析结果Table 3 Logistic regression analysis of the influential factors for patients with carotid arteries intimia-media thickness
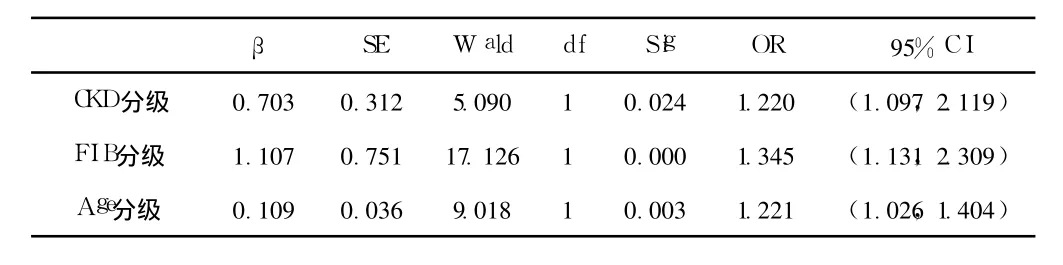
表 4 颈动脉斑块与其相关因素 Logistic回归分析结果Table 4 Logistic regression analysis of the influential factors for patients with carotid arteries athetomatousplaques
3 讨论
在 CKD患者中,动脉粥样硬化的替代指标 (如颈动脉IMT增厚)、亚临床表现 (如颈动脉粥样斑块、冠状动脉狭窄)及临床动脉粥样硬化性疾病等的发生率均明显增高,这提示慢性肾衰竭促进了动脉粥样硬化的发生和发展。由动脉粥样硬化引起的心血管疾病是慢性肾衰竭患者的主要并发症及导致死亡的主要原因。
近年研究发现,即使在早期 CKD患者中,心血管疾病的危险也明显增加[1-2]。美国高血压联合报告 (JNCⅦ)中已明确提出肾脏疾病是心血管疾病的独立高危因素[3]。很多研究证实了这一观点[4-5],前瞻性随机对照研究 HOPE中也提示,即使轻微的肾功能减退 (血肌酐 100~200μmol/L)也是独立于高血压、糖尿病、清蛋白尿之外的导致动脉硬化和冠状动脉病变的危险因素[6]。并且肾功能不全本身可能与传统危险因素一样,具有类似或者更大的导致心血管疾病的作用[7]。本研究发现,随着 CKD分级的加重,发生颈动脉 IMT增厚、颈动脉斑块的相对危险度也增大,进一步证明了以上观点。
本研究单因素相关分析显示FIB与颈动脉 IMT、颈动脉斑块呈正相关,多因素逐步回归分析进一步证明 FI B是颈动脉IMT、颈动脉斑块的独立危险因素。CKD患者普遍存在全身慢性微炎症反应,体内正性急性期反应蛋白,如 C-反应蛋白、FIB以及促炎性细胞因子,如 IL-1、IL-6、肿瘤坏死因子 -α(TNF-α)等均可能升高。慢性微炎症状态会对机体多方面造成影响。目前认为,动脉粥样硬化是一种炎症性疾病,许多证据表明动脉粥样硬化的形成与炎症相关。FIB可使血黏度升高,促进血小板聚集和血管平滑肌细胞增生。FIB还可刺激血管内皮细胞表达黏附分子,引导白细胞黏附于血管内皮细胞表面,并释放炎症因子,使被黏附血管产生炎症反应,启动动脉粥样硬化过程[8]。大量研究显示,慢性炎症反应可增加CKD患者心血管事件的死亡率。FI B增加还提示 CKD患者处于高凝状态,易导致动脉硬化及粥样斑块形成;肾小球内高凝状态易形成微血栓,从而加剧肾小球硬化,促进肾功能进一步恶化,使罹患心血管并发症的危险度增加。
一些大规模、前瞻性研究结果表明,血 UA升高与动脉粥样硬化程度[9]及冠心病、心肌梗死、原发性高血压、脑卒中、总心血管事件的发生率、死亡率、总死亡率等呈正相关,并具有独立性,不依赖于一些常见的心血管危险因素及肾损伤指标[10-11]。本研究显示,血 UA与颈动脉 IMT及颈动脉斑块呈正相关,多因素回归分析还发现高尿酸血症是颈动脉 IMT增厚的独立危险因素。血 UA高者,动脉粥样硬化程度重。在CKD患者中多合并有继发性高尿酸血症,CKD和高尿酸血症相互协同作用,可能进一步促进了动脉粥样硬化的发生。
本研究单因素相关分析及多因素回归分析均证实,年龄也是 CKD患者动脉粥样硬化的独立危险因素,这与大多数学者的观点是一致的[12-13]。因为伴随年龄增长全身动脉的管壁会发生某些组织学变化:主动脉和分支动脉内膜增厚,在承受压力的中膜层,弹性纤维和板层失去规则的排列,而表现为变薄、分裂、破碎和片断化,这些结构的改变导致动脉的僵硬度和阻力增加。而小动脉壁的透明变性、壁/腔比值变大、内膜增厚、对血管活性物质反应增加等也均可使外周血管阻力明显增加。
许多研究证实,在一般人群和高血压人群中,收缩压和脉压的增加与动脉硬化的进展密切相关[14-16]。本研究也发现,收缩压与颈动脉 IMT呈正相关,多因素回归分析进一步证明其是颈动脉 IMT增厚的独立危险因素。肾性高血压是 CKD最常见的并发症,50%以上的慢性肾衰竭患者合并不同程度的血压升高,约 95%的 CKD患者进展至终末期肾脏病时并发高血压,原有高血压患者有肾功能损害时血压更难于控制。长期高血压将引起左室肥厚、动脉硬化和心力衰竭。
CKD 3期时即可出现钙磷失衡、继发性甲状旁腺功能亢进,上述改变相互影响,导致血管钙化和心血管事件发生危险增加。其中高血磷是引起心血管钙化的关键因素。高磷血症可引起甲状旁腺激素分泌增加,介导血管内皮细胞增生分化成骨样细胞,促进血管钙化。钙、磷代谢紊乱所致的转移性软组织钙化可能导致动脉血管顺应性降低,致使动脉硬化、动脉狭窄以及冠状动脉和心脏瓣膜的钙化等。血管钙化与粥样硬化斑块数量、心肌梗死和心脏骤停等心血管事件的发生密切相关。本研究发现血清 Ph与颈动脉 IMT呈正相关,但未出现在多因素逐步回归模型中,可能与早中期 CKD患者血 Pxh水平相对较低有关。
纵向研究表明,高脂血症是诱发心脏病的危险因素之一。本研究未发现 TC、TG、LDL与颈动脉 IMT、颈动脉斑块相关,可能与 3、4期 CKD患者逐渐出现营养不良导致血脂偏低有关。然而 Kaysen等[17]研究观察到,当应用普通指标评价肾病患者的血脂时,经常不能得出血脂与心血管疾病发生的相关性。例如低密度脂蛋白胆固醇 (LDL-C)在普通人群中与心血管疾病的发生明确相关,而在 CKD患者中 LDL-C变化很大,没有明确的升高趋势,这是由于应用的计算公式 “TGHDL-C/5”中,没有考虑脂类残余团和脂蛋白 a〔LP(a)〕,而这两项在 CKD患者中均升高。在心血管疾病患者中 LP(a)分解代谢减慢,导致 LP(a)升高,因此认为升高的 LP(a)才是 CKD患者发生心血管疾病的重要血脂标记物。在今后的研究中应进一步完善 CKD患者 LP(a)对心血管并发症的影响。
1 Govindarajan G,Saab G,Whaley-Connell A.Outcomes of carotid revascularization in patients with chronic kidney disease[J].Adv Chronic Kidney Dis,2008,15(4):347-354.
2 Essig M,Escoubet B,de Zuttere D,et al.Cardiovascular remodelling and extracellular fluid excess in early stages of chronic kidney disease[J].Nephrol Dial Transplant,2008,23(1):239-248.
3 Sarnak MJ,Levey AS,Schoolwerth AC,et al.Kidney disease as a risk factor for development of cardiovascular disease[J].Circulation,2003,108:2154-2169.
4 Nanayakkara PW,Kiefte-de-Jong JC,ter-Wee PM,et al.Randomized placebo-controlled trial assessing atreatment strategy consisting of pravastatin,vitamin E,and homocysteine lowering on plasma asymmetric dimethylarginine concentration in mild to moderate CKD[J].Am JKidney Dis,2009,53(1):41-50.
5 Shah DS,Polkinghorne KR,Pellicano R,et al.Are traditional risk factors valid for assessing cardiovascular risk in end-stage renal failure patients?[J].Nephrology,2008,13(8):667-671.
6 Mann JF,Gerstein HC,Dulau-FloreaI,et al.Cardiovascular risk in patients with mild renal insufficiency[J].Kidney,2003,(Suppl 84):S192-S196.
7 Bax L,Algra A,Mali WP,et al.Renal function asa risk indicator for cardiovascular events in 3216 patients with manifest arterial disease[J].Atherosclerosis,2008,200(1):184-190.
8 Nasiek M,Kos-Kudla B,Ostrowska Z,et al.Acute phase proteins:C-reactive protein and fibrinogen in young women with polycystic ovary syndrome[J].Pathophysiology,2007,14:23-28.
9 Sun Y,lin CH,Lu CJ,et al.Carotid atherosclerosis,intima media thickness and risk factors-an analysis of 1781 asymptomatic subjects in Taiwan[J].Atherosclerosis,2002,164:89-94.
10 Fang J,Alderman MH.Serum uric acid and cardiovascular mortality the NHANESI epidemiologic follow-up study,1971-1992.National Health and Nutrition Examination Survey[J].JAMA,2000,283:2404-2410.
11 Alderman MH,Cohen H,Madhavan S,et al.Serum uric acid and cardiovascular events in successfully treated hypertensive patients[J].Hypertension,1999,34:144-150.
12 Toussaint ND,Lau KK,Strauss BJ,et al.Associations between vascular calcification,arterial stiffnessand bone mineral density in chronic kidney disease[J].Nephrol Dial Transplant,2008,23(2):586-593.
13 Covic A,Mardare N,Gusbeth-Tatomir P,et al.Arterial wave reflections and mortality in haemodialysis patients-only relevant in elderly,cardiovascularly compromised?[J].Nephrol Dial Transplant,2006,21(10):2859-2866.
14 Toprak A,Reddy J,Chen W,et al.Relation of pulse pressure and arterial stiffness to concentric left ventricular hypertrophy in young men(from the Bogalusa Heart Study)[J].Am J Cardiol,2009,103(7):978-984.
15 Olafiranye O,Qureshi G,Salciccioli L,et al.The relationship between effective arterial capacitance and pulse wave velocity is dependent on left ventricular stroke volume[J].Angiology,2009,60(1):82-86.
16 Montalcini T,Gorgone G,Pujia A.Association between pulse pressure and subclinical carotid atherosclerosis in normotensive and hypertensive post-menopausal women[J].Clin Exp Hypertens,2009,31(1):64-70.
17 Kaysen GA,Kumar V.Inflammation in ESRD:causes and potential consequences[J].J Ren Nutr,2003,13(2):158-160.
