茶树叶面真菌与内生真菌群落结构的比较
2010-06-27张宇玲李小容杨民和
张宇玲,李小容,杨民和
(福建师范大学生命科学学院,福州 350108)
植物叶片栖居有丰富的真菌群落。人们把附着于叶面并可以定居和增殖的真菌群体称为叶面真菌(fungal epiphytes)[1];而将寄生于正常生长植物体内的真菌称为内生真菌(fungal endophytes)[2]。已有的绝大多数研究都将叶面真菌和内生真菌独立进行。因此,叶面真菌与内生真菌虽然生存的微环境相距不到1 mm,但人们对它们的种群结构差异和相互关系知之甚少。近年来,由于微生态学理论和技术的飞速发展,人们逐步认识到植物叶围(phyllosphere)微生物的种群和互作关系比人们预料的要更为复杂而多样[3]。
20世纪70年代以来,已有一些零星的报道对健康植物叶片上叶面真菌和内生真菌作了比较研究。日本学者Osono实验室对山茱萸(Swida controversa)、偃伏梾木(Cornus stolonifera)和纯齿山毛榉(Fagus crenata)等植物的叶面真菌和内生真菌进行了分离和比较。研究结果表明,植物叶面和内部组织生长有明显不同的真菌群落,真菌的定植和分布受生长季节和叶片生育期的影响[4~7]。在咖啡(Coffea arabica)的健康叶片上,生长有丰富的真菌群落,内生真菌和叶片真菌的种群差异明显,交叉分布的种类很少;同时还发现,内生真菌的物种多样性比叶面真菌更为丰富;不同取样地点的同种植物的叶片中,真菌群落也有差异[3]。相对于种类丰富、生态类型复杂多样的植物,这些研究结果显然不足于概述植物叶围真菌的全貌。
茶树(Camellia sinensis)是一种重要的经济树种,有关茶树相关微生物的研究已经积累了一些资料。在茶园土壤微生物、茶树生长繁殖与微生物、微生物与茶叶加工贮藏、微生物与茶树保护、微生物与茶的综合利用等多方面都有相关的报道[8]。卢东升等对茶树内生真菌的种类及分布以及对豫南茶园树栖真菌、芽及叶栖真菌群落及种群演替做了大量调查,并对茶园微生物及其应用进行了很好的总结[9]。谢丽华等[10]对茶树品种、叶片生育期和茶叶化学成份对内生真菌的影响做过报道。但是,同时分离茶树叶面真菌与内生真菌,比较、分析它们的种群结构及其差异,还未见相关的报道。本研究对茶树叶面真菌与内生真菌进行分离和鉴定,以期进一步了解其种群结构及微生态关系。
1 材料与方法
1.1 样本采集
从福建农林大学园艺学院实验茶园(福州金山)采集健康成熟的叶片,茶树品种为黄旦和铁观音,在茶园这两品种相邻种植。采用五点取样法,每品种每点分别取健康成熟叶片10片,共50片。成熟叶片指得是当年生长季节发出的,叶色嫩绿、角质化不明显的展开叶片。样本编号后,装入无菌纸袋,带回实验室后立即进行真菌的分离,或将植物样本存放于4℃冰箱中备用。
1.2 叶面真菌
采用两种方法分离茶树叶面真菌。分离方法1,叶片组织粘附法[3]:将采集的同一品种的茶树叶片充分混合,然后随机取20片,用直径为0.5cm的无菌打孔器取叶片组织块,从每一叶片随机取6个组织块,分别接入补加50mg/kg链霉素的PDA培养基中,每直径为9cm的培养皿中放入6~8个组织块(3~4块近轴面朝下),置于28℃恒温培养箱中培养1 h后,再在无菌条件下将叶片组织块移出培养皿。将移走叶片组织块的培养皿放入28℃恒温培养箱中培养。待出现菌落时,按菌落形态的不同,挑取少量菌丝进行分离纯化。分离方法2,稀释平板法:将采集来的同一品种的茶树叶片混合,分别选取形状大小相近的茶树叶片10片,置于盛有100ml无菌水的三角瓶内,强力、反复振荡15min后,制得菌悬液,稀释10、100、1000倍3个不同浓度,用无菌吸管吸取0.2ml接种到PDA平板中,每个浓度梯度设3个重复,涂抹均匀后置于28℃恒温箱中培养;待菌落长出后统计菌落数并挑取单菌落于PDA平板上纯化培养,用于菌类的鉴定。
1.3 内生真菌分离
内生真菌的分离参见谢丽华等[10]的方法。待叶片组织周围出现菌体时,进行分离纯化。
1.4 真菌形态鉴定
由于分离获得的部分真菌在常规培养条件下不产生繁殖体,按其在PDA培养基上的生长情况和菌落形态划分为不同的形态型(morphospecies)。诱导产孢的方法如下:分离纯化的真菌移接到PDA培养基或经高压灭菌的茶叶上,在28℃恒温、黑暗条件下培养。至菌丝长满培养皿后,将培养皿取出,放置于室温下继续培养;或在无菌条件下用接种环轻刮菌丝表面,诱导真菌产生孢子。培养期间注意观察真菌生长特征,随时进行照相记录。对在人工培养条件能产孢的真菌,参照魏景超和陆家云等的相关专著,进行真菌属的初步鉴定;选择优势种真菌(分离率≥30%)采用ITS序列分析鉴定。
1.5 优势真菌ITS序列分析
1.5.1 基因组DNA的提取 参照武汉琴等(2009)的方法进行。
1.5.2 rDNA-ITS的扩增与序列测定 nrDNA ITS区用引物ITS4:5′-TCCTCCGCTTATTGATATGC-3′和ITS5:5′-GGAAGTAAAAGTCGTAACAAGG-3′,按程序:95℃预变性5 min;接以95℃30s,56℃30s,72℃30s,30个循环;最后72℃保温7min进行PCR扩增。引物由上海生工生物工程有限公司合成。扩增的反应体系( 25µl):超纯水16.75µl,10×Buffer2.5µl,2mmol/L dNTP2.5µl,10µmol/L ITS4 1µl,10µmol/L ITS5 1µl,Taq酶0.25µl,模板1µl。PCR产物经凝胶回收、纯化后送上海生工生物工程有限公司测序。
1.5.3 系统发育树的构建 以每个菌株的ITS和5.8S序列作为靶序列,在GenBank中用BLAST程序搜索同源序列,挑选与菌株序列相近的参考序列用于系统发育分析。利用Bioedit软件编辑,Clustalx软件将序列匹配排列,phylip3.67构建ITS系统树,选用邻接法(Neighbor-joining)分析,每次搜索进行随机1 000次重复,获得的自展检验(bootstrap)数值标记在分支上。
1.6 数据统计分析
叶面真菌和内生真菌的分离率按以下公式进行:

数据的显著性分析采用t-检验:双样本等方差假设。
2 结果与分析
2.1 茶树叶面真菌与内生真菌多样性
采用常规叶部真菌分离方法,依据PDA培养基上菌落形态的差异,从茶树品种黄旦叶片上分离得到叶面真菌共26种形态型,其中15种在PDA培养基上能产生或诱导产生繁殖体;内生真菌18种形态型,其中6种在PDA培养基上能产生或诱导产生繁殖体,叶面真菌与内生真菌检出率分别为100%和87.52%,其中分离率大于3%的共18种形态型。从茶树品种铁观音叶片分离到叶面真菌16种形态型,其中10种在PDA培养基上能产生或诱导产生繁殖体;内生真菌15种形态型,其中7种在PDA培养基上能产生或诱导产生繁殖体,叶面真菌与内生真菌检出率分别为100%和94.27%,其中分离率大于3%的共12种形态型。人工培养条件下能产生繁殖体的真菌包括拟盘多毛孢属(Pestalotiopsis spp.)、芽枝霉属(Cladosporium sp.)、短梗霉属(Aureobasidium sp.)、青霉属(Penicillium spp.)、曲霉属(Aspergillus sp.)、镰刀菌属(Fusarium sp.)、球座菌属(Guignardia sp.)、刺盘孢属(Colletotrichum spp.)的真菌。本研究中,同时分离获得一些人工培养条件下不产孢或难于产孢的、未鉴定的真菌。
2.2 优势真菌鉴定
对分离率大于30%的6种茶树叶围真菌,在形态学观察的基础上,进一步分析其ITS序列,采用邻接法(Neighbor-joining)构建N-J树,进行初步的鉴定。结果表明:菌株B1为Pestalotiopsis theae,菌株B2为Cladosporium cladosporioides(GenBank序列号:FJ216453),菌株B4为Botryosphaeria rhodina(GenBank序列号:FJ216454),菌株B8为Aureobasidium pullulans(GenBank序列号:FJ216455),菌株nsy-12为Guignardia mangiferae(GenBank序列号:EU671077),菌株N13确定为Colletotrichum sp.。
2.3 两种方法分离叶面真菌比较
采用两种分离方法均分离到4种相同的优势种叶面真菌。但从分离所得的真菌总数上,稀释平板法所得叶面真菌种类(形态型)少于叶片组织黏附法所获得的真菌;在茶树品种黄旦上,采用稀释平板法分离到叶面真菌15种形态型,而采用叶片组织黏附法获得26种形态型;在铁观音上,采用稀释平板法分离到叶面真菌12种形态型,而采用叶片组织黏附法获得16种形态型。采用叶片黏附法获得的4种优势真菌在茶树品种黄旦、铁观音中的分离率无显著差异(p<0.01),但采用稀释平板法分离获得的Pestalotiopsis theae、Cladosporium cladosporioides、Aureobasidium pullulans在黄旦和铁观音中的相对分离率存在显著差异(p<0.01),Botryosphaeria rhodina无显著差异(p=0.33)(表1)。同时,采用不同分离方法,真菌数量也大不相同,如采用叶片黏附法,Pestalotiopsis theae在黄旦和铁观音中的分离率分别为90.57%和96.74%;而采用稀释平板法,相对分离率分别只有7.47%和31.11%;其它3种真菌的数量也存在明显的差异(表1)。因此,采用不同的叶片表面真菌分离方法,检出真菌的种类和数量,均表现出明显的差异。
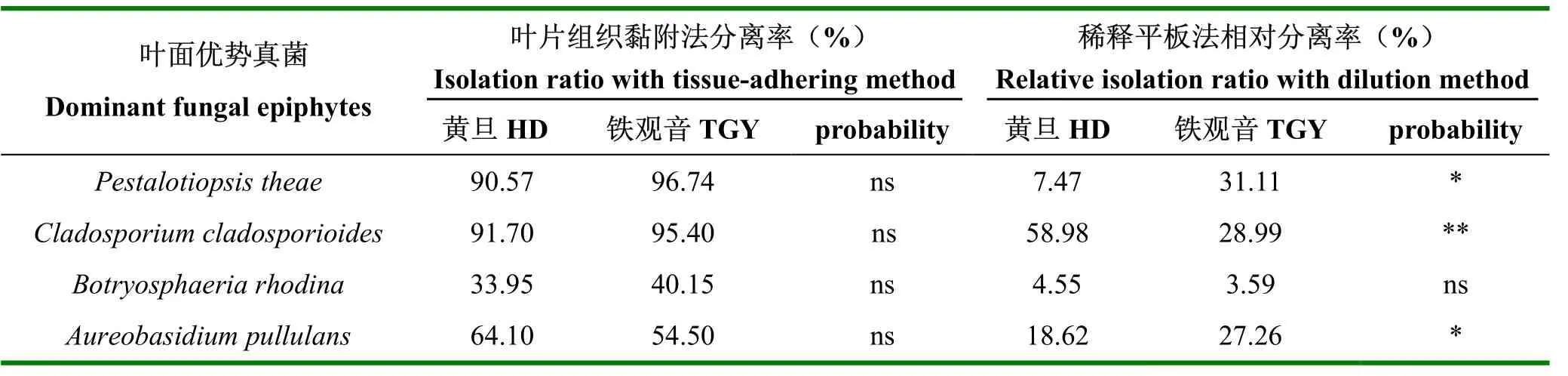
表1 叶面真菌两种不同分离方法结果比较Table 1 Comparison of fungal epiphytes with two isolation methods
2.4 茶树叶面真菌与内生真菌比较
由表2可知,Pestalotiopsis theae、Cladosporium cladosporioides、Botryosphaeria rhodina、Aureobasidium pullulans等4种真菌为叶面优势真菌,Guignardia mangiferae、Colletotrichum sp.等为内生优势真菌,其中仅Pestalotiopsis theae为叶面优势真菌与内生真菌所共有,其余叶面优势真菌均未在内生真菌中分离得到,数据分析结果表明两群落的真菌组成存在显著差异。
在叶面真菌中,Pestalotiopsis theae、Cladosporium cladosporioides、Botryosphaeria rhodina和Aureobasidium pullulans均能从同一茶叶组织块中长出,特别是Pestalotiopsis theae、Cladosporium cladosporioides和 Aureobasidium pullulans,表现出高度重叠(>64.10%);内生真菌中,Guignardia mangiferae 和 Colletotrichum sp.可以部分重叠,有22.33%~35.67%的Colletotrichum sp.和Guignardia mangiferae从同一组织块中同时长出。而Pestalotiopsis theae 则一般单独长出(表2)。
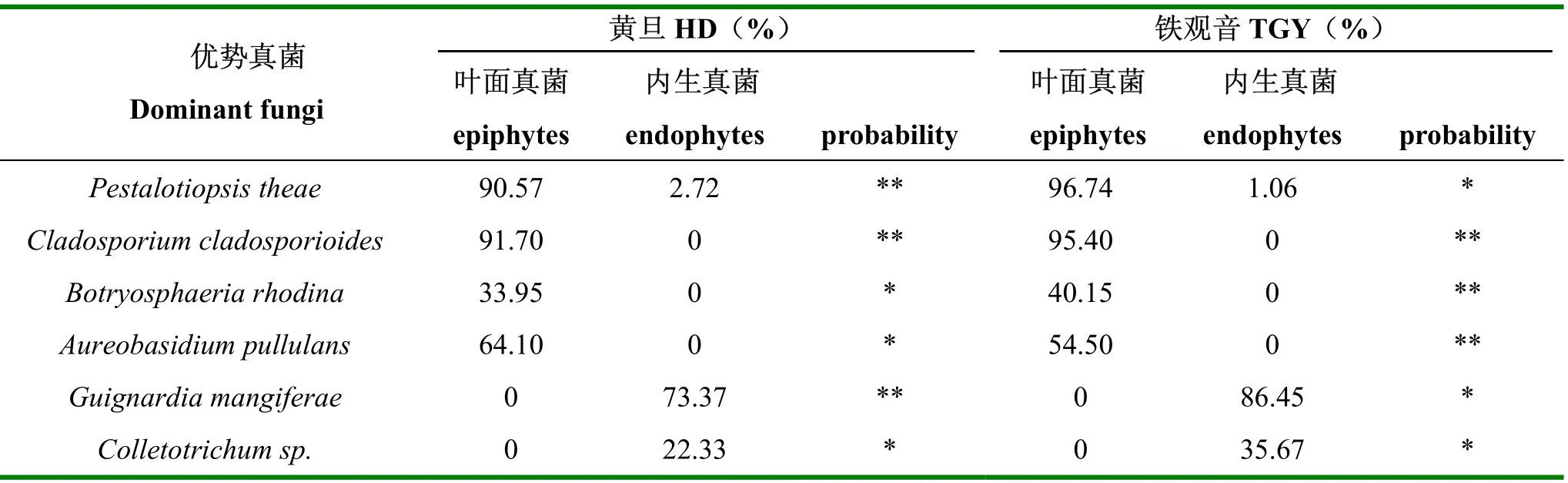
表2 茶叶叶面真菌与内生真菌优势种比较Table 2 Epiphytes vs endophytes in the six major fungal species isolated from tea leaves
3 讨论
结果显示,采用不同的分离方法用于分析真菌的种群数量和结构,能显著地改变分离结果。叶片洗涤后稀释平板分离法对那些以孢子粘附在叶面上的真菌计数较为准确,但以菌丝粘附的真菌则难以洗下。而在培养基上黏附一定时间后移走叶片组织块,却能分离到更多种类的叶面真菌。从叶片组织黏附法的分离结果看,移去茶叶组织块,培养2d后即可见茶拟盘多毛孢的菌丝大量生长。因此,在PDA培养基上,茶拟盘多毛孢具有更强的生长能力。对照于稀释平板法的结果(表1),可见茶拟盘多毛孢在茶叶表面的数量并不比芽枝状枝孢霉和出芽短梗霉更多,但因生长能力强,加上组织黏附法对叶面的真菌没有稀释作用,因而生长迅速的真菌易造成对生长慢的真菌的抑制作用。除少数情况外[3],大多数研究者采用稀释平板法分离叶面真菌。本研究的结果表明,采用两种方法分离、分析植物叶面真菌,各有优点。但由于这些方法均依赖于培养基的筛选作用,因而也存在明显的缺陷。采用PCR扩增和变性梯度胶电泳技术(DGGE),Yang 等[12]在植物叶片表面洗涤液中检测到丰富的微生物群落,其中许多种类在人工培养基上难于分离。因此,结合应用人工分离和分子生物学技术,能更为全面地反映自然条件下茶树叶围真菌群落结构的真实情况。
研究结果表明,茶树叶围维持有丰富的真菌物种多样性;茶叶表面和内部组织中,生长有完全不同的真菌群落。黄旦叶面真菌与内生真菌的种类(p<0.01)与数量(p<0.05)均存在显著不同,在黄旦叶片中叶面真菌的物种多样性(26种形态型)远大于内生真菌物种多样性(18种形态型);而在铁观音中,叶面真菌的物种多样性(16种)与内生真菌物种多样性(15种)差异不大(p=0.55),但各种真菌的数量存在显著差异(p<0.01)(表1,表2)。在茶树叶围占优势的6种真菌中,芽枝状枝孢霉、出芽短梗霉和柑桔葡萄座腔菌只存在于茶叶的表面;而芒果球座菌和刺盘孢菌只生活与茶叶组织内。茶拟盘多毛孢既可生活于茶叶组织内,也可生活于茶叶表面(表2);但茶拟盘多毛孢在茶叶表面占据优势,在茶叶内部组织中则分布很少(<3%)。Santamaria & Bayman[3]对咖啡叶面真菌与内生真菌进行了研究,共分离得到内生真菌66种,叶面真菌63种,其中仅4种为叶面真菌与内生真菌所共有;在叶面真菌中,Botryosphaeria sp.和Pestalotia sp.是优势种真菌;而在内生真菌中,Xylaria sp.、Collerotrichum sp.和 Guignardia sp.是优势种真菌。在山茱萸(Swida controversa)、纯齿山毛榉(Fagus crenata)和偃伏梾木(Cornus stolonifera)的叶部真菌研究中,也得出相似的结果[4-7]。Osono[13]从山茶(Camellia japonica)叶片中分离得到真菌共79种,其中叶面真菌52种,内生真菌44种,17种为叶面真菌与内生真菌所共有;Pestalotiopsis sp.、Cladosporium cladosporioides.、Colletotrichum gloeosporioides、Aureobasidium pullulans等真菌作为优势种叶面真菌存在,而Geniculosprium sp.、Colletotrichum gloeosporioides 和 C.acutatum.则是内生真菌中的优势种;在优势种中,只有Colletotrichum gloeosporioides 为叶面真菌和内生真菌种群所共有。和本研究的结果相比较,虽然同为山茶属植物,茶树和山茶叶面真菌的种群组成较为相似,但内生真菌的种群组成则很不同。以上分析表明,在植物叶围,不同物种之间优势种叶面真菌和内生真菌的种类可能有不同;但在同一物种叶片上,叶面真菌与内生真菌种群的组成均存在显著的差异。前人研究还显示,虽然植物叶围真菌的物种多样性非常丰富,但优势种真菌只是少数几种[1-7,13]。本研究的结果支持这一结论。
研究结果还显示,在茶树叶围的优势真菌中,除茶拟盘多毛孢可以明确为茶树叶部的病原菌,在一定条件下可导致茶树轮斑病外,本研究分离获得的其它叶围真菌,特别是优势种真菌,在茶树中均未有作为病原菌的记录[14]。这些真菌可能在维持茶树叶围微生态平衡和病虫害控制等方面发挥重要的作用。当然,有些真菌也可能是茶树的非寄主(non-host)寄生物,在一定条件下能导致其它植物的病害。如芒果球座菌,是热带和亚热带植物叶部的常见内生真菌,寄主范围非常广泛,但偶尔也能导致植物的病害[15]。像人体和动物肠道微生态系一样,植物叶围微生态系中微生物的种群结构和数量平衡,可能也会对植物健康产生深远的影响。
[1] 施雯, 张汉波.叶面微环境和微生物群落.微生物学通报, 2007, 34(4): 761-764.
[2] Petrini O.Fungal endophytes of tree leaves.In: Andrews J H, Hirano S S eds.Microbial Ecology of Leaves.New York: Springer Verlag, 1991, 179-197.
[3] Santamarıa J, Bayman P.Fungal epiphytes and endophytes of coffee leaves (Coffea arabica).Microbial Ecology, 2005,50: 1-8.
[4] Osono T, Mori A.Colonization of Japanese beech leaves by phyllosphere fungi.Mycoscience, 2003, 44: 437-441.
[5] Osono T, Mori A.Distribution of phyllosphere fungi within the canopy of giant dogwood.Mycoscience, 2004, 45:161-168.
[6] Osono T, Bhatta B K, Takeda H.Phyllosphere fungi on living and decomposing leaves of giant dogwood.2004,Mycoscience, 45: 35-41.
[7] Osono T.Endophytic and epiphytic phyllosphere fungi of red-osier dogwood (Cornus stolonifera) in British Columbia.Mycoscience, 2007, 48 : 47-52..
[8] 赵芹.茶微生物研究现状.茶叶, 1999, 25(1): 18-19.
[9] 卢东升.茶园微生物与茶园病害微生态控制.北京: 中国农业出版社, 2006.
[10] 谢丽华, 徐焰平, 王国红, 等.茶树品种、叶片生育期和茶叶化学成份对内生真菌的影响.菌物研究, 2006, 4(3):35-41.
[11] 武汉琴, 苏经迁, 谢明英, 等.茶树内生木霉种的鉴定及其在植物体内的定殖.菌物学报, 2009, 28(3):342-348.
[12] Yang C H, Crowley D E, Borneman J, et al.Microbial phylloaphere population are more complex than previously realized.Proc Natl Acad Sci USA, 2001, 98(7):3889-3894.
[13] Osono T.Endophytic and epiphytic phyllosphere fungi of Camellia japonica : seasonal and leaf age-dependent variations.Mycologia, 2008, 100(3): 387-391.
[14] 陈雪芬.中国常见茶树病害.见: 中国农业百科全书编辑部编著.中国农业百科全书-茶业卷.北京: 农业出版社, 1988.334.
[15] Baayan R P, Bonants P J M, Verkley G, et al.Nonpathogenic isolates of the citrus black spot fungus,Guignardia citricarpa, identified as a cosmopolitan endophyte of woody plants, G.mangiferae (Phyllosticta capitalensis).Phytopathology, 2002, 92(5): 464-477.
