生物转化在天然产物化学中的研究进展
2010-06-04王煜丹,程桂广,余旭亚等
生物转化是利用生物体系或其产生的酶制剂对外源性化合物进行结构修饰的生物化学过程。就其本质而言,生物转化是生物体系对外源性底物的酶催化反应[1~3]。生物转化反应具有高效、高选择性、反应清洁、产物单纯、易分离纯化、能耗低等优点,符合绿色化学的要求。著名化学家Wong ChiHuey教授指出,生物转化在天然产物化学中的应用具有巨大的潜力,设计与发展适于生物转化(酶促)反应的新的底物和利用遗传工程改变酶的催化性质等都将大大利于其在制药工业中的应用[4]。因此,生物转化方法已经受到研究者的广泛重视,并正迅速发展。
1 生物转化中的主要反应类型
生物转化的反应类型多种多样,常见的反应主要有羟基化、糖苷化、氧化还原、异构化、甲基化、酯化、水解、环氧化以及重排等。
1.1 羟基化反应
羟基化反应是生物转化中最常见也是最重要的一种反应,羟基化反应可以发生在多个位置,生成多种有意义的衍生物。自1952年微生物法合成糖皮质激素进入商品化生产以来,羟基化的生物转化技术成为甾体药物或其中间体合成路线中不可缺少的关键技术。目前肾上腺皮质激素及其衍生物的工业化生产技术就是利用微生物及其酶系统对甾体化合物11α-、11β-、15α-和16α-位进行羟基化。对于甾体化合物的生物转化进展,Fernandes等已进行了详细的综述[5]。
(-)-象牙洪达木酮宁,一种吲哚型生物碱,在临床上可用于改善大脑循环和新陈代谢,经过生物转化后可得到3种羟基化代谢产物,对这3种产物进行生物学活性检测,发现其在氰化物中毒时均表现出大脑保护作用[6]。
脱氢枞酸也可以通过生物转化的途径制得一些有活性的物质。1997年Tapia等[7]将脱氢枞酸在Fusariumspecies作用下,于26~28℃下培养7 d得到1β-羟基脱氢枞酸,将1β-羟基脱氢枞酸作用于Serratiasp.和Bacillussubtilis时,显示良好的活性。
1.2 糖苷化反应
糖苷化反应常见于植物悬浮培养体系介导的生物转化反应,而在微生物体系中应用较少。 糖苷化反应主要有两种:一种是羧酸和糖片段之间发生酯化反应,另一种是羟基和糖片段之间发生糖基化反应。糖苷化反应可使许多外源化合物的理化性质和生物活性发生较大的变化,例如,糖苷化反应可将不溶性化合物转变为水溶性化合物,这一点是微生物培养和化学合成很难做到的。
香豆素是一类很重要的植物次级代谢产物,但大部分香豆素缺乏天然糖苷,水溶性差。在人参根培养液中,7-羟基香豆素在糖基转移酶的作用下可转化成糖苷[8]。
丁酸具有体外抑制肿瘤生长和诱导肿瘤细胞分化的作用,但是其在哺乳动物体系中半衰期很短,人们通过悬浮培养的灰叶烟草(NicotianaplumbaginifoliaViv.)细胞糖苷化得到其糖苷,半衰期大大延长,有望开发为抗癌新药[9,10]。
1.3 醇酮的氧化还原反应
通过植物细胞培养可将醇转化为相应的酮,对于一些手性化合物的生产来说,对映选择性氧化反应是非常有用的。如斧柏烯在木槿属植物(Hibiscuscannabinus)培养细胞催化下,先脱水成烯,再氧化成酮,此反应与Collins氧化反应比较更符合绿色化学的要求[11]。
醛酮中的羰基也可在生物催化剂的作用下还原成相应的醇。在烟草属植物(Nicotianatabacum)和长春花属植物(Catharanthusroseus)细胞悬浮培养液作用下,樟脑醌中的羰基立体选择性地生成相应的α-酮醇[12]。
1.4 C=C双键的还原反应
C=C双键可加氢还原成饱和的C-C键。长变胞藻(AstasialongaPringsheim)的细胞培养物能够产生2种烯酮还原酶,可以还原芹酮的C=C双键。人们利用此反应来研究Carvene的立体化学及作用机制[13]。
1.5 硝基还原反应
北洋金花(DaturainnoxiaMill.)、长春花(Catharanthusroseus)及Myriophyllum属植物细胞培养物都能够将TNT(2,4,6-Trinitrotoluene)经过硝基还原反应生成ADNT(2,4,6-Aminodinitrotoluene)[14,15]。
1.6 环氧化反应
环氧化反应可以用于具有细胞毒性的倍半萜烯的结构修饰。莪术(Curcumazedoaria)细胞悬浮培养物中大根香叶酮(Germacrone)的环氧化反应就是成功的实例之一[16]。
还有文献报道,将Thujopsene加入红麻、烟草、长春花的植物细胞悬浮培养体系中,一部分底物发生环氧化反应,其转化产物为3-Epoxythujopsan-5-ol[17]。
1.7 酯化反应和水解反应
Dai等[18]应用长春花、桔梗(Platycodongrandiflorum)悬浮细胞培养体系对天麻素进行生物转化反应研究。经8 d培养生成天麻素水解后苷元——对羟基苯甲醇[19]。而与水解反应相对,研究发现乙酸酯化反应也比较容易出现在代谢产物中。在酯化反应中,密叶辛木素(Confertifolin)经过转化生成2种代谢产物,其中主产物是3β-羟基化密叶辛木素,而另一种代谢产物则是3β-乙酸酯化密叶辛木素。这2种产物很有可能是由一条代谢途径来完成的,这一推测可能为合成有用的酯类化合物提供捷径[20]。
1.8 成环反应
AspergillusalliaceusUI 315是功能强大的微生物,它可使芳烃和烷烃羟基化以及使芳烃化合物脱烷基化。最近发现它还具有环化作用,能模仿植物生物合成途径,使查耳酮分子成环生成黄酮。随后的研究证实是一种细胞色素P450酶在行使环化功能[21]。
2 生物转化在天然产物化学中的应用
2.1 有机合成及天然产物结构修饰
天然活性药物常常因为含量低、资源有限、结构复杂、不能采用化学方法合成等缺点而难以开发成新药。生物转化是由酶催化的化学反应,具有位置选择性和立体选择性好、催化效率高、反应条件温和、反应类型多、不污染环境等特点,因此往往应用生物转化方法合成有活性的天然产物或寻找有活性的天然产物衍生物,易于得到结构新颖的化合物,且避免了有机合成反应中对其它基团的保护与去保护,简化了合成步骤,提高了产物的收率,现已成为开发新药的有效途径。
利用结构类似物进行生物转化对于开发天然活性药物具有重要意义。1952年,Murray和Peterson首先成功用黑根霉(Rbizopusnigricans)使孕酮(黄体酮)实现C11羟基化,成为C11α-羟基孕酮(图1),成功地解决了皮质激素类药物合成过程中的难题,也使人们意识到用化学方法极难发生的C11羟基化,通过微生物转化能轻而易举地完成,从而开创了微生物转化甾体化合物的先例[22]。

图1 C11α-羟基孕酮的合成
10-羟基喜树碱(HCPT),作为抗癌药,其疗效好而且毒性低。近期发现多种微生物能定向将含量较高的喜树碱(CPT,图2)转化为10-羟基喜树碱[23]。
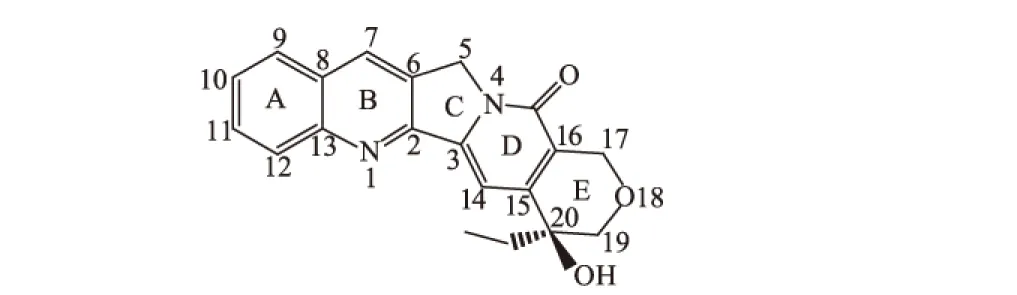
图2 喜树碱的结构式
2.2 手性药物合成和拆分
手性药物目前已成为国际上新药研究的热点。据统计,在研发的1200种新药中,有820种有手性,占世界新药开发的68%以上[24]。当手性药物进入生命体时,对映异构体因为光学活性不同,而具有不同的生物学活性。如镇静药沙利度胺(又名反应停,Thalidomide,图3),其(R)-对映体具有缓解妊娠的作用,(S)-对映体是一种强力致畸剂[25]。

图3 沙利度胺的结构式
生物体系中的酶具有化学选择性、区域选择性和对映体选择性,因此生物转化在不对称合成手性药物以及对映异构体的拆分方面显示出巨大的应用潜力[26]。
2.2.1 酶法拆分手性药物
酶法拆分是一种比较成熟的生物合成单一对映体的方法。酶的活性中心是一个不对称环境,有利于识别消旋体,在一定条件下酶只能催化消旋体中的一个对映体发生反应而生成不同的化合物,从而使两个对映体分开[27]。
荧光假单胞菌作用于外消旋体内酰胺后,由于该菌只选择性地水解右旋体,从而使其与左旋内酰胺分开,后者是抗艾滋病药物Carbovir的中间体[28]。
2-羟基-4-苯基丁酸乙酯(R-HPBE)是合成多种ACE(血管紧张素Ⅱ转化酶)抑制剂的重要中间体,例如合成抗高血压药西拉普利(Cilazapril)。用脂肪酶催化水解外消旋的HPBE,可以得到光学纯的R-HPBE和S-HPBE(图4)[29]。

图4 酶法拆分HPBE
2.2.2 酶催化合成手性药物
最近发展的主要是微生物或酶直接转化,或利用氧化还原酶、合成酶、裂解酶、水解酶、羟化酶、环氧化酶等直接从前体化合物不对称合成各种复杂的手性化合物。该法不需制备前体衍生物,可将前体 100%地转化为手性目标产物,因此具有更大的工业应用价值[27]。
普萘洛尔(心得安,图5)是非选择性的β-受体阻滞剂,对β1-受体和β2-受体均有阻滞作用,不仅能降低血压,也能降低心肌收缩力和心排出量。

图5 普萘洛尔的结构式
研究发现,普萘洛尔活性主要取决于S构型(其活性是R构型的130倍),将普萘洛尔进行拆分得(S)-(-)-普萘洛尔,可降低剂量和副反应。合成普萘洛尔的方法报道较多,利用酶催化来合成其手性前体是一种非常有效的方法[30]。Bevina等利用脂肪酶PS对外消旋的萘氧氯丙醇酯进行水解得到(S)-(-)-1-氯-3-(1-萘氧基)-2-丙醇,最后与异丙胺缩合得(S)-(-)-普萘洛尔[31]。
卡托普利(图6)是Bristol-Myers Squibb公司开发的血管紧张素转化酶抑制剂类抗高血压药物,临床应用广泛。铜绿假单胞菌可立体选择性氧化异丁酸得到其重要中间体(R)-2-甲基-3-羟基丙酸[32]。

图6 卡托普利的结构式
2.3 作为药物代谢机制的研究模型
近年来,有人发现药物的体内代谢产物往往与其微生物转化产物具有一定的相似性,遂提出将微生物转化作为药物体内代谢的模型,从而将生物转化技术引入到一个新的应用领域。文献报道华蟾毒精和蟾毒灵在大鼠肝脏的主要代谢途径为3-OH脱氢及16-位脱乙酰基反应,与微生物转化具有一定的相似性,例证了微生物转化可用于制备并辅助鉴定药物的体内代谢产物。
Hufford研究组对蒿乙醚进行微生物转化,得到的转化产物中9β-羟基蒿乙醚、9α-羟基蒿乙醚、2α-羟基蒿乙醚、14-羟基蒿乙醚也是蒿乙醚在小鼠肝细胞中的代谢产物。药物的体内代谢产物在生物制品中大多含量很低,且杂质干扰严重,产物的分离纯化与结构鉴定均较困难;而微生物转化产物的分离过程则相对简单,且可实现较大量的产物制备,因此可用于辅助鉴定药物代谢的微量乃至痕量产物,并可大量制备以作深入的研究[33]。
2.4 阐明抑真菌药物的耐药机制
最近发现生物转化是微生物耐受抑真菌药物的重要脱毒机制。Aleu等发现Botrytiscinerea可使具有抑真菌活性的天然化合物Ginsenol和Isoprobotryan-9α-ol的结构发生改变,生成羟基化产物,从而失去抗真菌作用。该研究成果为抑真菌药物的研制及耐药机制的阐明提供了新的思路。Pedras等还发现植物对病原性真菌的耐受亦存在着类似于生物转化的机制。植物可使真菌产生的有害物质通过糖苷化、羟基化等反应,失去毒害作用[34]。
3 展望
生物转化在天然产物化学中的应用已取得不凡的成就,而且其工业发展潜力非常巨大。但是目前生物转化研究的主流仍然停留在整体细胞催化水平,对转化规律的总结、生物催化机制的阐明以及从分子水平对催化酶展开的研究则相对薄弱得多。可喜的是,随着现代分析技术、现代生物技术(尤其是分子生物学与结构生物学)的飞速发展,这些新兴技术已经开始渗透到传统的生物转化研究中来[35]。可以预见,催化酶的研究将是今后生物转化的研究热点与发展趋势;生物转化也将与化学方法更紧密地结合。随着技术的进步,生物转化将在天然药物研究与开发中发挥更为重要的作用。
参考文献:
[1] 褚志义.生物合成药物学[M].北京:化学工业出版社,2000:259-262.
[2] Loughlin W A. Biotransformations in organic synthesis[J]. Bioresource Technology, 2000,74(1):49-62.
[3] Rozzell J D. Commercial scale biocatalysis: Myths and realities[J]. Bioorg Med Chem, 1999, 7(10):2253-2261.
[4] 张礼和.化学学科进展[M].北京:化学工业出版社,2005: 149-150.
[5] 冯冰,马百平.天然产物的生物转化研究进展[J].中草药,2005,36(6): 941-945.
[6] Adachi T,Saito M,Sasaki J, et al. Microbial hydroxylation of (-)-eburnamonine byMucorcircinelloidesandStreptomycesviolens[J]. Chem Pham Bull, 1993,41(3):611-613.
[7] Tapia A A, Vallejo M D, Gouiric S C, et al. Hydroxylation of dehydroabietic acid byFusariumspecies[J]. Phytochemistry, 1997, 46(1): 131-133.
[8] Li W, Koike K,Asada Y, et al. Biotransformation of umbelliferone byPanaxginsengroot cultures[J]. Tetrabedron Letters, 2002,43(32): 5633-5635.
[9] 于荣敏.天然药物活性成分的生物合成与生物转化[J].中草药, 2006, 37(9): 1281-1288.
[10] Kamel S,Brazier M,Desmet G,et al.Glucosylation of butyric acid by cell suspension culture ofNicotianaplumbaginifolia[J].Phytochemistry,1992,31(5):1581-1583.
[11] Fournier D,Hawari J,Streger S H,et al.Biotransformation ofN-nitrosodimethylamine byPseudomonasmendocinaKR1[J].Appl Environ Microbiol,2006,72(10):6693-6698.
[12] Chai W, Hamada H,Suhara J,et al. Biotransformation of (+)-and(-)-camphorquinones by plant cultured cells[J].Phytochemistry,2001,57(5):669-673.
[13] Shimoda K,Hirata T.Biotransformation of enones with biocatalysts——two enone reductases fromAstasialonga[J].Journal of Molecular Catalysis B:Enzymatic,2000,8(4-6):255-264.
[14] Lucero M E,Mueller W,Hubsten berger J,et al.Tolerance to nitrogenous explosives and metabolism of TNT by cell suspensions ofDaturainnoxia[J].In Vitro Cell Dev Biol(Plant),1999,35(6):480-486.
[15] Hughes J B,Shanks J,Vanderford M,et al.Transformation of TNT by aquatic plants and plant tissue cultures[J].Environ Sci Technol,1997,31(1):266-271.
[16] Sakui N,Kuroyanagi M,Ishitobi Y,et al.Biotransformation of sesquiterpenes by cultured cells ofCurcumazedoaria[J].Phytochemistry,1992,31(1):143-147.
[17] Chai W,Hayashida Y,Sakamaki H,et al.The biocatalytic oxidation of thujopsene by plant cultured-cells[J]. Journal of Molecular Catalysis B:Enzymatic,2004,27(2-3):55-60.
[18] Dai J,Gong Z,Zhu D,et al.Biotransformation of gastrodin by cell suspension cultures ofCatharanthusroseus[J]. Zhiwu Xuebao, 2002, 44(3): 377-378.
[19] 严春艳,于荣敏.植物生物转化技术与中药活性化合物研究[J].食品与药品,2005,7(10A):4-8.
[20] 王旭,徐威,游松.微生物转化在药学中的应用[J].沈阳药科大学学报,2006, 23(7): 477-482.
[21] 谢春锋,娄红祥.天然产物的生物转化[J].天然产物研究与开发,2005, 17(5): 658-664.
[22] 张春燕,白宝星,王明蓉.甾体药物生物转化体系的研究进展[J].国外医药:抗生素分册,2007,28(5):210-214.
[23] 余伯阳.中药与天然药物生物技术研究进展与展望[J].中国药科大学学报, 2002, 33(5): 359-363.
[24] 卢定强,李衍亮,凌岫泉,等.手性药物拆分技术的研究进展[J].时珍国医国药,2009,20(7):1731-1734.
[25] 胡文浩,周静.手性,手性药物及手性合成[J].化学教学,2009,(5):1-3.
[26] Santaniello E,Ferraboschi P,Grisenti P,et al.The biocatalytic approach to the preparation of enantiomerically pure chiral building blocks[J].Chem Rev,1992,92(5):1071-1140.
[27] 宫丽,卞俊.手性药物的制备[J].中国药业,2008,17(23):64-66.
[28] 吴再坤,钟宏,王微宏,等.手性药物的活性分析与生物转化[J].化工技术与开发, 2006, 35(9): 24-27.
[29] 张宪锋,郑裕国.酶法拆分手性化合物HPBE[J].生物加工过程,2003,1(2):34-38.
[30] Kapoor M,Anand N,Koul S,et al.Kinetic resolution of 1-chloro-3-(1-naphthyloxy)-2-propanol,an intermediate in the synthesis ofβ-adrenergic receptor blockers[J].Bioorganic Chem,2003,31(3):259-269.
[31] 刘正威.酶法拆分技术研究[J].管理观察,2009,(5):58.
[32] 蒋育澄,李淑妮,翟全国.手性药物的酶催化不对称定向合成[J].化学教育,2008,29(12):9-12.
[33] 汤亚杰,李艳,徐小玲,等.天然活性先导化合物生物转化[J].中国生物工程杂志, 2007, 27(9): 110-115.
[34] 于德泉,吴毓林.天然产物化学进展[M].北京:化学工业出版社, 2005: 368-392.
[35] 叶敏,宁黎丽,占纪勋,等.雷公藤内酯及蟾毒配基类化合物的生物转化研究进展[J].北京大学学报(医学版), 2004, 36(1): 82-89.
