产退浆酶优良菌株的选育及酶性质分析
2010-05-31赵伟陈晨金德才彭娟花刘倩周洪波
赵伟,陈晨,金德才,彭娟花,刘倩,周洪波
(中南大学 资源加工与生物工程学院,湖南 长沙,410083)
在纺织工业中,织物的经纱在织造前大都先经过淀粉浆液的浆洗。浆料在染整过程中会影响织物的润湿性,并阻碍化学品对纤维接触,消耗过多的染化料,因此,织物一般都要进行退浆。工业上传统的碱退浆、酸退浆及热水退浆法,退浆效率低,易损伤织物,且工序复杂,排出大量废液对环境产生很大污染。在社会对环境问题越来越重视的今天,生物酶制剂因能够有效、经济、环保地进行退浆而逐渐被应用于生产[1-2]。退浆酶是一种生物化学催化剂,常用的有胰淀粉酶和细菌淀粉酶。这2种酶的主要组成都是α-淀粉酶,它能促使淀粉长链分子的α-1,4葡萄糖苷键断裂,生成糊精和麦芽糖,从而极易从织物上洗除。根据热稳定性不同,淀粉酶可以分为普通淀粉酶和耐高温淀粉酶。在纺织应用过程中,耐高温的α-淀粉酶更适合工艺控制、连续化退浆生产的要求。产耐高温 α-淀粉酶的菌种有许多,研究和应用较多的是芽孢杆菌属(Bacillus)[3]、地衣芽孢杆菌(Bacillus licheninformis)、枯草芽孢杆菌(Bacillus subtilis)、嗜热芽孢杆菌(Bacillus stearothermophilus)等。国外生产高温淀粉酶所用菌株多数是芽孢杆菌属,但是,所用菌株产酶性能并不相同,应用于造纸、酿酒、纺织等不同行业的生产。另外,也有关于嗜热细菌和古菌的研究[4],不过它们最适生长温度较高,多在80 ℃以上,生长条件较苛刻,并不适合工业化生产的要求。因此,常温菌株芽孢杆菌属(Bacillus)仍然是研究的重点。本文作者从枯草堆、农田积肥、下水道等处土样中分离得到1株能向胞外分泌耐高温α-淀粉酶的菌株,经鉴定为枯草芽胞杆菌,命名为Bacillus subtilis C1,并对该菌筛选鉴定过程及所产耐高温α-淀粉酶酶学性质进行研究。
1 材料和方法
1.1 样品来源
从枯草堆、农田积肥、下水道等处,按“五点取样法”采取土样10份,从中分离菌株。
1.2 培养基
基础培养基(100 mL):蛋白胨 1 g,可溶性淀粉1 g,酵母粉 0.5 g,NaCl 1 g,pH=7。
筛选培养基[5]:在基础培养基的基础上,加入2%的琼脂粉,0.01%的曲利本蓝。
1.3 菌种初筛
[6]中的方法,将少量样品放入烘箱,在80 ℃加热处理 20 min后,称取样品 5 g加入装有45 mL无菌水的小三角瓶中,静置10 min,取上清液0.1 mL梯度(10-5,10-4,10-3)稀释后涂布于分离筛选平板上,在45 ℃培养箱中培养2~3 d,测量D/d(水解圈直径/菌落直径)[7],挑选比值较大的进行划线纯化。将分离得到的菌株进一步划线分离纯化。
1.4 菌种复筛
将初筛得到的几株菌纯化后,在45 ℃进行液体发酵,取发酵液离心后收集上清液进行酶活测定,选取酶活高的菌株进行划线传代培养,再测定酶活,最终得到1株产酶稳定且有较高酶活的耐高温淀粉酶产生菌株。纯化的菌株接种于牛肉膏蛋白胨斜面培养基上,于4 ℃保藏。
1.5 酶制备
1.5.1 粗酶液制备
用三角瓶(250 mL)装培养基 100 mL,接种后于45 ℃恒温振荡培养48 h 后,取发酵液在4 ℃以转速10 000 r/min离心20 min,上清液即为粗酶液。
1.5.2 固体粗酶制备
采用冷乙醇沉淀法制备固体粗酶。在冰盐浴中,向粗酶液中缓慢加入等体积的预冷至4 ℃的无水乙醇,并不断搅拌,然后,在4 ℃静置4 h。在4 ℃时,将悬浊液10 000 r/min离心20 min。弃上清,沉淀,于-20 ℃保藏过夜。于次日冷冻干燥6 h,即得固体粗酶。
1.6 酶活测定方法
采用Yoo改良法测定酶活[8-9]。在20 mL试管中加入5 mL 0.5%可溶性淀粉溶液(用pH=6磷酸盐缓冲液新鲜配制),在70 ℃预热10 min。然后,加入稀释一定倍数的0.5 mL酶液,在70 ℃准确反应5 min后,加入5 mL 0.1 mol/L HCl终止反应。取0.5 mL反应液加入盛有5 mL 0.4 mmol/L I2-KI溶液的试管中显色。在波长为620 nm时测定吸光度。酶活力单位定义为:在pH=6、温度70 ℃、5 min水解1 mg可溶性淀粉所需的酶量为1 U。
1.7 菌株鉴定
依据文献[10]和[11]进行生理生化鉴定。
离心收集菌体,使用UNIQ-10柱式基因组抽提试剂盒(Sangon)提取基因组DNA,以其作为扩增模板在PCR仪上进行16S rDNA扩增,所用引物以及PCR程序见文献[12-14]。PCR产物采用 E.Z.N.ATM Gel Extraction Kit(OMEGA)纯化回收后测序由北京三博远志生物公司完成。
2 结果与分析
2.1 菌株的筛选与鉴定
将土样梯度稀释后,涂布在筛选培养基上,在45 ℃培养48 h后,共长出23个菌落,菌体形状及菌落外观如图1所示。分别测量各个菌落的水解圈直径D和菌落直径d,挑出D/d较大的10个菌落,进行复筛。在基础培养基中,于45 ℃培养72 h,测定酶活。其中:C1菌株发酵液酶活最高为185 U/mL。将其进行纯化培养,经鉴定后,接入斜面培养基,于4 ℃保藏。
菌株 C1平板培养菌落白色或微黄色,刚形成的菌落边缘整齐,表面光滑、黏稠,能拉丝。但超过一定的培养时间时,表面变得不光滑,有褶皱,边缘不整齐,中央突起,或呈火山口状。液体静置培养时表面会形成白色菌膜。镜检菌株为直杆状,2个或多个相连,单个细菌较少见。菌体两端为圆形,端生鞭毛,有运动性。中生芽孢,呈椭圆或柱状,不明显膨大。菌株C1的生理生化鉴定结果如表1所示。

表1 菌株C1的生理生化特性测试结果Table 1 Physiology and biochemical characteristics of strain C1
将测得的菌株C1的16S rDNA核苷酸序列输入到GenBank数据库中。在GenBank数据库中进行BLAST比对[15],结果显示菌株C1与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和枯草芽孢杆菌(Bacillus subtilis)的同源性都达到99%。利用系统发育树软件MEGA 4.0构建菌株C1的系统发育树[16],见图2。
根据菌株C1生理生化及分子生物学的鉴定结果,初步断定菌株 C1为 1株枯草芽孢杆菌(Bacillus subtilis)。

图2 依据16S rDNA基因序列构建的菌株C1和相关菌种的系统发育树Fig.2 Phylogenetic tree of C1 and related bacterial species,constructed according to 16S rDNA gene sequence with MEGA4.0 software
2.2 生长曲线与产酶曲线
从冷冻斜面培养基上取样接种于基础培养基,在45 ℃、转速为180 r/min条件下培养24 h,取1 mL培养液接种于基础培养基中培养80 h。每4 h取样1次,测定细菌浓度(用c表示)及培养液酶活(培养12 h后测定酶活),细菌生长曲线及产酶曲线如图3所示。
由图3可以看出:菌株C1的生长曲线和产酶曲线并不一致,产酶曲线略迟滞于生长曲线;0~4 h为细菌的生长延迟期,4~24 h为对数生长期,24~40 h细菌浓度保持稳定,为稳定期。稳定期后,由于细菌繁殖越来越慢,菌体自溶,死亡数越来越多,细菌进入了衰亡期。从产酶曲线可以看出:在细菌生长12 h后,检测到了酶活,在细菌生长进入稳定期后,酶活开始大幅度增加;在细菌生长进入衰亡期时,酶活并没有立刻下降,而是继续增加,于68 h酶活达到峰值,之后由于细菌的生长代谢衰退,加上细菌分泌的蛋白酶酶解,淀粉酶酶活开始下降[17]。

图3 菌株C1培养过程中的生物量及其相应淀粉酶活变化Fig.3 Variations in biomass of Strain C1 and amylase activity during incubation
2.3 C1菌株所产粗酶性质
菌株C1在基础培养基中培养48 h后,取发酵液制得一定量固体粗酶,并对其化学性质(温度和pH值对酶活的影响、酶的热稳定性)进行研究[18-19]。
2.3.1 温度对酶活的影响
将粗酶稀释一定浓度,在温度40~70 ℃,每10 ℃为一梯度,分别测得粗酶酶活(a)。结果如图4所示。
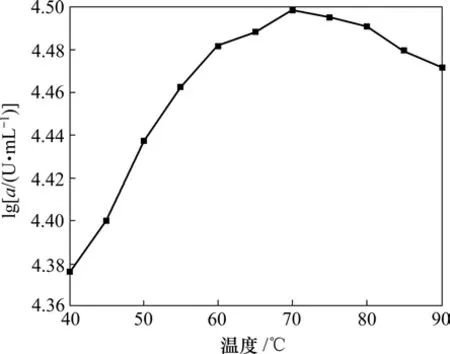
图4 温度对C1产酶酶活的影响Fig.4 Effect of temperature on activity of amylase
从图4可以看出:在较低温度时,酶活很低,如在40 ℃时,酶活只有最高酶活的75%;随着温度的升高,酶促反应速度增加,酶活增大;在70 ℃时,酶活最高;而随着温度继续升高,高温减弱了酶的一些氢键、离子键、静电相互作用等,酶的三维构象受到破坏,所以,酶活开始下降,至90 ℃时,酶活下降为峰值的94%。可见:70 ℃为酶的最适温度,而酶在较高温度(60~90 ℃)时,酶活变化不大,比较适合纺织工业高温退浆的需要。
2.3.2 pH值对酶活的影响
配制不同pH值(4~10)的缓冲液,将粗酶稀释至一定倍数,在最适温度下,测定不同pH值条件下C1产酶酶活(a),结果如图5所示。
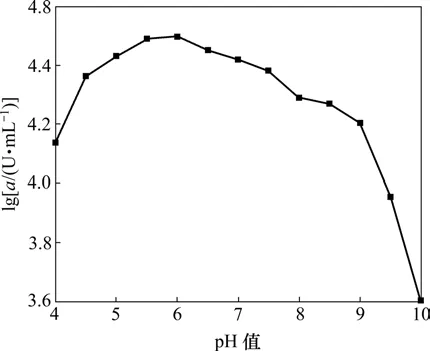
图5 pH值对C1产酶酶活的影响Fig.5 Effect of pH on activity of amylase
α-淀粉酶作为蛋白质,也具有两性电解质的性质,在溶液中可以发生解离作用。酶活性中心功能基团的解离状态随溶液的 pH值改变而改变,因此,溶液的H+浓度对酶催化反应的速度有明显的影响。酶分子的活性部位上的酸性或碱性氨基酸的侧链基团,随着pH值的变化而发生解离,酶的三维结构也随之改变,从而影响到酶的活化以及酶与底物的亲和力,宏观表现为酶活的改变。从图5可以看出:当pH值为6时,酶活最高,是酶的最适pH值;在偏酸环境中(pH=5~7),酶活变化不大;而在碱性环境中,酶活下降较快。因此,在退浆过程中,要保持反应液的偏酸环境。
2.3.3 热稳定性
将粗酶分别在70,80和90 ℃保温,分别取10,20,30,40,50和60 min时的酶稀释一定浓度,进行酶活测定。以未经过保温的酶的活性为 100%,计算在不同条件下的酶活(见图6),确定酶的热稳定性。酶退浆工艺是先把棉布浸泡在65~75 ℃的热水中,使淀粉浆料溶胀以利于酶对淀粉的作用,再浸泡到酶液中,酶液温度为50~70 ℃。然后,堆置2~4 h,或者将轧过酶液的织物放到水浴振荡器中或打卷后放到水浴振荡器中,汽蒸(100 ℃左右)一定时间,再充分水洗。工艺要求酶要有较强的热稳定性。
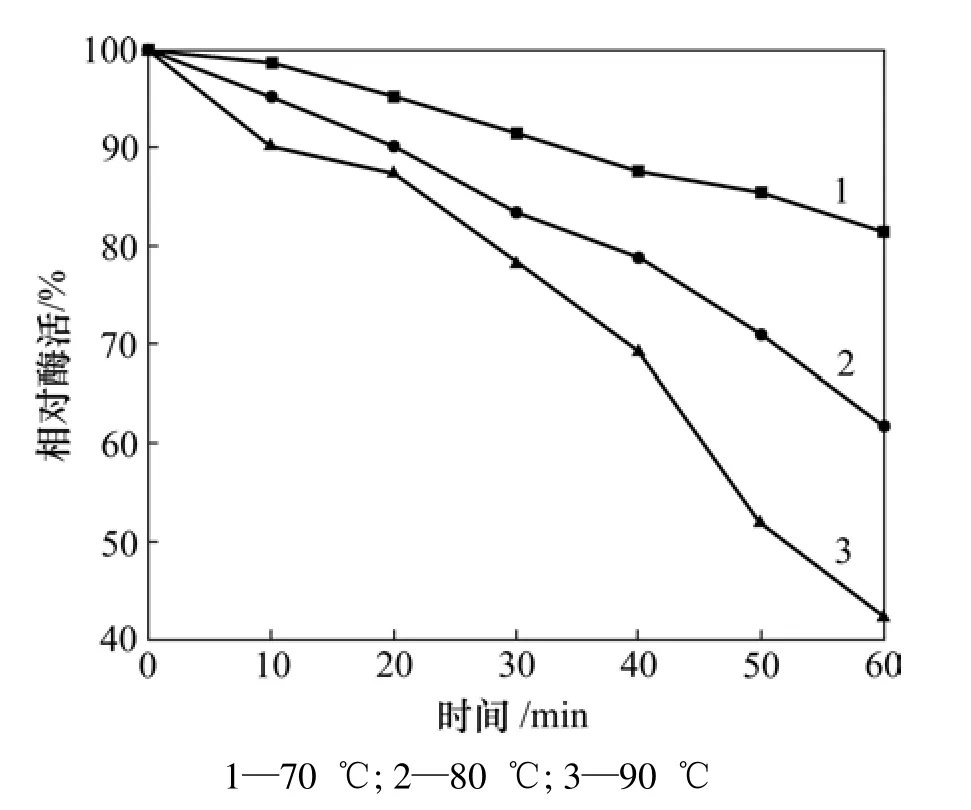
图6 酶的热稳定性Fig.6 Thermal stability of amylase
从图6可知:该酶有较强的热稳定性,能满足工艺的需要,在70 ℃保温1 h,酶活下降约19%;在80℃下保温1 h,酶活下降约38%;在90 ℃下保温1 h后,酶活下降较大,仅为原来的42%。
3 结论
(1) 从枯草堆、农田积肥、下水道等处土样中筛选得到1株可以产耐高温α-淀粉酶的细菌。通过Yoo改良法,测得酶活最高为185.6 U/mL。
(2) 通过16S rDNA鉴定,菌株C1与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和枯草芽孢杆菌(Bacillus subtilis) 的同源性都达到了99%。又由菌株C1的生理生化特性,初步鉴定为枯草芽孢杆菌Bacillus subtilis C1。
(3) 菌株C1在基础培养基中(pH=7,温度45 ℃),0~4 h为细菌的生长延迟期,4~24 h为对数生长期,在24~40 h时细菌浓度保持稳定,为稳定期,之后进入衰亡期。细菌生长12 h后,检测到了酶活,在细菌生长进入稳定期后,酶活开始大幅度增加,在68 h时酶活达到峰值,之后由于细菌的生长代谢衰退,加上细菌分泌的蛋白酶酶解,α-淀粉酶酶活开始下降。
(4) C1菌株所产酶最适温度为70 ℃,最适pH值为6。C1所产酶耐热性能良好,在高温条件下仍可保持较高的酶活,可以基本满足退浆工艺中的高温要求。若要获得纯度较高的成品固体酶,还可通过超滤、萃取等下游工艺来实现。
参考文献:
[1] 蒲宗耀, 陈松, 卢涛, 等. 耐碱耐温淀粉酶性能及退浆工艺试验研究[J]. 纺织科技进展, 2006(1): 24-26.PU Zong-yao, CHEN Song, LU Tao, et al. Study on thermo-stable amylase desizing for cotton fabric[J]. Progress in Textile Science & Technology, 2006(1): 24-26.
[2] Du G C, Liu L M, Song Z X, et al. Production of polyvinyl alcohol-degrading enzyme with Janthinobacterium sp. and its application in cotton fabric desizing[J]. Biotechnol Journal, 2007,2(6): 752-758.
[3] Sajedi R H, Manesh H N, Khajeh K, et al. A Ca-independent α-amylase that is active and stable at low pH from the Bacillus sp. KR-8104[J]. Enzyme and Microbial Technology, 2005,36(5/6): 666-671.
[4] Bertoldo C, Antranikian G. Starch-hydrolyzing enzymes from thermophilic archaea and bacteria[J]. Curr Opin Chem Biol,2002, 6(2): 151-160.
[5] 马向东, 马立新, 薛征峰, 等. 一种鉴定α-淀粉酶活性及其产生菌的新方法[J]. 华中农业大学学报, 2000, 19(5): 456-460.MA Xiang-dong, MA Li-xin, XUE Zheng-feng, et al. A new method to identify α-amylase activity and its producing bacteria[J]. Journal of Huazhong Agricultural University, 2000,19(5): 456-460.
[6] 李江华, 房峻. 真菌 α-淀粉酶产生菌的筛选及其固态发酵条件的初步研究[J]. 食品科学, 2007, 28(11): 373-378.LI Jiang-hua, FANG Jun. Preliminary study on screening fungal α-amylase-producing strain and its solid-state fermentation conditions[J]. Food Science, 2007, 28(11): 373-378.
[7] 陈龙然, 袁康培, 冯明光, 等. 一株产环糊精葡萄糖基转移酶的地衣芽孢杆菌的选育、产酶条件及酶学特性[J]. 微生物学报, 2005, 45(1): 97-101.CHEN Long-ran, YUAN Kang-pei, FENG Ming-guang, et al.Breeding, optimized fermentation and enzymatic properties of a Bacillus licheniformis mutant producing cyclomaltodextrin glucanotransferase[J]. Acta Microbiologica Sinica, 2005, 45(1):97-101.
[8] Yoo Y J, Hong J, Hatch R T. Comparison of α-amylase activities from different assay methods[J]. Biotechnology and Bioengineering, 1987, 30(1): 147-151.
[9] 史永昶, 姜涌明. 五种 α-淀粉酶测活方法的比较研究[J]. 微生物学通报, 1996, 23(6): 371-373.SHI Yong-chang, JIANG Yong-ming. Comparision of five methods for the assaying of α-amylase activity[J]. Microbiology,1996, 23(6): 371-373.
[10] 布坎南R E, 吉本斯N E. 伯杰细菌鉴定手册[M]. 8版. 洪俊华, 译. 北京: 科学出版社, 1984: 732-735.Buchanan R E, Gibbons N E. Bergey’s manual of determinative bacteriology[M]. 8th ed. HONG Jun-hua, trans. Beijing: Science Press, 1984: 732-735.
[11] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 62-65.DONG Xiu-zhu, CAI Miao-ying. Familiar bacilli system identify enchiridion[M]. Beijing: Science Press, 2001: 62-65.
[12] Weisburg W G, Barns S M, Pelletier D A, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. Journal of Bacteriology, 1991, 173(2): 697-703.
[13] YANG Yu, DIAO Meng-xue, SHI Wu-yang, et al. Isolation and characterization of organic-sulfur degradation bacterial strain[J].Journal of Central South University of Technology, 2007, 14(3):324-329.
[14] 丁建南, 朱若林, 康健, 等. 喜温嗜酸硫杆菌YN12菌株的鉴定及其镉抗性能[J]. 中国有色金属学报, 2008, 18(2): 342-348.DING Jian-nan, ZHU Ruo-lin, KANG Jian, et al. Identification and cadmium (Ⅱ) resistance of strain YN12, Acidithiobacillus caldus[J]. The Chinese Journal of Nonferrous Metals, 2008,18(2): 342-348.
[15] Altschul S F, Gertz E M, Agarwala R, et al. PSI-BLAST pseudocounts and the minimum description length principle[J].Nucleic Acids Research, 2009, 37(3): 815-824.
[16] Kumar S, Tamura K, Nei M. MEGA3: Integrated software for molecular evolutionary genetics analysis and sequence alignment[J]. Briefings in Bioinformatics, 2004, 5(2): 150-163.
[17] 唐欣昀, 温崇庆. 枯草杆菌(Bacillus subtilis)蛋白酶突变株蛋白酶和 α-淀粉酶合成的关系[J]. 工业微生物, 2003, 33(2):19-22.TANG Xin-yun, WEN Chong-qing. Relations between protease and α-amylase synthesis in protease mutants of Bacillus subtilis[J]. Industrial Microbiology, 2003, 33(2): 19-22.
[18] Asgher M, Asad M J, Rahman S U, et al. A thermostable alpha-amylase from a moderately thermophilic Bacillus subtilis strain for starch processing[J]. Journal of Food Engineering,2007, 79(3): 950-955.
[19] de Carvalho R V, Correa T L R, da Silva J C M, et al. Properties of an amylase from thermophilic Bacillus sp[J]. Brazilian Journal of Microbiology, 2008, 39(1): 102-107.
