转基因饲料的PCR检测策略
2010-04-28河南农业大学牧医工程学院管庆丰
河南农业大学牧医工程学院 管庆丰
农业部饲料生物技术重点实验室
中国农业科学院饲料研究所基因工程研究室 王秀敏 杨雅麟 滕 达 尹清强 王建华*
我国是世界第二饲料生产大国,饲料产业已成为国民经济发展支柱产业之一。由于转基因作物大量进入饲料领域,给饲料行业质量检测带来新课题,为了保证饲料安全与有效监管,建立科学可行的饲料转基因成分检测方法非常重要。由于饲料由多种饲料原料按照一定比例混合而成,饲料转基因检测在继承既有转基因植物食品检测方法的基础上还需要兼顾饲料特点,过去这方面工作相对薄弱,本文针对饲料转基因检测策略及特点进行概述。
1 转基因饲料
1.1 转基因饲料中所含转基因植物 表1为中国近年所批准种植或进口的用于饲料的玉米、大豆及油菜清单。
1.2 转基因饲料PCR检测的影响因素
1.2.1 饲料成分复杂给转基因成分检测技术带来挑战 (1)饲料原料种类多,其中植物源转基因成分主要有能量饲料(如玉米、油脂等)和蛋白质饲料(大豆饼粕、棉籽饼粕、油菜饼粕等)。由于不同类型和不同用途的饲料组成相差较大,造成转基因成分检测的复杂性,如需要检测的基因多、盲测的几率大等问题。一些送检样品成分标识不全或未如实标识,也增加了检测难度和周期。(2)复杂饲料产品中转基因成分的检测不同于单一作物及其加工品,含多种转基因作物成分,每种转基因成分相对含量降低,这增加了检测的难度和复杂度。(3)由于饲料组成成分复杂,提取的DNA是多种作物DNA的混合物,这为后续转基因成分PCR检测造成一定困难。如表1所示,在饲料中,一种外源基因可能存在于不同原料中,如Bt176和MON810都含有Cry1Ab基因,Bt11和T25都含有修饰的PAT基因等;或者是一种饲料原料含有不同外源基因,如59122玉米同时含有耐除草剂基因 PAT及抗虫基因 Cry34ab1和 Cry35Ab1,TC1507同时含有耐除草剂基因PAT和抗虫基因Cry1Fa2等。当这些具有相同外源基因的不同原料及具有不同外源基因的相同原料混合到一起时,使定性定量检测变得更复杂。
1.2.2 饲料加工对转基因成分及其检测的影响饲料的基本加工工艺包括先粉碎后配料加工工艺和先配料后粉碎加工工艺,这两种工艺均包括以下加工环节:原料接收、粉碎、配料、混合、制粒或膨化、成品包装:(1)用于饲料原料的饼粕中DNA经过浸提、压榨等工艺后,大部分已经被降解,玉米蛋白粉在加工过程中DNA也大部分降解(Angela和Mae,2001)。膨化及制粒使饲料发生一系列物理、化学变化,蛋白质的变性和剪切、核酸断裂等,增加转基因成分检测的难度和灵敏度,从而影响检测。饲料原料经高温高压等加工工艺后,大片段DNA会降解为小片段,加热时间越长,温度越高,降解越明显(Vijayakumar等,2009)。 DNA的降解可能造成假阳性的结果。(2)饲料混合对饲料原料的转基因成分没有降解作用,但增加转基因成分检测背景的复杂性,饲料混合均匀度不同,饲料中转基因成分添加量不均衡,会影响检测结果。(3)粉碎对蛋白质、DNA等成分溶出有影响。

表1 中国近年批准种植或进口的用于饲料的玉米及大豆
2 转基因饲料PCR检测策略
2.1 转基因检测的不同层次 转基因检测按特异性有4种层次:通用元件检测、基因特异性检测、构建特异性检测及品系特异性检测,特异性依次升高。(1)通用元件特异性:针对转基因常用的启动子和终止子等构件进行检测。常用的通用元件为花椰菜花叶病毒CaMV 35S启动子,NOS终止子,CaMV 35S终止子等 (Barbau-Piednoir等,2010)。(2)基因特异性:针对插入的性状基因进行检测。转基因作物常见的性状有抗虫类,多为苏云金芽孢杆菌内毒素家族,有Cry1Ab(Lutz等,2006),Cry1Ac、Cry3Bb1 及 Cry1Fa 等; 抗除草剂类, 常见的有 cp4 epsps (Alexander等,2006)和PAT(张舒亚等,2007)基因等。 (3)构建特异性:针对载体的构件特异性进行检测。(4)品系特异性:针对插入序列与内源基因的边界序列进行检测。每种转基因作物的品系的边界序列是唯一的,在边界序列设计引物可以特异地对饲料原料进行品系特异性检测。图1为4种检测层次。Rudi等(2003)针对MON 810等7种转基因玉米成分设计引物,采用了基因特异性、构件特异性及品系特异性PCR检测方法,有效地检测出了饲料及食品中的转基因玉米成分。
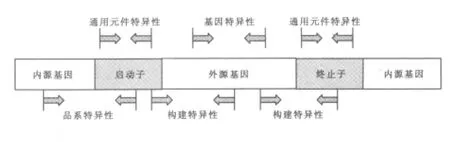
图1 4种转基因检测水平图示
2.2 PCR检测策略及应用 常规PCR、巢氏PCR、降落式PCR、复合PCR及实时定量PCR等PCR技术及不同检测水平组成了转基因饲料检测策略。图2为转基因饲料PCR检测常见策略。
2.2.1 常规PCR法 常规PCR常用于定性检测饲料原料是否含有转基因成分。鉴于加工工艺对DNA片段的降解,引物设计扩增片段不宜过大,避免由于大片段的降解而出现假阳性的结果。Tengel等(2001)对饲料中的转基因大豆和玉米及原料进行检测发现,玉米和大豆的检测灵敏度为30~200 bp。
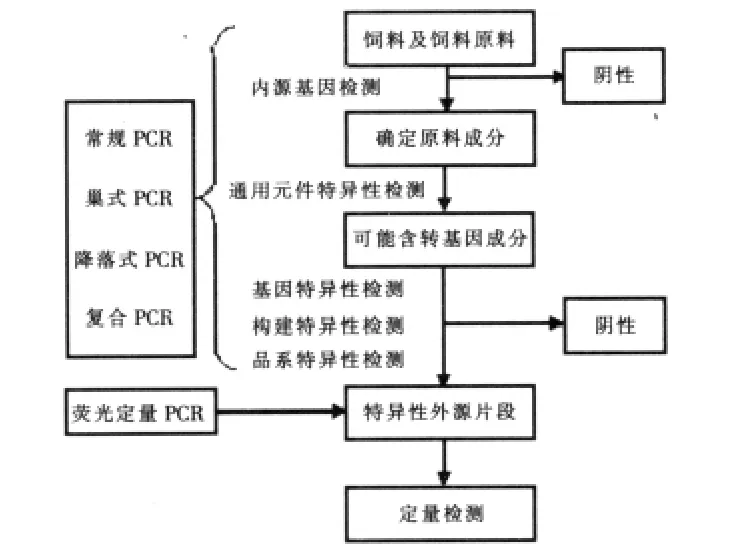
图2 转基因饲料检测策略
2.2.2 巢式PCR法 巢式PCR是常规PCR的一种改良模式,使用巢式PCR对目的基因进行多轮连续扩增,可提高灵敏度和特异性。在饲料等深加工产品中,DNA片段部分降解,且混合后相对浓度降低,常规PCR扩增时会出现假阴性结果。巢式PCR则可弥补这一缺陷。Zhang等(2007)用三重巢式PCR技术检测抗草甘膦大豆深加工产品,检 测 基 因 为 lectin、CaMV 35S、CTP、CP4~EPSPS和NOS,灵敏度达0.005%。陶冉等(2007)利用巢式PCR对水产饲料和食品中的转基因成分的检测发现,转基因大豆不同稀释度DNA溶液用常规PCR扩增灵敏度为1%,经引物 F1R1(532 bp)、F2R2(324 bp)扩增以后,分别采用F2R2或F3R3(254 bp)进行第二轮扩增,采用F1R1-F2R2两对引物进行巢式PCR扩增,检测灵敏度为0.1%,而采用F2R2、F3R3两对引物进行巢式PCR扩增,检测灵敏度为0.01%。说明巢式PCR可提高检测灵敏性,且在一定范围内检测的目的片段越小,灵敏度越高。但巢式要经多轮PCR反应,检测时间相对于常规PCR检测时间更长,不利于大规模的转基因样品检测。
2.2.3 降落式PCR法 降落式PCR对常规PCR的优化体现在退火温度上,可以有效避免非特异产物的出现。降落式PCR可以单独使用,也可以与其他PCR方法结合。Forte等(2005)用降落式PCR同复合PCR结合,分别扩增出了转基因玉米Bt176的内源基因及35S启动子,Roundup Ready转基因大豆内源基因、35S启动子及NOS终止子和转基因玉米Bt11内源基因、35S启动子及NOS终止子,检测最低限是0.5%。
2.2.4 复合PCR法 复合PCR是在一个PCR反应体系中加入两对或多对不同的引物,分别与相对应的模板反应,在同一个反应体系中扩增出多条目的DNA片段。同常规PCR相比,扩增相同条数的目的DNA,复合PCR具有时间短、效率高,经济便捷等优点,同时又具有常规PCR反应的灵敏性和特异性,非常适合用于饲料中若干原料的转基因检测。于忠娜等(2007)以大豆内源基因、35S启动子、NOS终止子和35S~CTP4为检测对象,研究了对内源基因与外源基因的引物终浓度配比及退火温度对转基因豆粕多重PCR检测的影响,结果表明,建立的多重PCR方法能够准确地检测出豆粕中的内源基因和外源转基因成分。Hernández 等 (2005)针 对 MON810、Bt11、T25 及GA21基因设计特异性的引物,在一个PCR反应体系中扩增出468、280、177 bp及90 bp的目的片段,成功的鉴别出该4种转基因玉米,灵敏度为0.05%。理论上,只要扩增条件合适,引物对数量可以无限。但由于引物之间对模板的竞争、引物与模板之间以及引物与酶之间的互作,往往达不到理想效果。在同一个反应体系当中,引物之间Tm值和退火温度相差不能太大,引物之间互补碱基不能太多,否则易形成引物二聚体,扩增片段之间也不能太接近(邓鸿铃等,2007),否则不易区分。聚丙烯酰胺凝胶电泳分离DNA时,具有很高灵敏性,能检测出差异为3~10 bp的DNA片段,可用于复合PCR扩增产物检测。同时聚丙烯酰胺凝胶电泳的灵敏度是琼脂糖凝胶电泳的10倍左右,能获得更高灵敏结果(冯家望等,2006)。
近年来,复合PCR与基因芯片结合越来越多地应用到转基因检测上。Hamels等(2009)用多重PCR扩增出目的片段,杂交于带有荧光探针的基因芯片上,从通用元件特异性、基因特异性及品系特异性3个层次成功地检测出了转基因玉米、大豆及油菜等多种转基因作物,灵敏度≤0.1%。这种方法的优势在于:(1)由于特异性探针的存在,即使出现非特异性扩增,也不会被检测出来,所以特异性非常高(Alexandre 等,2001)。 (2)可以把多个复合PCR的产物集合在同一个基因芯片上进行同步检测,既实现了高通量,且省时省力。
2.2.5 定量PCR法 由于转基因作物的含量是进行转基因标识的依据,所以对转基因的定量分析非常重要。转基因作物的定量PCR非常灵敏,且和提取工艺也有一定关系 (Charels等,2007),高质量及纯度的提取方法对定量检测非常重要。徐淼锋等(2009)用荧光定量PCR技术对转基因菜籽粕CaMV 35S启动子、NOS终止子及NPTⅡ检测时发现,深加工的菜籽粕内、外源基因的Ct值一般都出现较晚,且使用DNA浓度低于100 ng/μL 或高于 1500 ng/μL 时 Ct值都大于 40,建议模板使用浓度为500~1300 ng/μL。
随着实时定量PCR技术的发展,对多种转基因成分同时进行实时定量检测成为可能。针对不同目的基因设计不同荧光基团,可在同一个PCR体系中同时检测两种以上转基因成分的含量。多重定量PCR同时具有多重PCR和定量PCR的优点,探针的存在有效地避免了假阳性的存在。Oguchi等(2009)用双重实时定量PCR同时检测花椰菜花叶病毒35S启动子及GA21玉米特异性基因,检测效果与单一的检测效果差异很小,并可减少一半时间及成本。但荧光定量PCR仪器及探针成本较高,是制约该方法普及的一个重要因素。
3 小结及展望
综上所述,转基因饲料检测的实质是在不同的特异性检测水平上,用一系列检测技术有针对性地对转基因饲料原料进行快速、灵敏及高通量检测。随着生物技术日益成熟,转基因作物品系越来越多,由于具有双亲的优点,转基因杂交品系也越发受欢迎,目前尚未有有效方法将两者区分开,这是转基因饲料成分检测技术研究需要加强的方向。饲料原料的复杂性及加工工艺的特殊性等因素,也都给转基因饲料检测带来挑战。PCR技术可使基因片段指数扩增,有效地放大转基因信号,加上PCR技术与其他技术结合,如PCR-ELISA、PCR-基因芯片、PCR-生物传感器等 (陈福生等,2004),可以满足不同检测需要,但是需要针对不同饲料产品的特点进行优化和完善,这是转基因饲料检测值得引起重视的新课题。
[1]陈福生,高志贤,王建华.食品安全检测与现代生物技术[M].北京:化学工业出版社,2004.,162 ~ 184.
[2]邓鸿铃,郭新东,吴玉銮.利用PCR方法检测水稻及其加工产品中转基因水稻[J].食品科技,2007,32(2):248 ~ 251.
[3]冯家望,王小玉,李丹琳.多重PCR检测食品中转基因成分研究[J].检验检疫科学,2006,16(4):16 ~ 19.
[4]陶冉,刘梅,王雷,等.应用巢式PCR技术对水产饲料及食品转基因成分检测的研究[J].饲料工业,2007,28(21):34 ~ 38.
[5]徐淼锋,尹浩,莫义武,等.实时荧光PCR定量检测菜籽粕中转基因成分的研究[J].植物检疫,2009,23(1):4 ~ 6.
[6]于忠娜,苗向阳,单虎.豆粕饲料中转基因成分的多重PCR快速检测[J].动物医学进展,2007,28(1):53 ~ 56.
[7]张舒亚,潘良文,吕蓉,等.饲料中转基因成分的实时荧光PCR检测研究[J].中国饲料,2007,(19):9 ~ 11,19.
[8]Alexandre I,Hamels S,Dufour S,et al.Colorimetric Silver Detection of DNA Microarrays[J].Analytical Biochemistry,2001,295(1):1 ~ 8.
[9]Barbau-Piednoir E,Lievens A,Mbongolo-Mbella G,et al.SYBR Green qPCR screening methods for the presence of “35S promoter”and “NOS terminator”elements in food and feed products[J].Eruopean Food Research and Technology,2010,230(3):383 ~ 393.
[10]Charels D,Broeddrs S,Corbisier P,et al.Toward metrological traceability forDNA fragmentratiosin GM quantification.2.Systematic study of paratmters influencing the quantitative determination of MON810 corn by real-time PCR[J].Agricultual and Food Chemistry,2007,55(9):3258 ~ 3267.
[11]Forte V T,Di Pinto A,Martino C.A general multiplex-PCR assay for the general detection of genetically modified soya and maize[J].Food Control,2005,16(6):535 ~ 539.
[12]Hamels S,Glouden T,Gillard K,et al.A PCR-microarray method for the screening of genetically modified organisms[J].European Food Research and Technology,2009,228(4):531 ~ 541.
[13]Hernández M,Rodríguez-Lázaro D,Zhang D,et al.Interlaboratory Transfer of a PCR Multiplex Method for Simultaneous Detection of Four Genetically Modified Maize Lines:Bt11,MON810,T25,and GA21[J].Journal of Agricultural and Food Chemistry,2005,53(9):3333 ~ 3337.
[14]Lutz B,Wiedemann S,Albrecht C.Degradation of transgenic Cry1Ab DNA and protein in Bt-176 maize during the ensiling process[J].Journal of Animal Physiology and Animal Nutrition,2006,90(3 ~ 4):116 ~ 123.
[15]Oguchi T,Onishi M,Minegishi Y.Development of quantitative duplex real-time PCR method for screening analysis of genetically modified maize[J].Journal of Food Hygienic Society of Japan,2009,50(3):117 ~ 25.
[16]Rudi K,Rud I,Holck A.A novel multiplex quantitative DNA array based PCR (MQDA-PCR)for quantification of transgenic maize in food and feed[J].Nucleic Acids Research,2003,31(11):e62.
[17]TengelC,SchüβlerP,Setzke E,etal.PCR-Based Detection of Genetically Modified Soybean and Maize in Raw and Highly Processed Foodstuffs[J].BioTechniques,2001,31(2):426 ~ 429.
[18]Vijayakumar K R,Martin A,Gowda L R,et al.Detection of genetically modified soy and maize:impact of heat processing [J].Food Chemistry,2009,117:514 ~ 521.
[19]Zhang M H,Gao X J,Yu Y B,et al.Detection of Roundup Ready soy in highly processed products by triplex nested PCR[J].Food Control,2007,18(10):1277 ~ 1281.
