丹参酮ⅡA对腹膜透析液诱导的大鼠腹膜组织学变化及TGF-β1表达的影响
2010-04-18
(南京大学医学院附属南京鼓楼医院肾内科,江苏南京 210008)
腹膜透析(peritoneal dialysis,PD)是治疗终末期肾脏病的主要方法,然而腹膜透析液(peritoneal dialysis solutions,PDS)中的高糖、低pH值及反复发生的腹膜炎介导的腹膜纤维化导致腹膜结构改变和功能丧失是长期PD患者退出PD的主要原因。研究表明,转化生长因子-β1(TGF-β1)分泌增加是腹膜纤维化发生发展的重要因素。许多实验研究证明,中药丹参酮ⅡA(tanshinoneⅡA)可以拮抗多种因素对细胞造成的损伤作用,减轻纤维化[1-2]。我们通过观察丹参酮ⅡA对葡萄糖PDS干预下的大鼠腹膜组织学变化以及TGF-β1表达的影响,探讨丹参酮ⅡA是否具有抑制TGF-β1的表达从而发挥抗腹膜纤维化作用。
1 材料与方法
1.1 实验动物及分组
SD(Sprague-Dawley)大鼠50只,雄性,清洁级,体重180~220 g,周龄6~8周(南京大学动物实验中心提供),于清洁级动物笼内适应性喂养1周后进入正式实验,给予清洁级大鼠饲料及自由饮水。50只大鼠随机分为5组,每组10只:对照组,每日用生理盐水腹腔注射20 ml;PDS组,每日用4.25%的PDS腹腔注射20 ml;丹参酮低、中、高浓度组,每日分别用含丹参酮ⅡA 浓度为 50、100、200 mg·L-1的4.25%的 PDS 腹腔注射20 ml。于实验第30天,注射上述药物2 h后氯胺酮(3 ml·kg-1)肌肉注射麻醉,打开腹腔取壁层腹膜组织置于10%中性缓冲甲醛中,断颈处死大鼠。
1.2 药物、主要试剂和仪器
4.5%Baxter PDS为广州百特医疗用品公司产品,丹参酮ⅡA磺酸钠注射液为江苏科菲平医药有限公司产品,规格10 mg·支-1。兔抗大鼠 TGF-β1多克隆抗体购于美国Santa Cruz公司,二步法免疫组化检测试剂(PV-6001)购于北京中杉金桥生物技术有限公司。
1.3 腹膜组织学检查
取石蜡包埋的壁层腹膜组织,作2 μm切片,60℃烘干融蜡,二甲苯脱蜡,梯度酒精水化并经蒸馏水充分漂洗,常规方法HE、Masson染色,光镜下观察病理改变。壁层腹膜厚度测量,选用HE染色切片200倍光学显微镜下观察,每张切片随机选取5个视野,每个视野分5处测量,取其平均值作为腹膜厚度值。壁层腹膜Masson染色切片,200倍光学显微镜下观察胶原纤维分布,以蓝绿色为阳性信号,每张切片随机选取5个视野摄片,经Image-Pro Plus 5.0图像分析系统(美国Media Cybernetics公司)采集图像,分析其阳性信号的平均积分光密度(integrated OD total,IOD),取平均值。
1.4 TGF-β1的表达
用免疫组织化学方法测定。取石蜡包埋的壁层腹膜组织,作2 μm切片。石蜡切片经二甲苯脱蜡,梯度酒精水化并经蒸馏水充分漂洗后置于1 mmol·L-1的EDTA(pH 8.0)缓冲液中电磁炉加高压锅方法高温高压热修复2 min。PBS缓冲液漂洗后滴加3%H2O2阻断内源性过氧化物酶,孵育10 min,PBS缓冲液中漂洗3 min×3 次,吸干后滴加 100 μl兔抗大鼠 TGF-β1多克隆抗体(1∶800),4℃冰箱孵育过夜,PBS缓冲液漂洗3 min×3次,再滴加100 μl二步法免疫组化检测试剂,室温下孵育30 min,再次PBS缓冲液漂洗3 min×3次。DAB显色,光镜控制,蒸馏水漂洗,复染及封片。阴性对照用PBS缓冲液代替一抗。每张切片在400倍光学显微镜下观察显色结果,棕褐色颗粒为阳性信号,每张切片随机选取5个视野摄片,经Image-Pro Plus 5.0图像分析系统分析其阳性信号的IOD值,取平均值。
1.5 统计学处理
结果用均数±标准差表示,组间差异比较采用SPSS 13.0软件进行方差分析检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠腹膜组织学观察
HE染色显示对照组大鼠腹膜较薄,间皮细胞完好,间皮下基底膜薄,并与结缔组织相连,间皮下胶原纤维无明显沉积。PDS组大鼠腹膜明显增厚,间皮细胞脱落,腹膜间皮下基质明显增多,胶原纤维大量沉积。丹参酮组大鼠腹膜也有增厚,间皮细胞也有脱落,间皮下基质增多,胶原纤维沉积,程度比PDS组略轻(图1)。各组壁层腹膜致密层厚度比较见表1,其中PDS组腹膜增厚程度最明显(P<0.01);丹参酮低浓度组与丹参酮中、高浓度组相比,具有显著差异(P<0.01);丹参酮高浓度组与丹参酮中浓度组相比,具有显著差异(P <0.01)。

图1 各组大鼠壁层腹膜组织学观察 HE染色×200Fig 1 Morphology changes of parietal peritoneum from rats HE staining,Magnification×200

表1 各组壁层腹膜致密层厚度比较Tab 1 Submesothelial compact zone thickness of parietal peritoneum from rats
Masson染色显示PDS组胶原纤维的阳性染色主要分布在腹膜间皮下间质,较对照组阳性染色明显增多(图2)。胶原纤维分布的半定量分析结果见表2。PDS组壁层腹膜胶原纤维含量明显高于其他各组(P<0.01)。丹参酮中、高浓度组较丹参酮低浓度组胶原含量均明显减少(P<0.05);丹参酮中浓度组较丹参酮高浓度组胶原纤维含量明显增加(P<0.05)。

图2 各组大鼠壁层腹膜组织学观察 Masson染色×200Fig 2 Morphology changes of parietal peritoneum from rats Masson staining,Magnification×200
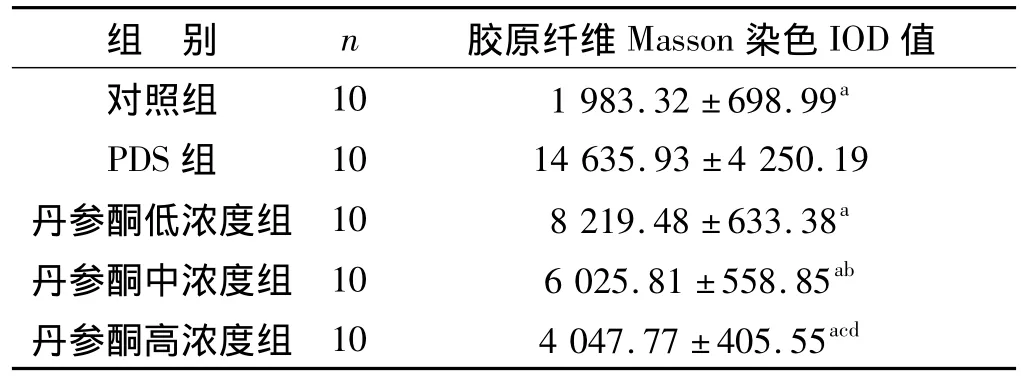
表2 各组大鼠壁层腹膜胶原纤维分布的半定量分析Tab 2 Semiquantitative analysis of submesothelial matrix of parietal peritoneum from rats
2.2 各组大鼠壁层腹膜组织中TGF-β1分布观察及半定量分析结果
免疫组织化学法检测显示,TGF-β1的阳性染色(棕褐色)主要分布在腹膜间皮细胞胞浆(图3)。TGF-β1表达半定量分析结果见表3。与PDS组壁层腹膜比较,对照组 TGF-β1表达量显著减少(P<0.01),丹参酮组明显减少(P <0.01)。丹参酮中、高浓度组较丹参酮低浓度组TGF-β1表达量明显减少(P<0.01),丹参酮高浓度组较中浓度组TGF-β1表达量明显下降(P <0.05)。

图3 各组大鼠壁层腹膜TGF-β1观察 ×400Fig 3 Expression of TGF-β1in parietal peritoneum from rats Magnification×400
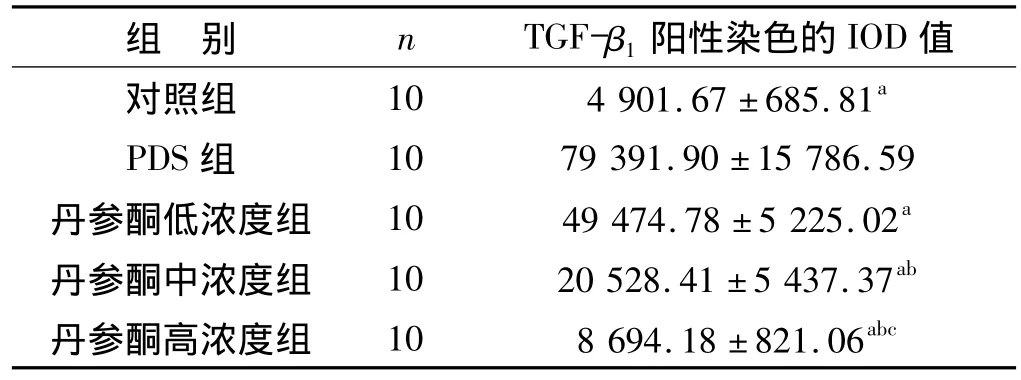
表3 各组大鼠壁层腹膜TGF-β1分布的半定量分析Tab 3 Expression of TGF-β1in parietal peritoneum from rats
3 讨 论
PD是治疗终末期肾脏病的有效方法之一,因其具有不需特殊设备、操作简便、对血流动力学影响小、残余肾功能保护较好等优点,得到了越来越广泛的应用。但随着PD时间的延长,腹膜间皮细胞发生微绒毛丧失、细胞间隙增宽、细胞脱落等形态学改变,间皮细胞下大量细胞外基质堆积[3],腹膜发生纤维化最终可导致腹膜功能衰竭,这已成为患者退出PD的主要原因。在本研究中,对照组大鼠腹膜间皮细胞完好,间皮下基底膜薄并与结缔组织相连,间皮下胶原纤维无明显沉积;而PDS组大鼠腹膜明显增厚(P<0.01),间皮细胞脱落,腹膜间皮下基质明显增多,有胶原纤维大量沉积(P<0.01)。证明传统葡萄糖PDS具有的生物不相容性可以导致腹膜纤维化的发生。
TGF-β是一个多功能的细胞因子,通过TGF-Smad或其它信号通路(如Ras/MEK/ERK和蛋白激酶C信号通路)参与许多生理和病理过程,促进或抑制细胞增殖、调节各种组织分化和参与纤维化[4-6]。其中,TGF-β1的过度表达在纤维化中起关键作用,并贯穿于纤维化的发生到维持的整个过程。在PD过程中,尿毒症毒素如晚期糖基化终产物等通过人腹膜间皮细胞(Human peritoneal mesothelial cells,HPMC)表面受体刺激TGF-β1的分泌;传统非生物相容性PDS中的高糖、低pH值及反复发生的腹腔内细菌感染引起腹膜间皮细胞、成纤维细胞及浸润的巨噬细胞分泌TGF-。TGF-β1的过度表达和分泌促进了细胞外基质的沉积,最终导致腹膜纤维化的发生[8-9]。Yuan 等[10]用重组人的TGF-β1反义核苷酸真核细胞表达载体转染HPMC,通过抑制TGF-β1的合成使HPMC表达纤维连接蛋白较空表达载体组下降17%。Margetts等[4]使用腺病毒载体将TGF-β1基因导入大鼠腹腔,7 d后开始发现腹膜增厚、胶原过度沉积以及新生血管形成,并伴有腹膜溶质转运增加。
TGF-β1主要通过以下机制导致腹膜纤维化:(1)直接刺激腹膜间皮细胞分泌细胞外基质蛋白如胶原蛋白Ⅰ、Ⅱ、Ⅳ,层粘连蛋白,纤维连接蛋白,进而促进细胞外基质的沉积[11]。(2)诱导下调表达间皮细胞的表面标志E-cadherin和cytokeratins,上调表达α-SMA等纤维母细胞的表面标志,使间皮细胞具有迁移功能和纤维母细胞的特性,能够分泌胶原纤维、纤维连接蛋白等细胞外基质成分,间接使细胞外基质成分增多,即间皮细胞的间叶转分化[12],这将长期保持间叶细胞状态并加剧腹膜纤维化;(3)诱导结缔组织生长因子(connective tissue growth factor,CTGF)的表达,CTGF可以促进纤维母细胞的分化、迁移和黏附,并促进其合成细胞外基质,是纤维化形成过程的启动钥匙[13];(4)通过调节基质金属蛋白酶和其抑制物的平衡,增加细胞外基质的合成并抑制其降解[14-15]。(5)刺激腹膜间皮细胞上调纤维蛋白溶酶原活化物(PA)抑制物PAI-1的表达,从而抑制细胞外基质的降解[16]。(6)刺激细胞外基质蛋白受体的合成。
丹参酮ⅡA是中药丹参的提取物,也是丹参重要的有效药理成分之一,具有明确的分子结构,在临床使用安全,无明显副作用。研究已经证明,丹参酮ⅡA可以减少血管损伤后细胞外基质胶原的生成[1],能通过抑制TGF-β1的表达减轻肺纤维化[2]。丹参能拮抗高渗PDS对腹膜间皮层结构的损伤,维持腹膜间皮层结构的完整性[17]。张丹等[18]通过动物实验发现,丹参能提高腹膜物质清除率,拮抗PDS引起间皮细胞过度表达AQP-1蛋白,提高ZO-1蛋白表达量,促进间皮细胞增生,维持紧密连接结构完整性,拮抗PDS对腹膜组织结构和功能的损伤,延缓腹膜纤维化的发生。
本研究通过在PDS中添加不同浓度的丹参酮ⅡA,观察其对腹腔注射PDS大鼠TGF-β1表达以及腹膜组织学改变的影响。我们的研究发现,在PDS中添加丹参酮ⅡA后,腹膜间皮细胞脱落程度、腹膜致密层厚度、间皮下基质的沉积均有明显改善。同时,免疫组化显示,腹膜组织TGF-β1表达较PDS组有明显的下调(P<0.01),并且这种作用呈现一定的浓度依赖性。提示丹参酮作为PDS添加剂可能具有抑制TGF-β1的表达,从而抑制腹膜间皮细胞损伤和腹膜致密层的增厚,潜在保护腹膜,延缓腹膜纤维化的作用。
[1]陈怀生,龙波,梁玉佳,等.丹参酮ⅡA对兔髂动脉球囊损伤后胶原生成抑制的效应观察[J].中药材,2005,28(10):903-906.
[2]李广虎,李志平,徐泳,等.丹参酮ⅡA对放射性肺纤维化防治作用的研究[J].中华放射肿瘤杂志,2006,15(1):50-54.
[3]IZUMOTANI T,ISHIMURA E,YAMAMOTO T,et al.Correlation between peritoneal mesothelial cell cytology and peritoneal histopathology with respect to prognosis in patients on continuous ambulatory peritoneal dialysis[J].Nephron,2001,89(1):43-49.
[4]MARGETTS P J,KOLB M,GALT T,et al.Gene transfer of transforming growth factor-beta1 to the rat peritoneum:effects on membrane function[J].J Am Soc Nephrol,2001,12(10):2029-2039.
[5]JOSEPHS S E.Cell signaling by receptor tyrosin kinases[J].Cell,2000,103:211-225.
[6]KOHEIN M.Positive and negative of TGF-beta signaling[J].J Cell Sci,2000,113:1102-1109.
[7]LIU Y H,LIU FY,ZHANG H.Effects of high glucose on the cell proliferation,damage and cytokine in human peritoneal mesothelial cells[J].Medical Journal of Zhergnan Univercity,2006,31(4):575-579.
[8] JAYYOUSI R A,MEDCALF J F,HARRIS K P.Role of transforming growth factor beta in peritoneal fibrosis[J].Nephrology,2002,7(5):216-219.
[9]NAIKI Y,MAEDA Y,MATSUO K,et al.Involvement of TGF-beta signal for peritoneal sclerosing in continuous ambulatory peritoneal dialysis[J].J Nephrol,2003,16(1):95-102.
[10]YUAN F,LIU F Y,LIU Y H.Effect of TGF beta1 antisense RNA expression vector on synthesis and secretion of extracellular matrix in cultured human peritoneal mesot helial cells[J].Medical Journal of Zhergnan Univercity,2004,29(5):548-551.
[11]MEDCALF J F,WALLS J,PAWLUCZYK I Z,et al.Effects of glucose dialysate on extracellular matrix production by human peritoneal mesothelial cells(HPMC):the role of TGF-beta[J].Nephrol Dial Transplant,2001,16:1885-1892.
[12]LIU Y.Epithelial to mesenchymal transition in renal fibrogenesis:pathologic significance,molecular mechanism,and therapeutic intervention[J].J Am Soc Nephrol,2004,15(1):1-12.
[13] ZARRINKALAM K H,STANLEY J M,GRAY J,et al.Connective tissue growth factor and its regulation in the peritoneal cavity of peritoneal dialysis patients[J].Kidney Int,2003,64(1):331-338.
[14]MARTIN J,YUNG S,ROBSON R L,et al.Production and regulation of matrixmetallop roteinases and their inhibitors by human peritoneal mesothelial cells[J].Perit Dial Int,2000,20:524-533.
[15]CHEGINI N.The role of growth factors in peritoneal healing:transforming growth factor beta(TGF-beta)[J].Eur J Surg Suppl,1997,(577):17-23.
[16]ROUGIER J P,GUIA S,HAGEGE J,et al.PAI-1 secretion and matrix deposition in human peritoneal mesothelial cell cultures:transcriptional regulation by TGF-beta 1[J].Kidney Int,1998,54:87-98.
[17]席春生,周清发,刘静.丹参黄芪对实验大鼠腹膜透析效能及腹膜超微结构的急性影响[J].中国现代医学杂志,2001,11(1):1-2.
[18]张丹,舒静,王怡.丹参注射液减轻腹透液致大鼠腹膜结构和功能损伤[J].中西医结合学报,2008,6(5):517-523.
