营养限制对断奶羔羊血浆和胃肠道上皮组织抗氧化能力的影响
2010-04-17张庆丽谭支良贺志雄张恩平孙志洪
张庆丽 谭支良 贺志雄 张恩平 孙志洪,3*
(1.西北农林科技大学动物科技学院,杨凌 712100;2.中国科学院亚热带农业生态过程重点实验室,长沙 410125; 3.西南大学动物科技学院,重庆 400715)
近年来,人类流行病学研究、临床医学研究和模型动物研究的结果均证实早期营养不足广泛影响机体认知、代谢、免疫、抗氧化能力以及胃肠道等多个器官和系统的发育[1-3]。机体新陈代谢过程中产生的自由基浓度过高会使细胞产生氧化损伤,而机体抗氧化系统可对细胞进行保护,使细胞免受自由基的损伤[4-6]。饲粮蛋白质和能量不足会导致胃肠道黏膜损伤,改变其抗氧化能力,如降低谷胱甘肽(glutathione,GSH)的含量[7]和超氧化物歧化酶(superoxide dism utase,SOD)的活性[8],从而引发氧化应激[9-10]。牛、羊尤其是妊娠母体和新生幼体(出生后0~3个月)因受草料供应短缺(冬、春季节)以及粗放式饲养管理的影响,面临着营养不足的问题,其中蛋白质和能量缺乏最为普遍。目前,国内外有关新生牛、羊关键营养素缺乏对胃肠道上皮组织抗氧化能力影响的报道极少。因此,本研究对28日龄断奶羔羊进行能量、蛋白质或能量与蛋白质同时限制饲养,拟研究营养限制期间以及营养恢复期间血浆与胃肠道上皮组织抗氧化能力的变化,为减少新生反刍动物因营养素缺乏所引起的氧化应激而进行的针对性营养干预提供科学依据。
1 材料与方法
1.1 试验动物
试验动物为28日龄断奶羔羊,由中国科学院亚热带农业生态研究所与浏阳黑山羊产业研发中心共建的动物试验基地提供。选用60头第2胎、体重为(25.0±1.0)kg的浏阳黑山羊为受孕母羊,采用同步发情、人工受精和人工催产技术,以保证出生羔羊的同步性。
1.2 试验设计与饲粮
选用48头健康状况良好、平均体重为(3.38± 0.04)kg的28日龄断奶羔羊,按随机区组原则分配到以下4组中:对照组(C组,饲喂开食料+牧草)、低能组(LN组,饲喂限制40%能量的开食料+牧草)、低蛋组(LP组,饲喂限制40%蛋白质的开食料+牧草)以及低能低蛋组(LNP组,饲喂限制40%能量和40%蛋白质的开食料+牧草),分配之后进行性别调整,使各组公羔和母羔的数量一致。每组4个重复,每个重复3只羊。试验分为营养限制期(时间为7周,饲喂开食料和牧草)和营养恢复期(时间为9周,饲喂配合精料和玉米秸秆)。试验开始前进行1周的预试期,饲喂开食料和牧草。开食料组成及营养水平见表1,配合精料原料组成(风干基础):玉米56.0%、麦麸12.0%、酵母粉10.5%、豆粕15.0%、食盐1.0%、鱼粉2.0%、石粉1.5%、磷酸氢钙0.5%、反刍动物多维预混料0.1%、反刍动物矿物质预混料1.0%和碳酸氢钠0.4%。
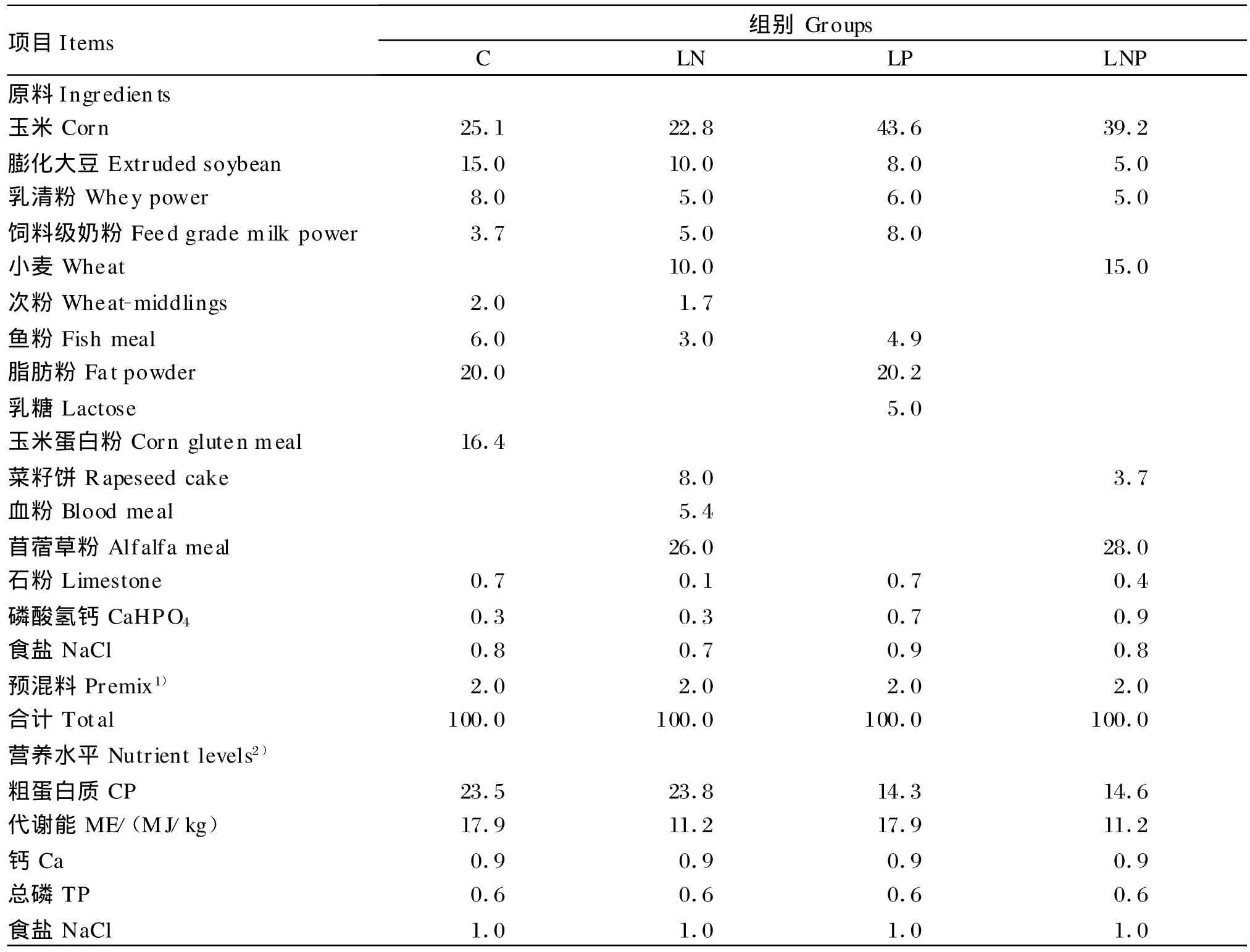
表1 开食料组成及营养水平(风干基础)Table 1 Com position and nutrient levels o f starters(air-dry basis)%
1.3 饲养管理
试验第1周至第7周,羔羊采食开食料和牧草,开食料和牧草饲喂比为6∶4,用凉开水将粉状饲料搅拌成粥样,以促进采食;试验第8周至第16周,羔羊采食配合精料和玉米秸秆,精粗比为5∶5,精料、粗料直接饲喂。试验期间干物质饲喂量随日龄增加而增加,29~49日龄为50 g,50~69日龄为100 g, 70~99日龄为150 g,100~119日龄为200 g,120日龄至试验结束为250 g。试验期间每日饲喂2次,饲喂时间为08:00和16:00,自由饮水。试验期间记录每天的精料、粗料采食量,如果每天干物质剩余量小于饲喂量的5%,则增加干物质的饲喂量,精料和粗料每次增加量分别为50和100 g。
1.4 样品分析
1.4.1 样品采集
试验第21天、第41天和第111天,饲喂前,每组随机选择5头(3头公羔和2头母羔)体重最为接近平均体重的羔羊,颈静脉采血5m L,肝素钠抗凝,室温静置1 h后,于4℃、3 000 r/min条件下离心20 min,血浆于-20℃下保存。
试验第42天和第112天,从每组中挑选3头(2头公羔和1头母羔)体重最为接近平均体重的羔羊进行屠宰,颈动脉放血。待动物停止呼吸后剖开腹腔,取出内脏组织,分段结扎胃肠道,采集瘤胃上皮和空肠黏膜组织,液氮速冻后于-80℃下保存。
1.4.2 组织样品前处理
瘤胃上皮和空肠黏膜进行抗氧化指标测定前要先行匀浆,组织匀浆液的制备方法如下:称取1 g左右的组织样品,加入9倍体积的预冷的双蒸水,将组织剪碎后迅速转入杆式玻璃匀浆器中进行匀浆,匀浆液于4℃、5 000 r/min条件下离心20 m in,取上清液备测。
1.4.3 指标测定
对血浆样品和组织匀浆液进行SOD、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和谷胱甘肽还原酶(g lutathione reductase,GR)活性、总抗氧化能力(total an tioxidant capacity,T-AOC)以及丙二醛(m alondialchehyche,MDA)、GSH含量测定,上述指标测定所用试剂盒购自南京建成生物工程研究所,检测方法如说明书所示。
1.5 数据分析
试验数据用Excel 2007初步整理后,用SAS 6.12软件包的一般线性模型(GLM)进行统计分析,并用Duncan氏法进行多重比较,P<0.05为差异显著。数据以平均值和平均标准误(SEM)表示。
2 结 果
2.1 血浆抗氧化能力
由表2可知,进行能量限制饲养显著降低试验第21天血浆GR活性和T-AOC(P<0.05),同时显著提高试验第21天血浆MDA含量(P<0.05);进行蛋白质限制饲养显著降低试验第21天血浆GR活性和T-AOC,同时显著提高试验第21天和第41天血浆MDA含量(P<0.05);同时进行能量与蛋白质限制饲养显著降低试验第21天血浆CAT、GR活性,试验第41天血浆CAT、SOD活性以及试验第21天、第41天和第111天血浆T-AOC活性(P<0.05),同时显著提高试验第21天和第41天血浆MDA含量(P<0.05)。
2.2 胃肠道上皮组织抗氧化能力
2.2.1 试验第42天
由表3可知,进行能量限制饲养显著降低瘤胃上皮和空肠黏膜GSH含量、空肠黏膜CAT和GR活性(P<0.05);进行蛋白质限制饲养显著降低瘤胃上皮和空肠黏膜GSH含量、空肠黏膜GSH-Px活性和T-AOC(P<0.05);进行能量与蛋白质同时限制饲养显著降低瘤胃上皮和空肠黏膜GSH含量和CAT活性,空肠黏膜SOD、GSH-Px和GR活性及T-AOC(P<0.05)。
2.2.2 试验第112天
由表4可知,进行能量限制饲养显著降低空肠黏膜SOD活性和T-AOC(P<0.05);进行蛋白质限制饲养显著降低瘤胃上皮和空肠黏膜T-AOC以及空肠黏膜SOD活性(P<0.05);进行能量与蛋白质同时限制饲养显著降低瘤胃上皮和空肠黏膜T-AOC以及空肠黏膜GSH含量和SOD、GR活性(P<0.05)。
3 讨 论
3.1 血浆抗氧化能力
本研究结果表明,营养限制期间,羔羊血浆抗氧化能力受营养限制的影响而出现降低,营养水平恢复后,除低能低蛋组羔羊血浆T-AOC低于对照组外,营养限制组羔羊血浆所测定的抗氧化指标都恢复到了对照组水平。在其他模型动物上的研究也证实了营养限制会影响机体血浆抗氧化能力[11-12]。

表2 营养限制对断奶羔羊血浆抗氧化能力的影响Tab le 2 Ef fects of nutrient restric tion on p lasma antioxidant capacity in w ean ling lambs(n=5)
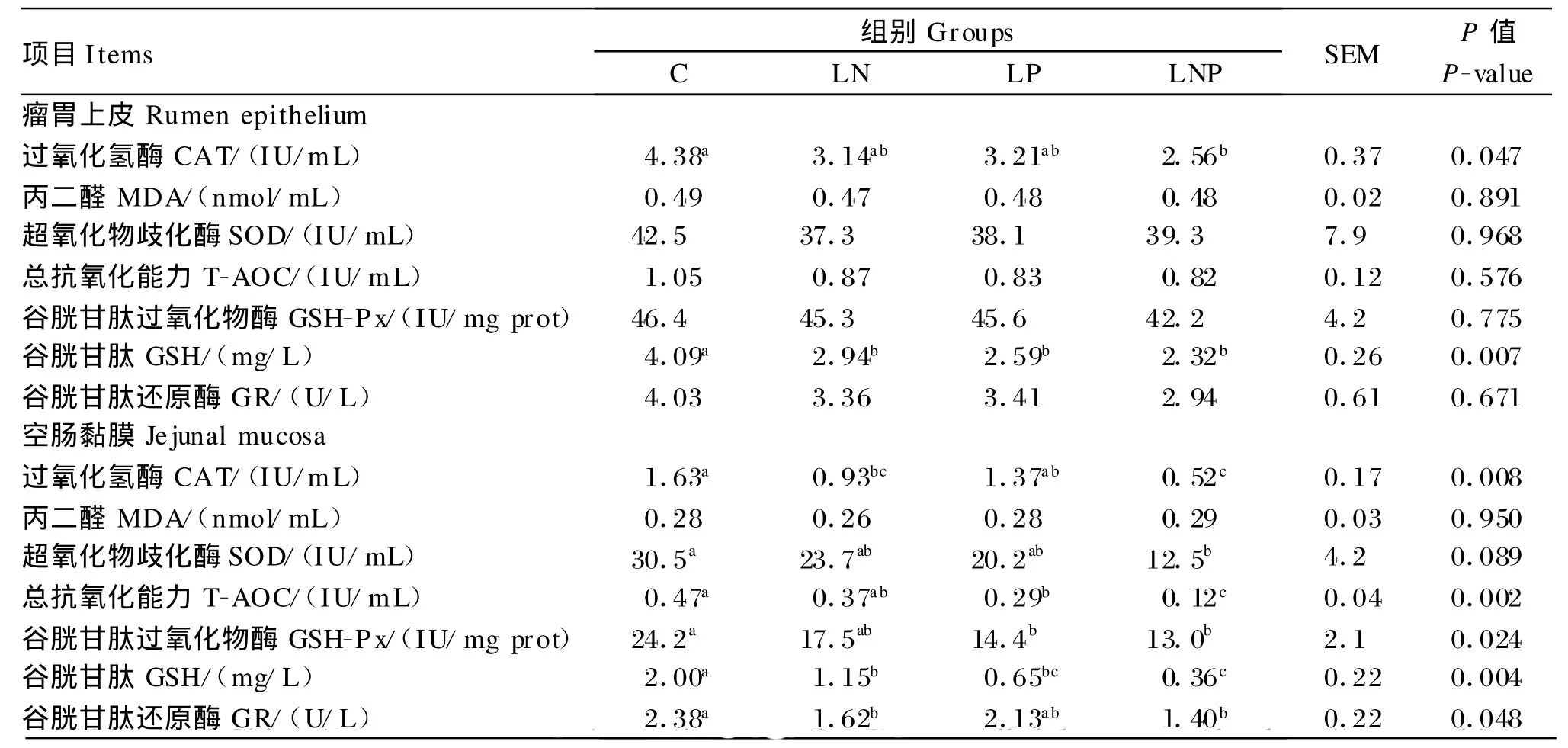
表3 营养限制对断奶羔羊胃肠道上皮组织抗氧化能力的影响(试验第42天)Table 3 Effects o f nutrient restriction on antioxidant capacity of gut epithelial tissues in w ean ling lambs(day 42 of experiment,n=5)
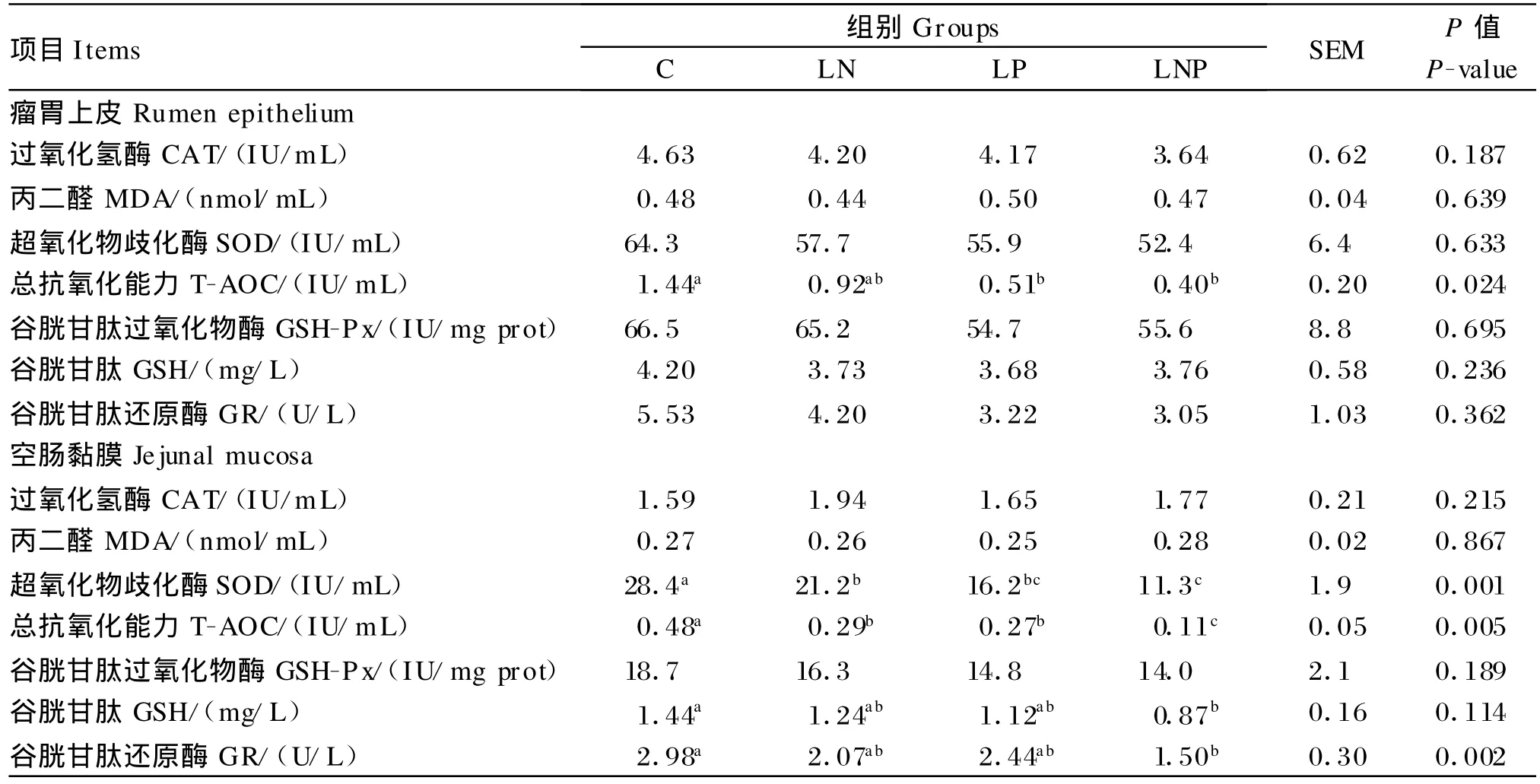
表4 营养限制对断奶羔羊胃肠道上皮组织抗氧化能力的影响(试验第112天)Table 4 Effects o f nutrient restriction on antioxidant capacity of gut epithelial tissues in w eanling lambs(day 112 of experiment,n=3)
组织器官在生化反应过程中持续产生自由基[13],自由基具有诸多重要生理功能,如调节细胞分化、细胞凋亡、胞内信号转导以及抵御微生物侵袭等[14-18]。但过多的自由基可以破坏核酸、蛋白质、脂类、碳水化合物等生物大分子,使机体患病,加速衰老。在营养缺乏或其他非正常生理状态下,机体内自由基产生量增多,抗氧化酶生物合成下降,内源性抗氧化剂水平减少,外源性抗氧化剂供给量不足,使自由基的产生与清除失衡,出现明显的内源性氧化应激,导致重要生物大分子损伤,机体对损伤的修复能力也会随之降低[19]。机体存在氧化还原态势的平衡能力,正常生理状态下的组织细胞可通过自我保护免受氧化损伤,而处于非正常生理状态下的组织细胞免受氧化损伤的自我保护能力将下降[4,10]。在抗氧化防御体系中,各种抗氧化酶起着不同的作用,SOD是超氧阴离子自由基的天然清除剂,可加速超氧阴离子自由基发生歧化反应,清除超氧阴离子自由基,防止其对机体的氧化损伤; GSH-Px利用GSH作为底物,与SOD和CAT一起作用,共同清除机体的活性氧自由基,减少和阻止其对机体的氧化损伤[20];CAT是一种四聚氧化还原酶,能够分解过氧化氢;MDA是脂质过氧化产物的降解物,测定MDA的含量可以反映机体内自由基的积累程度,血浆MDA含量的高低间接反映机体细胞受自由基侵害的严重程度。本研究结果表明,对28日龄羔羊进行能量、蛋白质或能量与蛋白质同时限制饲养使血浆抗氧化能力下降,进而导致机体氧自由基累积。机体氧自由基的累积会引起机体细胞膜受到损伤,细胞氧化磷酸化障碍,损害细胞内DNA、蛋白质分子,引发脂质过氧化反应。
3.2 胃肠道上皮组织抗氧化能力
目前,断奶期哺乳动物进行营养限制对抗氧化能力的影响多集中在胃肠道外组织,对胃肠道上皮组织抗氧化能力影响的研究少有报道,而有关营养水平恢复后胃肠道上皮组织抗氧化能力受到的破坏是否得到解除的研究报道更为缺乏。Fang等[21]指出饲粮中蛋白质缺乏不仅影响抗氧化酶的合成,同时减少组织中抗氧化物的浓度,导致抗氧化能力降低。营养缺乏降低大鼠肠黏膜组织中GSH的含量[22]。于晓明等[23]研究报道,当能量供给不足时,大鼠肠黏膜的抗氧化能力显著降低,而补充蛋白质后,在一定程度上能提高机体的抗氧化能力,降低MDA的生成。本研究结果显示,对28日龄断奶羔羊进行能量、蛋白质或能量与蛋白质同时限制饲养降低了营养限制期间羔羊胃肠道上皮组织的抗氧化能力,营养水平恢复后各限制组羔羊胃肠道上皮组织抗氧化能力在试验观测期内未恢复到对照组水平,与上述结果一致。
胃肠道是养分消化、吸收和代谢的重要器官,过量自由基极易引发胃肠道功能障碍,使胃肠道黏膜损伤及黏膜通透性升高[24]。活性氧自由基是一种胃黏膜独立损伤因子,可直接攻击胃黏膜细胞,也可间接损伤胃黏膜,减弱胃黏膜对其他攻击因子的抵抗力[25]。体外试验研究发现小肠上皮细胞轻度的氧化应激可显著抑制肠细胞的增殖能力[24]。胃肠道是合成GSH的主要场所,GSH能清除氧自由基,促进胃肠细胞增殖,GSH含量下降会造成空肠黏膜结构和功能出现严重退化[26]。本研究结果显示,对28日龄断奶羔羊进行能量、蛋白质或能量与蛋白质同时限制饲养降低了羔羊胃肠道上皮组织抗氧化能力。胃肠道上皮组织抗氧化能力降低使代谢产生的多余的氧自由基得不到及时清除,氧自由基的累积会损伤胃肠道黏膜组织,使黏液层变薄、隐窝变浅、绒毛表面积减少、绒毛变短以及胃肠道黏膜上皮通透性增高,致使大量吸收细胞受到破坏,严重影响胃肠道吸收功能[27]。此外,胃肠道氧化应激将影响腺体分泌,GSH-Px活性降低导致胰腺功能损伤,引起胰腺萎缩,进而发生病变[28]。
本研究结果同时表明,对28日龄断奶羔羊进行能量、蛋白质或能量与蛋白质同时限制饲养,空肠黏膜抗氧化能力受到的破坏要比瘤胃上皮严重,其原因可能是瘤胃上皮和空肠黏膜调控氧化还原平衡的能力不同,关于这一推断有待于进一步深入研究。
4 结 论
①对28日龄断奶羔羊进行能量、蛋白质或能量与蛋白质同时限制饲养,特别是能量与蛋白质同时限制饲养,降低了羔羊血浆抗氧化能力,营养水平恢复后,除低能低蛋组羔羊血浆T-AOC低于对照组外,营养限制组羔羊血浆所测定的抗氧化指标都能恢复到对照组水平。
②对28日龄断奶羔羊进行能量、蛋白质或能量与蛋白质同时限制饲养,特别是能量与蛋白质同时限制饲养,降低了羔羊胃肠道上皮组织抗氧化能力,营养水平恢复后,营养限制组羔羊胃肠道上皮组织中降低的抗氧化指标部分未能恢复到对照组水平。
[1] FUKUDA M T,FRANCOLIN-SILVA A L, ALMEIDA SS.Early postnatal p rotein malnutrition af fects learning and memory in the distal but not in the proximal cue version of the Morris water maze[J].Behavioural Brain Research,2002, 133:271-277.
[2] AGU ILERA A,AUX ILIADORA-BAJO M,ESPINOZA M,et al.Gastrointestinal and pancreatic function in peritoneal dialysis patients:their relationship w ith malnutrition and peritonealmembrane abnorm alities[J].American Journal o f Kidney Diseases,2003,42:787-796.
[3] NEU J.Gastrointestinal development and meeting the nutritional needs of prem ature in fants[J].A-merican Journal of Clinical Nutrition,2007,85: 629-634.
[4] HALLIWELL B,GUTTERIDGE JM C.Free radicals in biology and medicine[M].New York:Oxford University Press,1999.
[5] MACKAY W J,BEW LEY G C.The genetics of catalase inDrosophila melanogaster:isolation and characterization of acatalasem ic mutants[J].Genetics Society o f America,1989,122(3):643-652.
[6] PARKES T L,H ILLIKER A J,PH ILLIPS JP.Genetic and biochem ical analysis of glutathione-S-transferase in theoxygen de fense system o f drosophilamelanogaster[J].Genome,1993,36(6):1007-1014.
[7] MEISTER A.Glutathione deficiency produced by inhibition of its synthesis and its reversal:app lications in research and therapy[J].Pharmaco logy& Therapeutics,1991,51:155-194.
[8] OGASAWARA T,OHNHAUS E E,HOENSCH H P.G lutathione and its re lated enzym es in the sm all intestinalmucosa o f rats:ef fec ts of starvation and diet[J].Research in Experim ental Medicine,1989, 189:195-204.
[9] W ANG J L,STONER G D,BRAY T M.D ietary supplementation with cysteine p rod rugs selec tively restores tissue glutathione leve ls and redox status in protein-malnourished m ice(1)[J].The Journal of Nutritional Biochem istry,2002,13:625-633.
[10] MARKS D B,MARKS A D,SM ITH C M.Basic medical biochem istry:a clinical approach[M].New York:LippincottW illiams&W ilkins,1996.
[11] BAI C,JONESD P.GSH transport and GSH-dependen t detoxication in small intestine of rats exposedin vivoto h ypoxia[J].American Journal of Physiology,1996,271:701-706.
[12] ZIEGLER T R,ALMAHFOUZ A,PEDRINIM T, etal.A comparison of rat small intestine insulin and insulin-like grow th fac torⅠrecep tors during fasting and refeeding[J].Endocrinology,1995,136: 5148-5154.
[13] MATÉS J M,PÉREZ-GÓMEZ C,NU'ÑEZ DE CASTRO I.Antioxidant enzymes and human disea-ses[J].Clinical Biochem istry,1999,32(8):595-603.
[14] LAMBETH JD.NOX enzymes and the biology of reactive oxygen[J].Nature Reviews Immuno logy, 2004,4(3):181-189.
[15] GHOSH J,MYERSC E.Inh ibition o f arachidonate 5-lipoxygenase triggers m assive apoptosis in human prostate cancer cells[J].Proceedings o f the National A cademy o f Sciences o f the United States o f A-m erica,1998,95(22):13182-13187.
[16] 尹光耀,尹玉芬,何雪芬,等.驻春丸对肾阳虚老年人免疫与内分泌功能的影响[J].中国中西医结合杂志, 1995,15(10):601-603.
[17] BAE Y S,KANG SW,SEO M S,et al.Epiderm al grow th factor(EGF)-induced generation of hydrogen peroxide.Role in EGF receptor-mediated tyrosine phosphorylation[J].The Journal of Biological Chem istry,1997,272(1):217-221.
[18] LEE Y J,GALOFORO S S,BERNS C M,et al. G lucose deprivation induced cytotoxicity and alterations in m itogen-activated p rotein kinase activation are mediated by oxidative stress in multidrug-resistant human breastcarcinom a cells[J].The Journalof Biological Chem istry,1998,273(9):5294-5299.
[19] 方允中,杨胜,伍国耀.自由基、抗氧化剂、营养素与健康的关系[J].营养学报,2003,25(4):337-341.
[20] 蔡晓波,陆伦根.谷胱甘肽过氧化物酶与肝脏疾病[J].世界华人消化杂志,2009,17(32):3279-3282.
[21] FANG Z Y,YANG S,W U G Y.Free radical,antioxidants,and nutrition[J].Nutrition,2002,18 (10):872-829.
[22] JONAS K C,ESTIVARIZ C F,JONES D P,et al. Keratinocyte grow th factor enhances glutathione redox state in rat intestinalmucosa during nutritional depletion[J].The Journal o f Nutrition,1999,127: 1278-1280.
[23] 于晓明,王永辉,李培兵,等.蛋白质对改善半饥饿大鼠肠黏膜抗氧化功能的作用[J].肠外与肠内营养, 2007,14(3):141-143.
[24] 陈群,于维,于秀芳,等.氧化应激对离体大鼠小肠上皮细胞的损伤及抗氧化研究[J].河北农业大学学报, 2009,32(6):101-104.
[25] 王立新,林三仁.抗氧化剂与胃黏膜保护[J].当代医学,2000,6(4):15-18.
[26] 白爱平.炎症性肠病发病机制的微生物因素[J].世界华人消化杂志,2006,14(7):645-649.
[27] 黎君友,盛志勇,吕艺,等.严重创伤后肠屏障功能损伤及谷氨酰胺的保护[J].世界华人杂志,2000,8 (10):1093-1096.
[28] 陈群,乐国伟,施用辉,等.氧自由基对动物消化道损伤及干预研究进展[J].中国畜牧兽医,2006,33(11): 106-108.
*Correspond ing au thor,ZHANG Enp ing,professor,E-m ail:zep126@126.com;SUN Zhihong,assistan t professor,E-mail:sunzh2002cn @yahoo.com.cn
(编辑 菅景颖)
