一株产紫杉醇内生真菌的分离及其代谢产物的研究
2010-04-06卢陆洋秦竹徐金库李新松
卢陆洋,秦竹,徐金库,李新松
一株产紫杉醇内生真菌的分离及其代谢产物的研究
卢陆洋,秦竹,徐金库,李新松
【摘要】
目的从南方红豆杉(Taxus chinensis var. mairei)中分离产紫杉醇内生真菌,并研究其抗肿瘤细胞活性。
方法采用组织块法从南方红豆杉的树根部、树主干内层、侧枝及针叶分离纯化内生真菌,经液体发酵培养,抽提发酵粗产物,以标准紫杉醇为对照进行薄层层析(TLC)、紫外光谱(UV)、HPLC、质谱(MS)分析。同时将经上述方法确认后的内生真菌产的紫杉醇作用于人宫颈癌 HeLa 细胞,采用 MTT 法分析其抗肿瘤细胞活性。
结果从南方红豆杉主干韧皮部分离得到 1 株产紫杉醇内生真菌 D62,其紫杉醇产量为 148.95 μg/L。对菌株 D62 的菌落和菌丝体的形态学分析表明其属于镰刀属(Fusarium sp.)。将该菌株产紫杉醇作用于 HeLa 细胞,表现出明显的致细胞凋亡作用。
结论南方红豆杉中分离得到的产紫杉醇内生真菌 D62具有优良的发酵特性。
【关键词】抗肿瘤药,植物; 真菌; 发酵; 红豆杉属
www.cmbp.net.cn 中国医药生物技术, 2010, 5(3):202-207
紫杉醇(Paclitaxel,商品名 Taxol) 是复杂的二萜类衍生物,最早于 1971 年由 Wani 等[1]从短叶红豆杉(Taxus breviifolia Nutt.)的树皮中分离,具有独特的催化微管蛋白迅速合成微管作用,并可与微管结合,防止微管解聚[2]。紫杉醇对卵巢癌、乳腺癌等,尤其对耐常规药物的肿瘤有较好的疗效,被美国肿瘤研究所认为是人类未来 20 年最有效的抗癌药物之一。
目前,紫杉醇主要从红豆杉的树皮中提取。由于红豆杉生长周期长,资源缺乏,且天然红豆杉在世界范围内数量很少,而树皮中紫杉醇含量仅为干重的 0.01% ~ 0.03%,仅仅从树皮中提取紫杉醇无法满足市场需求,造成了紫杉醇市场价格昂贵的同时,也严重破坏了自然资源[3]。为此,国内外学者不断研究生产紫杉醇的其他方法,包括紫杉醇的化学全合成和半合成,红豆杉愈伤组织培养和细胞悬浮培养等[4-6]。然而因为这些方法成本高、产率低,目前还无法应用于工业生产。
1993 年,Stierle 等[7]首次报道短叶红豆杉中分离出了可产紫杉醇的内生真菌 Taxomyces andreanae,这为生产紫杉醇提供了潜在新途径。内生真菌生长迅速,培养基成本相对较低,菌种易于改良,可以大幅度提高紫杉醇产量,同时也能保护红豆杉资源,维持生态平衡。此后,国内外研究者相继报道了从不同的红豆杉种类中分离出不同的产紫杉醇内生真菌[8-11]。为了拓展红豆杉内生真菌的种群资源,寻找发酵法生产紫杉醇更有效的潜在途径,本研究以南方红豆杉(Taxus chinensis var. mairei)为材料,从其中分离纯化内生真菌,并通过薄层层析(TLC)、紫外光谱(UV)、HPLC、质谱(MS)对其代谢产物进行分析,以确定其是否为紫杉醇,同时分析紫杉醇的抗肿瘤细胞活性。
1 材料与方法
1.1 材料
1.1.1 样品采集 南方红豆杉采集于江苏省紫金山,按照不同方位(向阳面和背阳面)随机选取树根部、树主干内层、侧枝及针叶,装入灭菌纸袋内编号备用。
1.1.2 培养基配置 马铃薯葡萄糖琼脂培养基(PDA)、马铃薯葡萄糖液体培养基(PDB)[12]以及发酵培养基(S-7)[7]参照文献配制;HeLa 细胞培养基:DMEM 培养基(含 10% 胎牛血清以及100 μg/ml 青霉素和 100 μg/ml 链霉素)。
1.1.3 主要试剂和仪器 HeLa 细胞由东南大学生物材料和药物释放实验室提供;紫杉醇标准品购自阿拉丁试剂(中国)有限公司,纯度 > 99.0%(HPLC);甲醇为色谱纯,其余试剂为分析纯,均购自国药集团上海化学试剂厂。Heλios γ 紫外分光光度计为美国热电公司产品;Agilent-1100 高效液相色谱仪为美国 Agilent 公司产品;Agilent-1100 LC/MSD 液质联用仪为美国 Agilent 公司产品;Bio-Rad Model 680 酶标仪为美国伯乐公司产品。
1.2 方法
1.2.1 样品预处理 用无菌水洗净南方红豆杉表面,无菌刀剥去外皮,取内皮和韧皮部,同时剪成0.5 cm × 0.5 cm 的小块,叶剪去外缘后切成 0.5 cm的小段,然后分别用 75% 乙醇浸泡 5 ~ 10 min 表面消毒,再用无菌水冲洗样品 5 min 去除表面消毒剂。
1.2.2 内生真菌分离和纯化 经过预处理的材料分别接种于 PDA 固体培养基上,使材料完全紧贴培养基,25 ℃ 培养,待新菌落长出后,用菌丝尖端纯化法[12]挑取不同形态菌丝,接种于新鲜PDA 培养基上,如此反复纯化多次,得到纯化菌株,并移至 PDA 斜面培养基上,于 4 ℃ 冰箱中保存备用。
1.2.3 发酵培养和产物提取 取上述保存的内生菌株,转接于 PDA 固体培养基上,25 ℃ 活化3 d,然后转入 250 ml 三角瓶中(含 PDA 液体培养基 50 ml)作为种子培养基,25 ℃、150 r/min 培养 3 d。以 5%(v/v)接种量转入 500 ml 三角瓶中(含 S-7 发酵培养基 200 ml),25 ℃、150 r/min发酵培养 14 d。发酵结束后真空抽滤,分别收集滤液和菌丝体。滤液用等体积的二氯甲烷萃取 3 次,合并上层有机相;菌丝体冻融后充分研磨,加入30 ml 乙酸乙酯,超声萃取 15 min,有机相与前述有机相合并,于旋转蒸发仪上 35 ℃ 去除有机溶剂,得到的萃取物溶于 1 ml 甲醇中,供检测用。
1.2.4 TLC 分析 将紫杉醇标准品溶于甲醇中配制成浓度为 1 mg/ml 的对照品。用点样毛细管将标准品和样品分别在硅胶板 GF254(5 cm × 20 cm)上点样。展层系统为 A,氯仿/甲醇(7∶l,v/v);B,二氯甲烷/甲醇 (20∶1,v/v),当前沿跑至距薄层板上端 1 cm 处时终止。254 nm 紫外灯下观察荧光。再用 1% 香草醛的浓硫酸喷雾显色,观察有无紫杉醇特征性蓝色斑点出现,并计算 Rf值。
1.2.5 UV 分析 层析结束后,在 254 nm 紫外灯下选取与标准紫杉醇有相同 Rf值的样品区域,将该区域硅胶沿展层方向小心刮取,用 1 ml 甲醇溶解,超声洗脱,经微孔滤膜过滤后得测定洗脱液。将上述标准液和样品液分别在 200 ~ 600 nm范围内紫外扫描,测其最大紫外吸收波长,并作对比。
1.2.6 HPLC 分析 将标准品和样品分别进行HPLC 分析。色谱条件:色谱柱为 Zorbax SB-C18(250 mm × 4.6 mm,5 μm);柱温为 30 ℃;流动相为甲醇/水(65∶35,v/v);紫外检测波长 227 nm,流速 1.0 ml/min,样品进样量 20 μl,标准品进样量 5 μl。
1.2.7 MS 分析 将标准品和样品分别进行 MS分析。质谱条件:检测模式是全范围扫描“Scan”模式,离子极性 Pos(正离子)、离子化方式 ESI、离子相对分子质量范围 50 ~ 1500、干燥气温度350 ℃、CID 电压 70 V。色谱柱为 SB-Aq(250 mm × 4.6 mm,5 μm);流动相甲醇/水(70∶30,v/v),流速:0.3 ml/min,柱温:30 ℃。
1.2.8 发酵粗提物的抗肿瘤细胞活性检测 以HeLa 细胞为实验用癌细胞,采用体外细胞毒性测定的 MTT 法[13]检测内生真菌发酵粗提物是否具有抗肿瘤细胞活性。培养好的 HeLa 细胞用内含 10% 胎牛血清的 DMEM 培养基制成单细胞悬浮液,计数后接种至 96 孔板,5 × 103个细胞/100 μl/孔,37 ℃,5% CO2条件下培养。24 h 后吸弃上清液,加入含不同终浓度粗提物(待测的粗提物溶于甲醇中,1 mg/ml,用 DMEM 培养基依次做 1∶100,1∶200,1∶500 浓度稀释)的培养基 100 μl/孔,每个浓度设置 6 个重复孔。同时以添加相同浓度标准紫杉醇的培养基为阳性对照,以完全培养基为阴性对照,并且设置添加相同浓度甲醇的培养基,观察甲醇对 HeLa 细胞的影响。24、48、72 h 后分别加入 5 mg/ml 的 MTT 溶液20 μl,37 ℃ 反应 4 h 后终止培养,小心吸去孔内培养液,加入 150 μl 二甲基亚砜。置摇床上低速振荡 10 min,使结晶物充分溶解。在酶联免疫检测仪吸光度(OD490nm)值处测量各孔的吸光值。按下列公式计算内生真菌粗提物对 HeLa 细胞的抑制率:
抑制率 =(对照组 OD 值 - 实验组 OD 值)/对照组 OD 值 × 100%
1.2.9 内生真菌的分类 根据所分离的内生真菌的形态学特点,包括菌落的生长速度、菌丝体以及孢子的特征、分泌色素等,参照丝状真菌的分类鉴定方法[14]将上述真菌菌株鉴定到适当的属。
2 结果
2.1 菌种成功分离
获得了 91 株单一的丝状真菌。其主要分离部位为韧皮部,因植物材料表面严格消毒并无菌操作,故上述纯化菌株均可确认为是南方红豆杉的内生真菌。
2.2 TLC
TLC 初步分析结果见表 1,4 株菌株的发酵提取物与标准紫杉醇 Rf值相同或相似处出现一特异性蓝色斑点,且 24 h 后蓝色斑点转灰。试验结果初步表明,这些菌株可能分泌紫杉醇或紫杉烷类化合物。
2.3 UV
如图 1,标准紫杉醇在 273 nm 处有最大吸收波长,而与之基本相同的是菌株 D62 的发酵纯化产物也显示在 273 nm 处有最大吸收波长。

表 1 菌株发酵提取物的薄层层析结果Table 1 Thin-layer chromatography analysis of taxol excreted by endophytic fungal

图 1 菌株 D62 发酵液提取物(A)与标准紫杉醇(B)的最大紫外吸收图Figure 1 UV absorption spectrum of fungal extract (A) and authentic taxol (B)
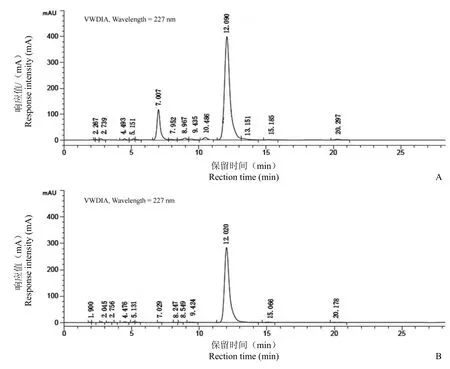
图 2 HPLC 检测菌株D62 发酵液提取物(A)与标准品紫杉醇(B)图谱Figure 2 HPLC analysis of fungal extract (A) and authentic taxol (B)
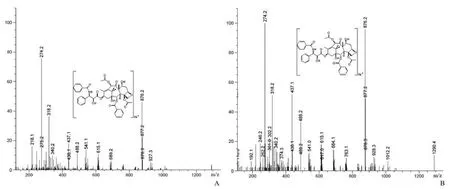
图 3 MS 检测菌株 D62 发酵液提取物(A)与标准品紫杉醇(B)的图谱Figure 3 MS analysis of fungal extract (A) and authtic taxol (B)
2.4 HPLC
HPLC 分析结果显示(图 2),标准紫杉醇的保留时间在 12.02 min,而与之相似的是菌株 D62发酵纯化产物的保留时间在 12.09 min。由此可以进一步判断菌株 D62 发酵纯化产物与标准紫杉醇峰为同一物质。并可根据峰面积推算出其发酵液中紫杉醇含量为 148.95 μg/L。
2.5 MS
MS 扫描结果显示(图 3),菌株 D62 发酵纯化产物与标准紫杉醇都出现了特有的准分子离子峰(M + Na)+为 m/z 876.2,证明菌株 D62 发酵纯化产物确实含有紫杉醇。
2.6 内生真菌形态特征及分类
菌株 D62 的形态特征如图 4,菌株初期在PDA 培养基上生长较缓慢,培养 3 d 后菌落直径超过 2 cm,7 d 后达 5 ~ 6 cm;菌丝呈棉絮状至绒毛状,最初白色,后期逐渐变灰黑,菌丝老化,培养基反面暗绿色;菌丝有隔,分枝,透明,直径 1.5~ 3.5 μm。根据该菌株的形态学特征,经查阅相关文献[14],与镰刀孢属的分类特征相吻合。因此,菌株 D62 暂定为 Fusarium sp.。
2.7 体外抗肿瘤细胞活性
从图 5 可以看出,真菌产紫杉醇和标准紫杉醇均能高效抑制 HeLa 细胞生长,同时完全对照组和添加相同浓度甲醇的对照组中 HeLa 细胞生长良好。从图 6 中可以看出随着紫杉醇浓度以及作用时间增长,细胞抑制率也随之增长。当内生真菌D62 产紫杉醇浓度为 10 μg/ml时,与 HeLa 细胞作用24、48、72 h 后,其抑制率分别到达 17.8%、 64.6%、88.6%。而同浓度标准紫杉醇的抑制率分别为 24.8%、78.5%、93.4%。

图 4 D62 菌株的形态学特征 × 400(A:菌株 D62 在PDA 培养基上生长的菌落;B:菌丝体形态)Figure 4 Morphological observation of the fungus D62 × 400. A: Colonies of strain D62 on PDA medium; B: Mycelia.
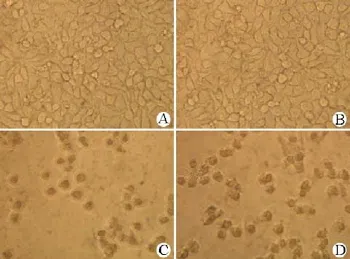
图 5 不同药物处理后的 HeLa 细胞系的生长情况 × 400(A:不添加药物;B:添加 5 μg/ml 的甲醇;C:添加 5 μg/ml的标准紫杉醇;D:添加 5 μg/ml 的真菌产紫杉醇)Figure 5 The microscope observation of the HeLa cells treated with drug. A: No addition; B: Add methanol, 5 μg/ml; C: Add authentic taxol, 5 μg/ml; D: Add fungal taxol, 5 μg/ml.
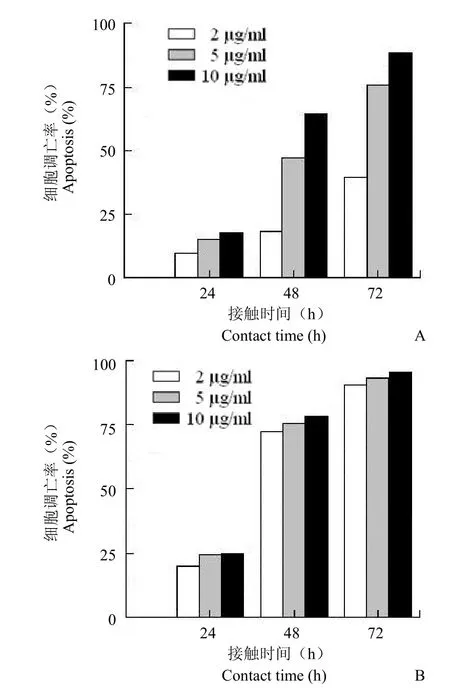
图 6 菌株 D62 产紫杉醇(A)与紫杉醇标准品(B)致HeLa 细胞的凋亡率Figure 6 Apoptosis rate of HeLa cells incubated with fungal taxol (A) compared with authentic taxol (B)
3 讨论
本文从南方红豆杉树中分离得到了 91 株纯化的内生真菌,发现菌株 D62 的发酵纯化产物含有紫杉醇,其液体发酵产量为 148.95 μg/L。对菌株D62 的菌落和菌丝体的形态学分析表明其属于镰刀属。另外本试验研究结果还表明,菌株 D62 发酵所得的紫杉醇对 HeLa 细胞生长具有明显的抑制作用,且与标准紫杉醇的抗 HeLa 细胞作用基本一致。
利用内生真菌发酵生产紫杉醇最大的问题是内生真菌中紫杉醇的含量低,同时内生真菌在多次传代后,生物特性退化,其代谢产物不稳定。一般来说,微生物发酵法工业化生产紫杉醇盈亏平衡点为 1 mg/L。而目前报道的内生真菌生产紫杉醇的初始量每升培养基从 24 ng ~ 276.76 μg 不等,距工业化生产还有一定差距[8-11]。目前已报道的内生真菌的发酵产量还比较低,通过分离筛选高产量的菌株,优化发酵条件,对菌株进行诱变育种等方式有望提高其产量,从而实现其工业化生产[15]。因此,利用微生物发酵生产紫杉醇具有潜在的应用前景和经济价值。 我们下一步工作将对筛选到的菌株D62 的发酵条件进行优化,并利用生物技术方法对菌株进行诱变选育,以期提高其紫杉醇的发酵产量。
参考文献
[1] Wani MC, Taylor HL, Wall ME, et al. Plant antitumor agents. VI. The isolation and structure of taxol, a novel antileukemic and antitumor agent from Taxus brevifolia. J Am Chem Soc, 1971, 93(9):2325-2327.
[2] Schiff PB, Fant J, Horwitz SB. Promotion of microtubule assembly in vitro by taxol. Nature, 1979, 277(5698):665-667.
[3] Stone R. Surprise! A fungus factory for taxol? Science, 1993, 260(5150):154-155.
[4] Holton RA, Somoza C, Kim HB, et al. First total synthesis of taxol. 1. Functionalization of the B ring. J Am Chem Soc, 1994, 116(4):1597-1599.
[5] Nicolaou KC, Yang Z, Liu JJ, et al. Total synthesis of taxol. Nature, 1994, 367(6464):630-634.
[6] Denis JN, Greene AE, Guenard D, et al. Highly efficient, practical approach to natural taxol. J Am Chem Soc, 1988, 110(17):5917-5919.
[7] Stierle A, Strobel G, Stierle D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew. Science, 1993, 260(5105):214-216.
[8] Qiu DY, Huang MJ, Fang XH, et al. Isolation of an endophytic fungus associated with Taxus yunnanensis et L.K.Fu. Acta Mycologica Sinica, 1994, 13(4):314-316. (in Chinese)邱德有, 黄美娟, 方晓华, 等. 一种云南红豆杉内生真菌的分离.真菌学报, 1994, 13(4):314-316.
[9] Wang J, Li G, Lu H, et al. Taxol from Tubercularia sp. strain TF5, an endophytic fungus of Taxus mairei. FEMS Microbiol Lett, 2000, 193(2):249-253.
[10] Zhou DP, Sun JQ, Yu HY, et al. Nodulisporium, a genus new to China. Mycosystema, 2001, 20(2): 277-278. (in Chinese)周东坡, 孙剑秋, 于寒颖, 等. 中国一新记录属——多节孢属. 菌物系统, 2001, 20(2):277-278.
[11] Ma YC, Zhao K, Wang SW, et al. Biological diversity of Taxol-producing endophytic Fungi. J Fungal Res, 2003, 1(1):28-32. (in Chinses)马玉超, 赵凯, 王世伟, 等. 产紫杉醇(Taxol)内生真菌的生物多样性. 菌物研究, 2003, 1(1):28-32.
[12] Shen P, Fan XR, Li GW. Experiment of Microbiology. 3rd. Beijing: Higher Education Press, 1999. (in Chinese)沈萍, 范秀容, 李广武. 微生物学实验. 3版. 北京: 高等教育出版社, 1999.
[13] Chen RM. Animal tissue culture technology and its applications. Beijing: Science Press, 1991. (in Chinese)陈瑞铭. 动物组织培养技术及其应用. 北京: 科学出版社, 1991.
[14] Wei JC. Handbook to Identification of Fungi. Shanghai: Shanghai Scientific & Technical Publishers, 1979. (in Chinese)魏景超. 真菌鉴定手册. 上海: 上海科学技术出版社, 1979.
[15] Zhao K, Ping WX, Ma X, et al. Breeding of high-yield strain of taxol by mutagensis of protoplast and primary discussion of genetic differences between mutants and their parent strain. Acta Microbiol Sinica, 2005, 45(3):355-358. (in Chinese)赵凯, 平文祥, 马玺, 等. 紫杉醇高产菌株的原生质体诱变选育及其遗传变异初探. 微生物学报, 2005, 45(3):355-358.
ObjectiveTo isolated from producing endophytic fungi of Taxus chinensis var. mairei, and study its anti-tumor activity.
MethodsThe hyphal tips, which grew out from the tissue of Taxus chinensis var. mairei were isolated and transferred to potato dextrose agar (PDA). Then the purified endophytic fungal strains were fermented. The presence of taxol in the fungal extract was confirmed by thin-layer chromatography (TLC), ultraviolet spectrophotometry (UV), high performance liquid chromatography (HPLC) and mass spectrometry (MS) by comparison with taxol standard. The anti-tumor activity of the fungal taxol was detected by Methyl Thiazolyl Tetrazolium (MTT) method with HeLa cells.
ResultsStrain D62, an isolated endophytic fungus from the phloem of the Taxus chinensis var. mairei, was observed to produce taxol, when grown in semi-synthetic liquid media. The amount of taxol produced by this endophytic fungus was 148.95 μg/L determined by HPLC. The fungus was identified as a Fusarium sp. according to the morphology of the fungal culture and the characteristics of the colony. The fungal taxol extracted also showed a strong cytotoxic activity in the in vitro culture of HeLa cells tested by an apoptotic assay.
ConclusionStrain D62, a taxol-producing endophytic fungus isolated from Taxus chinensis var. mairei, can serve as a potential material for fungal fermentation to improve taxol production.
【Key words】Antineoplasstic agents, phytogenic; Fungi; Fermentation; Taxol
Author Affiliation: Biomaterials and Drug Delivery Laboratories, School of Chemistry and Chemical Engineering, Southeast University, Nanjing 211189, China
Correspongding Author:LI Xin-song, Email: lixs@seu.edu.cn www.cmbp.net.cn
Chin Med Biotechnol, 2010, 5(3):202-207
作者单位:210018 南京,东南大学化学化工学院生物材料和药物释放实验室
通讯作者:李新松,Email:lixs@seu.edu.cn
收稿日期:2009-12-01
DOI:10.3969/cmba.j.issn.1673-713X.2010.03.008
Production of taxol by an endophytic fungus isolated from Taxus chinensis var. mairei
LU Lu-yang, QIN Zhu, XU Jin-ku, LI Xin-song
【Abstract】
