秸秆糖化复合菌系的筛选方法及糖化效果评价
2010-03-24徐诚蛟王爱杰
刘 冰,徐诚蛟,王爱杰
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,哈尔滨150090,waj0578@hit.edu.cn; 2.沈阳农业大学土地与环境学院,沈阳110866;3.东北农业大学资源与环境学院,哈尔滨150030)
从19世纪70年代的石油危机开始,利用有机废物产生生物质能被认为是一个重要的产能途径[1].我国是农业大国,每年产生大量纤维素类的农业废弃物,利用生物手段将其转化为高附加值的生物质能成为研究热点[2].其中,降解纤维素产糖是这项研究的核心内容之一[3-5].在人们追求糖产量的同时,如何能更准确的将产出的糖量测定出来成为一个热点问题.由于在复合菌系内,微生物对还原糖利用的瞬时性,通过测定反应体系中残留的还原糖量,很难准确的评价其糖化能力.本试验采用分室同步糖化发酵产氢的培养模式,将从高温堆肥中筛选得到降解水稻秸秆的复合菌系,与实验室原有只能代谢单糖高产氢菌株YUAN-3(Ethanoligenens harbinense)[6]分室同步糖化发酵培养,以单独利用葡萄糖为底物发酵时,产生氢气与所消耗葡萄糖的比例关系为对照,研究同步培养时复合菌系降解秸秆产生还原糖的能力,从而对厌氧纤维素降解菌系生物糖化效果进行评估.
1 材料与方法
1.1 菌种来源与培养基配制
复合菌系分离样品取自高温牛粪堆肥.实验室原有菌株YUAN-3(E.harbinense),该菌株有较强的产氢能力,同时又具备自凝集特性,该菌仅能利用单糖产氢.试验所需培养基分别为:秸秆培养基(L-1):NH4Cl 1.0 g,K2HPO43.5 g,KH2PO41.5 g,MgCl20.5 g,NaCl 1.0 g,KCl 0.2 g,半胱氨酸0.5 g,蛋白胨2.0 g,酵母粉2.0 g,秸秆 5 g,维生素液[7]5 mL,微量元素溶液[7]1 mL,刃天青1.5 mg,pH 7.0.YUAN-3培养基[8].滤纸液体培养基[9-10].将各种培养基分装于血清瓶内,全过程在氮气的保护下进行,121℃,20 min高压灭菌.
1.2 产糖复合菌系的富集与筛选
1.2.1 复合菌系的富集
取高温堆肥样品10 g,在氮气保护下,投入装有数颗玻璃珠的无氧无菌水中,在振荡器中振荡1 h,利用玻璃珠剪切力将堆肥样品粉碎,使微生物菌体充分分散于体系中.再将混合体系接种于秸秆培养基中,接种量10%,35℃静止富集培养10 d,连续转接两次,使降解纤维素菌株大量富集.
1.2.2 秸秆降解效果
采用滤纸崩解法.将富集得到的菌群接入到滤纸培养基中培养,滤纸在配制培养基前需烘干恒重后称重,接种量为10%,35℃、120 r/min振荡培养,7~10 d后,烘干称重,测量滤纸的崩解情况.反复转接3次,比较滤纸崩解的效果.
1.2.3 连续稀释转接筛选高产糖复合菌系
将筛选得到的利用滤纸效果好的菌系用无菌水进行梯度稀释,取稀释度为10-3~10-9的溶液分别接种到水稻秸秆培养基中,35℃培养箱培养.每隔24 h小时取样,采用DNS比色法[11-12]测定还原糖量.总结数据,当还原糖量升高,及时将该稀释度培养体系再度稀释至10-3~10-9,分别接入到新鲜秸秆培养基中液体培养,如此连续稀释以得到高产糖复合菌系.
1.3 产糖效果评价方法及装置
为更好的研究降解纤维素复合菌系的产糖效果,将其与已知菌株YUAN-3进行分室同步糖化发酵,根据复合菌系与YUAN-3分别培养时,产生单位体积H2时的底物利用率,研究分室同步培养条件下复合菌系的产糖效果.将筛选得到产糖效果较好的复合菌系接种于如图1所示反应器的A室,B室接种YUAN-3,A、B两室以0.45 μm细菌滤膜分隔,单室容积32 mL,装液量80%,以添加于A室的水稻秸秆段为惟一碳源,流加无碳源培养液,采用单批培养方法,以分别单室培养为对照,测定反应器A、B室及对照产氢量变化规律,对照的葡萄糖消耗量,反应体系内还原糖含量残留量.氢气测定、发酵液相末端代谢产物的测定采用美国安捷伦7890型气相色谱仪测定.色谱柱:TDX-02;柱温:100℃;汽化室:80℃;检测器100℃.
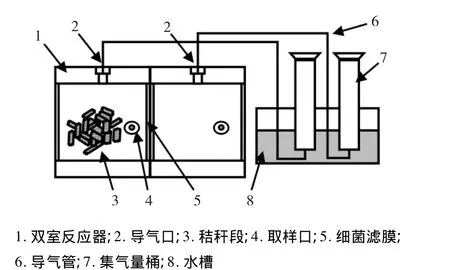
图1 双室反应器装置简图
1.4 复合菌系糖化能力计算与秸秆降解率测定
分别测定复合菌系和YUAN-3在单室反应器中,累积产氢量与葡萄糖消耗量,并根据两者的比例关系拟合成回归曲线方程.再将双室反应器中复合菌系和YUAN-3的产氢量分别代入方程,求得不同时间产生一定体积的氢气,所需消耗的还原糖量,以此来表述复合菌系降解秸秆的产糖效果.秸秆降解率=(原始秸秆质量-残留秸秆质量)/原始秸秆质量×100%.
2 结果与讨论
2.1 复合菌系的富集结果
富集得到的复合菌系JY在水稻秸秆培养基中能够生长,说明具有降解纤维素能力.分别观察其在滤纸培养基中培养7,9,11 d后的滤纸崩解程度,通过培养观察得到,图2中复合菌系JY在第11天能将滤纸完全降解成糊状,说明其具有较好利用纤维素底物的能力.

图2 滤纸崩解效果
2.2 筛选到的复合菌系及其产糖效果
将复合菌系 JY进行梯度稀释后接种于50 mL秸秆培养基,每天测定反应体系内还原糖产量,当产糖量升高时,说明利用秸秆的厌氧产糖微生物活跃,及时稀释转接,如此反复,从而得到产糖量较高的复合菌系.从表1看出,在稀释培养后的第2天,所有稀释度还原糖量均有所下降,下降最快为JY6(JY稀释为10-6),而在第3天其还原糖量又迅速上升,达到0.088 5 mg/mL.此时将JY6再进行梯度稀释转接,转接后的第2天,JY66(JY6稀释为10-6)还原糖含量迅速上升达到0.148 6 mg/mL.再将JY66再进行梯度稀释,同样在转接后的第2天,JY665(JY66稀释为10-5)的还原糖含量上升达到最高值0.165 6 mg/mL,而后还原糖量开始下降.由此可见,通过测定还原糖量并及时稀释转接,可以将复合菌系的微生物结构向产糖微生物更活跃,产糖效率更高的方向驯化.得到一个降解纤维素产糖能力较强的菌系,并且产糖量会在接种后的第2天达到最大值.结果还表明,稀释度10-5或10-6对复合菌系内的产糖类群具有较好的分离度,即产糖微生物类群占所在菌系的比例较高,而随时间推移,产生的还原糖很快会被其它微生物类群利用,还原糖含量随即下降.
2.3 复合菌系的产糖效果评价
利用DNS法只能测得体系中残留的少量还原糖,无法反应菌系降解秸秆过程中,产生还原糖的量和变化动态.本研究利用同步分室培养的方法,利用反应器中氢产量来推算菌系降解秸秆产糖能力.
将产糖效果较好的复合菌系JY665接种于双室反应器A室,将菌株YUAN-3接种于B室,以利用单室反应器分别培养JY菌系和YUAN-3作为对照,35℃下振荡培养80 h.将JY复合菌系和YUNA-3对照产氢体积(ml)对消耗葡萄糖的质量(g)拟合方程,分别为Y=-0.000 5x2+ 0.012 1x+0.011 3(R2=0.934 3)和Y=-0.000 07x2+ 0.006 4x+0.001 3(R2=0.999 6),且拟合度较高(如图3).
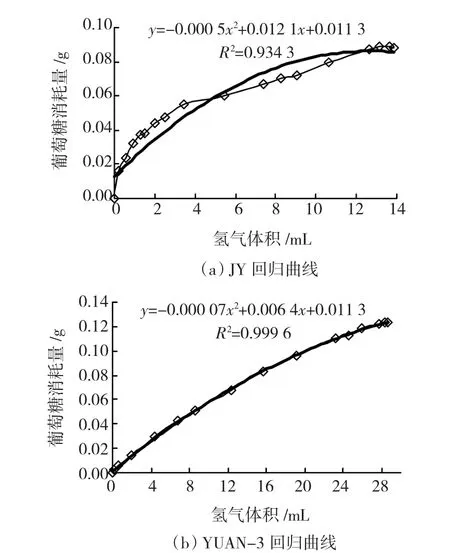
图3 产氢量对葡萄消耗量拟合曲线

图4 反应器产氢气变化动态
双室反应器JY复合菌系和YUAN-3,80 h累积产氢气量如图所示,80 h时产气累积量达到最大值分别为9.45 mL和14.40 mL.其中JY复合菌系产气量稳步上升,而YUAN-3则呈波动上升,可能是由于还原糖透过细菌滤膜时不均匀扩散造成的.YUAN-3的产氢起始时间为20 h,而JY复合菌系为32 h,说明由于JY的菌系复杂性使还原糖被消耗而产氢起始时间滞后.将反应器双室所产生氢气量(图4)代入JY复合菌系和YUNA-3对照的回归曲线方程,得到反应体系内还原糖消耗量的变化值,并与利用DNS法测得的反应器残留还原糖值进行对比.
结果(图5)表明,JY复合菌系和YUAN-3在发酵过程中所消耗的还原糖量在不断升高,在80 h时达到最大值,分别为0.081 0 g和0.083 8 g,总还原糖消耗量达到了0.164 8 g.水稻秸秆添加量为0.320 0 g,培养结束后水稻秸秆残留为0.124 6 g,据此JY复合菌系,产糖能力达到0.515 0g/g秸秆,秸秆降解率达到61.06%.

图5 反应器产生及残留还原糖量
同时,利用DNS法测定了反应体系中的残留的还原糖量,反应器内JY复合菌系和YUAN-3还原糖含量均较低,最高值也分别只有3.310 mg和3.005 mg,且动态变化并不规律.结果表明,在秸秆降解的过程中,可能还原糖在产生后便被及时利用,很难在反应体系发现糖的残留.由此可见,以产生一定体积氢气所消耗的葡萄糖量,来表述复合菌系降解秸秆产生的还原糖量是可行和有效的.
3 结论
1)利用连续稀释转接法,筛选得到能够降解水稻秸秆产糖的复合菌系JY665,该菌系35℃条件下降解纤维素产糖效果较好.将所得菌系JY665与产氢菌YUAN-3分室同步糖化培养,以单独培养时氢气产量对还原糖消耗量拟合曲线方程,代入反应器产氢量得到复合菌系产糖能力达到0.515 0 g/g秸秆,秸秆降解率达到61.06%.
2)通过拟合产氢体积与消耗葡萄糖量之间的曲线方程,采用分室同步糖化发酵法,以反应体系产氢量推知降解秸秆产生还原糖量,建立了一套关于复合菌系产糖能力的间接评价方法,并验证了该方法的可行性.
[1]DEBABRATA D,NEJAT T V.Hydrogen production by biological processes:a survey of literature[J].Int J Hydrogen Energy,2001,26:13-28.
[2]黄宁珍,赵志国,何成新,等.一组降解纤维素细菌的分离筛选及产酶特性研究[J].广西植物,2009,29 (5):683-688.
[3]BALLESTEROS I,OLIVA J M,NEGRO M J,et al.Enzymic hydrolysis of steam exploded herbaceous agricultural waste(Brassica carinata)at different particule sizes[J].Process Biochem,2002,38:187-192.
[4]CHEN Hongzhang,LIU Liying,YANG Xuexia,et al. New process of maize stalk amination treatment by steam explosion[J].Biomass Bioenergy,2005,28(4):411-417.
[5]LI Dongmin,CHEN Hongzhang.Biological hydrogen production from steam-exploded strawby simultaneous saccharification and fermentation[J].International Journal of Hydrogen Energy,2007,32:1742-1748.
[6]XING Defeng,REN Nanqi,LI Qiubo,et al.Ethanoligenens harbinense gennov,spnov,isolated from molasses wastewater[J].Int J Syst Evol Microbiol,2006,56:755-760.
[7]BALCH W E,FOX G E,MAGRUM I,et al.Methanogens:reevaluation of aunique biological group[J].Mierobiolog and Molecular Biology Reviews,1979,43(2): 260-296.
[8]REN Nanqi,XIE Tianhui,XING Defeng.Composition of extracellular polymeric substances influences the autoaggregation capability of hydrogen-producing bacterium Ethanoligenens harbinense[J].Bioresource Technology,2009,100:5109-5113.
[9]刘东波,陈珊,李凡,等.一种新的评价好氧性细菌降解天然纤维素能力的方法[J].东北师大学报,2009,41(3):114-117.
[10]张建强,王艳坤,李勇.纤维素高效降解混合菌的筛选及其发酵条件[J].西南交通大学学报,2008,43 (4):549-554.
[11]赵凯,许鹏举,谷广烨.3,5—二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8): 534-536..
[12]王俊刚,张树珍,杨本鹏,等.3,5-二硝基水杨酸(DNS)法测定甘蔗茎节总糖和还原糖含量[J].甘蔗糖业,2008,5:45-49.
