罗非鱼酶解液中挥发性成分分析
2010-03-23曾绍东吴建中欧仕益
曾绍东,吴建中,欧仕益*,金 君
(暨南大学理工学院食品科学与工程系,广东 广州 510632)
罗非鱼酶解液中挥发性成分分析
曾绍东,吴建中,欧仕益*,金 君
(暨南大学理工学院食品科学与工程系,广东 广州 510632)
采用顶空-固相微萃取(HS-SPME)技术结合气相色谱-质谱联用(GC-MS)对罗非鱼蛋白酶酶解液中挥发性成分进行研究,优化顶空固相微萃取的条件,并对挥发性成分进行鉴定和分析。结果表明最佳萃取条件为样品中添加30g/100mL氯化钠,采用以聚二甲基硅氧烷/二乙烯基苯(PDMS/DVB)为涂层的萃取头在60℃条件下搅拌萃取40min。实验共鉴定出69种挥发性物质,其中与罗非鱼酶解液气味相关的成分主要是相对分子质量为80~200的C6~C9挥发性羰基化合物、醇类和含氮类物质,这些挥发性成分的协同作用构成了酶解液的特征风味。
罗非鱼;酶解液;挥发性成分;顶空-固相微萃取;气相色谱-质谱法
罗非鱼有“白肉三文鱼”之称,俗称非洲鲫鱼,隶属于鲈形目、鲈形亚目、丽鱼科、罗非鱼属。是联合国粮农组织向全世界推广的优良养殖鱼类之一,也是我国重要的淡水养殖种类和优势出口水产品种,预计2010年我国罗非鱼养殖产量将达167.5万吨[1]。罗非鱼蛋白酶解液中含有较丰富的多肽和氨基酸等营养物质[2-3],采用罗非鱼肉及其加工下脚料生产酶解液,能够丰富罗非鱼产品种类,提高其附加值。但由于酶解液中存在有鱼腥味、土腥味、脂肪味等异味,使得产品感官品质差,不易被消费者所接受,严重影响了相关加工制品的发展。因此,有必要通过分析和鉴定罗非鱼蛋白酶解液中存在的挥发性气味成分,改进罗非鱼肉及其下脚料酶解液的风味,提高其利用质量。
近几年国内对罗非鱼及其加工产品中挥发性成分进行了一系列研究,黄国宏等[4]采用乙醚萃取罗非鱼酶解液美拉德反应产物中挥发性成分,共鉴定出34种风味成分;陈胜军等[5]采用固相微萃取和气相色谱-质谱联用技术,研究液熏罗非鱼片和传统烟熏罗非鱼片中的风味成分,分别检测出33种和30种成分;胡世伟等[6]采用水蒸气蒸馏法提取出4种罗非鱼的挥发性成分,用气相色谱-质谱联用仪进行分离,鉴定出奥利亚罗非鱼和奥尼罗非鱼各26种,尼罗罗非鱼24种,吉富罗非鱼18种挥发性成分;曾少葵等[7]利用同时蒸馏萃取与气相色谱-质谱联用技术从罗非鱼皮明胶溶液中检出了33种挥发性
成分。
分析挥发性或半挥发性的物质通常需要通过液液萃取,蒸馏萃取等技术来浓缩分析物,这些技术通常需要较多的时间,消耗大量的溶剂等[8]。固相微萃取技术(solid phase microextration,SPME)是一种满足快速、无溶剂和兼容样品制备的吸附/脱附技术,通过利用微纤维萃取头表面少量的吸附剂从样品中分离和浓缩分析物,萃取后,纤维萃取头可以通过像注射器那样的手柄装置被转移到分析仪器中,对目标分析物进行分离和分析。这一技术集合了取样、萃取和进样,其检测限低、线性范围广、重复性好,是一种简单方便有效的分析方法,已在食品领域有广泛的应用[9-10]。本实验利用顶空固相微萃取技术萃取罗非鱼Alcalase蛋白酶酶解液中挥发性成分,优化顶空固相微萃取的萃取条件,并结合气相色谱-质谱联用法对挥发性成分进行分析鉴定,旨在为罗非鱼酶解液的风味改进和深入研究提供参考。
1 材料与方法
1.1 材料与试剂
新鲜尼罗罗非鱼(体质量250~400g) 暨南大学菜市场;Alcalase2.4L碱性蛋白酶 诺维信(中国)公司;氢氧化钠、氯化钠(均为分析纯) 广州市化学试剂厂。
1.2 仪器与设备
固相微萃取手动进样手柄、聚二甲基硅氧烷/二乙烯基苯涂层纤维萃取头(PDMS/DVB 65μm)、碳分子筛/聚二甲基硅氧烷涂层纤维萃取头(CAR/PDMS 75μm) 美国Supelco公司;7890/5975气相色谱-质联用仪 美国Agilent公司;pH计 上海精密科学仪器有限公司;恒温水浴锅 江苏金坛市宏华仪器厂;15mL带PTFE涂层硅橡胶垫螺口顶空瓶 德国CNW公司。
1.3 方法
1.3.1 酶解液制备方法
将鲜活罗非鱼,去内脏、鱼鳞、清洗,取鱼肉沥干并绞碎,置于-18℃冰箱中保存备用。取冷冻罗非鱼肉(蛋白质含量18.6%)室温25℃解冻,加水至料液比为1:3(g/g)匀浆,调至Alcalase蛋白酶酶解作用最适条件pH8.0、60℃,水浴保温20min,酶用量为3000U/g底物蛋白,加酶开始酶解,酶解过程中滴加1.0mol/L NaOH溶液保持pH值恒定,水解3h后沸水浴10min灭酶活,4000r/min离心15min,取上清液备用。
1.3.2 固相微萃取方法
固相微萃取萃取头在使用之前按照Supelco公司推荐条件进行老化处理:65μm PDMS/DVB 萃取头于250℃下老化30min;75μm CAR/PDMS 萃取头于300℃条件下老化60min。
移取7.0mL酶解液于15mL顶空瓶中,并添加一定量氯化钠,加入磁力搅拌子后立即旋盖封口并固定于磁力搅拌器上,以该磁力搅拌器的中速档(500~700r/min)搅拌,在设定温度下加热平衡20min后将SPME针管穿透隔垫插入顶空瓶中,调整并固定其在顶空瓶中的位置,推出已老化好的萃取头以顶空方式萃取一段时间,将萃取头缩回针管内并立即插入气相色谱进样口中,在250℃条件下解析10min后取出萃取装置,同时启动软件采集数据。
1.3.3 分析条件
1.3.3.1 色谱条件
色谱柱:HP-5MS毛细管柱(30m×0.25mm,0.25 μm);程序升温:柱初温35℃,保温1min,以4℃/ min升温至120℃,6℃/min升温至180℃,再以10℃/min升温至250℃,保持2min。进样口温度:250℃;载气:氦气,流速0.8mL/min;不分流模式进样。
1.3.3.2 质谱条件
电子轰击(EI)离子源;电子能量为70eV;离子源温度230℃;传输线温度250℃,四级杆温度150℃;质量扫描范围35~350(m/z)。
1.3.4 数据处理
样品完成GC-MS分析后,将采集到的质谱图通过GC-MSD化学工作站与NIST 08.L标准谱库检索,并参考有关文献资料分析,再结合保留时间、质谱、人工图谱解析等参数和方法确定挥发性成分的化学组成。按照峰面积归一化方法计算出各成分的相对含量。
2 结果与分析
2.1SPME萃取条件的优化
2.1.1 萃取头的选择
选择合适的萃取头是进行固相微萃取的第一步,目标分析物的化学性质决定了选用何种涂层的萃取头,本实验选用PDMS/DVB、CAR/PDMS两种不同涂层的萃取头,比较在相同条件下对罗非鱼酶解液中挥发性成分的萃取效果。发现酶解液中挥发性成分经PDMS/DVB萃取头萃取,气相色谱分离,共鉴定出69种成分,而经CAR/PDMS萃取头萃取,气相色谱分离只确认42种,这是由于与PDMS/DVB萃取头相比,CAR/PDMS萃取头更适合吸附小分子物质,而PDMS/DVB萃取头可以吸附分子质量较大的成分,萃取范围相对较宽。因此本实验选择PDMS/DVB涂层的纤维萃取头。
2.1.2 萃取温度的选择

图1 萃取温度对总峰面积的影响Fig.1 Effect of HS-SPME extraction temperature on total peak area of volatile components
从图1可以看出,随着萃取温度的升高,总峰面积出现一个先升后降的过程。这是因为温度升高会加速样品分子运动,促进挥发性成分的挥发,提高了顶空气相中分析物的浓度,有利于萃取头对目标物的吸附;但由于固相微萃取表面吸附过程为放热反应,萃取温度过高,会造成部分分析物与萃取头的亲和能力下降,使得其解析能力大于吸附能力从而导致吸附量下降,同时温度升高使顶空部分水蒸气浓度增加,影响了萃取头对目标物的吸附。在这些因素的综合影响下,60℃为最佳萃取温度。
2.1.3 萃取时间的选择
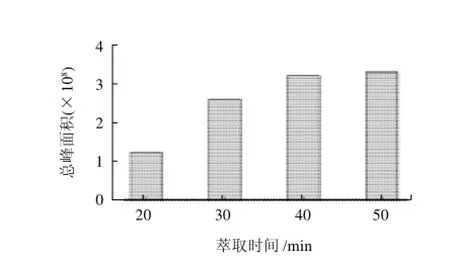
图2 萃取时间对总峰面积的影响Fig.2 Effect of length of HS-SPME extraction time on total peak area of volatile components
从图2可以看出,PDMS/DVB萃取头在温度60℃条件下,罗非鱼酶解液中挥发性成分的萃取量在萃取开始阶段增加较快,随着时间的延长逐渐趋于平缓,直到40min基本达到平衡,因此选择40min为最佳萃取时间。
2.1.4 氯化钠添加量的确定
样品中加入无机盐可以提高溶液中的离子强度,降低分析物的溶解度,提高样品液相和顶空气相之间的分配系数,从而可以增加萃取头固定相对分析成分的吸附。实验研究氯化钠添加量分别为0、10、20、30g/100mL对总峰面积的影响,结果见图3。从图3可以看出,加入氯化钠有利于提高色谱峰总峰面积,且随着氯化钠添加量的增加而升高。因此酶解液中氯化钠的最适添加量为30g/100mL。
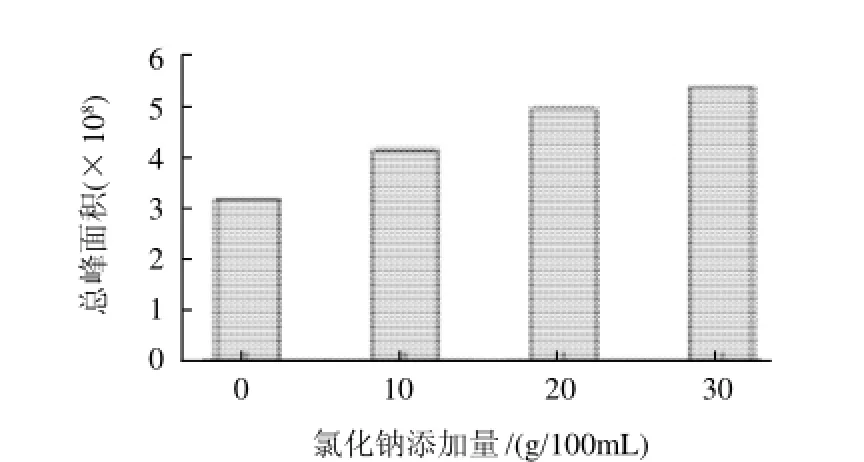
图3 氯化钠添加量对总峰面积的影响Fig.3 Effect of sodium chloride amount on total peak area of volatile components
2.1.5 搅拌对萃取效果的影响
样品搅拌可以促进萃取,缩短萃取时间。从图4可以看出,经搅拌样品的萃取效果明显优于不搅拌的样品。但搅拌速度不宜过大,过高的搅拌速度会使酶解液飞溅至萃取头,影响分析测定,降低萃取头的使用寿命。因此采用磁力搅拌器的中速500~700r/min进行萃取实验。
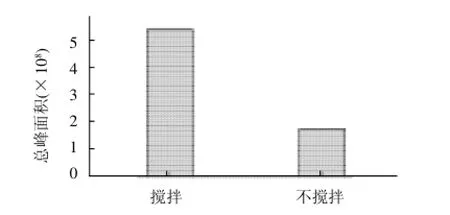
图4 搅拌对总峰面积的影响Fig.4 Effect of agitation on total peak area of volatile components
2.2 罗非鱼酶解液中挥发性成分的分析
罗非鱼酶解液中挥发性成分的GC-MS总离子流色谱图见图5,各成分按化合物结构进行分类,结果见表1。

图5 罗非鱼酶解液挥发性成分总离子流色谱图Fig.5 Total ion current chromatogram of volatile compounds in tilapia enzymatic hydrolyzates

表1 罗非鱼酶解液挥发性成分Table 1 Volatile compounds identified in tilapia enzymatic hydrolyzates

续表1
罗非鱼Alcalase蛋白酶酶解液中挥发性成分经PDMS/DVB萃取头萃取,气相色谱分离,共鉴定出69种成分。从表1可以看出,酶解液中挥发性成分大多是羰基化合物、醇类、含氮类物质,其中醛类19种、醇类13种、烃类12种、含氮类8种、酮类6种、含硫类2种以及其他化合物9种。
2.2.1 醛类化合物分析
醛类的相对含量最高,达到38.11%。其中以壬醛最高,为5.93%,其次是(E,E)-2,4-葵二烯醛、辛醛,分别为5.15%和3.75%。烷基醛、烯醛和二烯醛等成分是由饱和、不饱和脂肪酸氧化后形成的氢过氧化物的降解产物,这些醛类在烟熏鱼肉中起重要的作用,并且是各种氧化风味的来源[11-12]。部分短链饱和及不饱和醛,如(Z)-4-庚烯醛、2,4-庚二烯醛、(E)-2-辛烯醛,具有油脂味、清香或类瓜果香的气味, 2,4-庚二烯醛、(Z)-4-庚烯醛被认为是二十碳五烯酸(C20:5ω-3)(EPA)的氧化产物之一[13],而(Z)-4-庚烯醛与冷冻臭关系最为密切[14]。部分饱和的直链醛如庚醛、辛醛、壬醛、奎醛等通常带有油或蜡的令人不愉快的气味,正己醛则呈现出类似青草清香的气味,能产生一种原生、鲜香的特征香味,在多种鱼体内均有发现[15]。
2.2.2 醇类化合物分析
醇类占挥发性成分总量的24.42%,仅次于醛类物质。被检出的醇类化合物主要有1-辛醇、1-辛烯-3-醇、1-壬醇、1-庚醇、(Z)-2-辛烯-1-醇、苯甲醇、1-戊烯-3-醇等,其中1-辛醇的相对含量最高,达到了8.18%,其与1-辛烯-3-醇、(Z)-2-辛烯-1-醇等共同作用形成酶解液具有的金属味、蘑菇香和土腥味。Iglesias等[15]认
为1-辛烯-3-醇和1-戊烯-3-醇是15-脂氧合酶催化EPA(C20:5n-3)和12-脂氧合酶催化花生四烯酸的过程中形成的,是构成鱼腥味的重要成分之一。
2.2.3 烃类化合物分析
酶解液挥发性成分中烃类相对含量为13.68%,包括烷烃和烯烃,主要来源于脂肪酸烷氧自由基的裂解。挥发性成分中主要有环十二烷、1-甲基-2-亚甲基环己烷、(Z,Z)-1,3-环辛二烯等成分。各种烷烃广泛存在于鱼类的挥发性成分中,但它们的阈值较高,对风味的整体作用不大[17]。
2.2.4 含氮类化合物分析
含氮类物质占挥发性成分总量的9.92%,主要是吡嗪类和胺类物质。酶解液挥发性成分中吡嗪类相对含量为6.60%,可能是经美拉德和热解反应,通过Strecker反应生成的,其中2,5-二甲基吡嗪相对含量最高,为2.28%。吡嗪类由于其量大和低风味阈值一直被认为是许多热加工食品中的重要挥发性成分,使产品呈现出坚果香和烘烤香。氧化三甲胺在微生物和酶的作用下发生降解生成的产物三甲胺,与其他成分共同作用时能增强鱼腥味,主要用来评价水产品的新鲜度[18]。鱼体内蛋白质和脂质等在微生物的作用下产生的吲哚、2-戊基吡啶等具有不良风味,也会影响酶解液的气味。
2.2.5 含硫类化合物分析
酶解液挥发性成分中含硫类化合物的相对含量为3.31%,由于其阈值较低,对鱼肉及其加工产品风味有重要作用,一般认为是含硫氨基酸等在内源酶和微生物的作用下生成的,其中二甲基二硫醚具有令人不适的臭气味[13]。
2.2.6 其他成分分析
其他成分的相对含量为6.21%。其中2-戊基呋喃是一种典型的油脂氧化产物,具有果香、泥土清香[12],低分子量的酯类成分乙酸乙酯具有果香及芳香气味,可能是在乳酸菌作用下形成的[13],酶解液挥发性成分中的甲苯,对二甲苯这些物质的存在可能与罗非鱼生长的环境有关,而萘的来源还不清楚,可能是受到污染的影响[12],这些物质能引起酶解液的异味。
总体说来,与罗非鱼酶解液气味相关的化合物多为C6~C9羰基化合物、醇类、含氮类物质,且相对分子质量分布范围主要在80~200之间,所有这些挥发性成分的协同作用构成了罗非鱼酶解液特有的风味。
3 结 论
罗非鱼酶解液中挥发性成分顶空固相微萃取的最佳条件为酶解液中氯化钠的添加量为30g/100mL,采用聚二甲基硅氧烷/二乙烯基苯(PDMS/DVB)为涂层的萃取头在60℃条件下搅拌萃取40min。
从罗非鱼酶解液挥发性成分中共鉴定出69种物质,其中醛类19种、醇类13种、烃类12种、含氮类8种、酮类6种、含硫类2种、其他9种。与罗非鱼酶解液气味相关的化合物主要是相对分子质量为80~200的C6~C9羰基化合物、醇类、含氮类物质,所有这些挥发性成分的协同作用构成了罗非鱼酶解液特有的风味。
[1]董在杰, 梁政远, 徐跑, 等. 尼罗罗非鱼出肉率与可量性状的相关性[J]. 中国水产科学, 2010, 17(2): 212-217.
[2]丁利君, 危雪如. 罗非鱼蛋白酶解液的多肽与钙复合物的制备及其抑菌分析[J]. 食品科学, 2009, 30(20): 198-202.
[3]CNDIDO L M B, SGARBIERI V C. Enzymatic hydrolysis of Nile tilapia (Oreochromus niloticus) myofibrillar proteins: effects on nutritional and hydrophilic properties[J]. Journal of the Science of Food and Agriculture, 2003, 83(9): 937-944 .
[4]黄国宏, 沈要林, 钟华锋. 罗非鱼肉酶解液美拉德反应产物风味成分的分析[J]. 中国调味品, 2007(8): 68-70.
[5]陈胜军, 李来好, 黄靖芬, 等. 气相色谱-质谱分析熏制罗非鱼片的风味成分[J]. 食品科学, 2009, 30(20): 379-382.
[6]胡世伟, 李瑞伟, 宋文东, 等. 四种罗非鱼挥发性成份的GC-MS分析[J]. 河北渔业, 2009(1): 20-24.
[7]曾少葵, 杨萍, 邓楚津, 等. 罗非鱼皮明胶的脱腥方法及理化性质[J].水产学报, 2010, 34(3): 349-356.
[8]夏延斌. 食品风味化学[M]. 北京: 化学工业出版社, 2008: 22-29.
[9]KATAOKA H, LORDH L, PAWLISZYN J. Applications of solid-phase microextraction in food analysis[J]. Journal of Chromatography A, 2000, 880(1): 35-62.
[10]胡国栋. 固相微萃取技术的进展及其在食品分析中应用的现状[J]. 色谱, 2009, 27(1): 1-8.
[11]GUILLEN M D, ERRECALDE M C, SALMERON J, et al. Headspace volatile components of smoked swordfish (Xiphias gladius) and cod (Gadus morhua) detected by means of solid phase microextraction and gas chromatography-mass spectrometry[J]. Food Chemistry, 2006, 94 (1): 151-156.
[12]GUILLAUME D, VINCENT M C, MARIE C, et al. Determination of volatile compounds to characterize fish spoilage using headspace/mass spectrometry and solid-phase microextraction/gas chromatography/mass spectrometry[J]. Journal of the Science of Food and Agriculture, 2006, 86(4): 600-611.
[13]须山三千三, 鸿巢章二. 水产食品学[M]. 上海: 上海科学技术出版社, 1992: 118-124.
[14]IGLESIAS J, MEDINA I. Solid-phase microextraction method for the determination of volatile compounds associated to oxidation of fish muscle[J]. Journal of Chromatography A, 2008, 1192(1): 9-16.
[15]IGLESIAS J, MEDINA I, BIANCHI F, et al. Study of the volatile compounds useful for the characterisation of fresh and frozen-thawed cultured gilthead sea bream fish by solid-phase microextraction gas chromatography-mass spectrometry[J]. Food Chemistry, 2009, 115(4): 1473-1478.
[16]JOSEPHSON D B, LINDSAY R C, STUIBER D A. Enzymic Hydroperoxide Initiated Effects in Fresh Fish[J]. Journal of Food Science, 2006, 52(3): 596-600.
[17]HERLAND H, ESAIASSEN M, COOPER M, et al. Changes in trimethylamine oxide and trimethylamine in muscle of wild and farmed cod (Gadus morhua) during iced storage[J]. Aquaculture Research, 2009, 41 (1): 95-102.
[18]GUILLEN M D, ERRECALDE M C. Volatile components of raw and smoked black bream (Brama raii) and rainbow trout (Oncorhynchus mykiss) studied by means of solid phase microextraction and gas chromatography/mass spectrometry[J]. Journal of the Science of Food and Agriculture, 2002, 82(9): 945-952.
Analysis of Volatile Components in Tilapia (Oreochromus niloticus) Enzymatic Hydrolysates
ZENG Shao-dong,WU Jian-zhong,OU Shi-yi*,JIN Jun
(Department of Food Science and Engineering, College of Science and Engineering, Jinan University, Guangzhou 510632, China)
Headspace-solid phase microextraction (HS-SPME) coupled with gas chromatography-mass spectrometry (GCMS) was used to analyze the volatile compounds in alcalase hydrolyzed tilapia meat. The optimization of HS-SPME conditions was conducted. The optimal HS-SPME extraction conditions were addition of sodium chloride to samples at a levels of 30 g/100 mL and subsequent extraction using a polydimethylsiloxane/divinylbenzene (PDMS/DVB) coated fiber at 60 ℃ for 40 min with stirring. Totally 69 volatile compounds were identified and the predominant flavor compounds were C6 to C9 volatile carbonyl compounds, alcohols or nitrogen-containing substances, whose molecular weights distribution were in the range of 80 to 200. All of these compounds showed synergistic effect on the formation of special flavor in tilapia enzymatic hydrolysates.
tilapia;enzymatic hydrolysates;volatile components;headspace-solid phase microextration;gas chromatography coupled with mass spectrometry
TS254.4
A
1002-6630(2010)18-0342-05
2010-06-19
广东省教育部产学研专项(2009B090200012);粤港关键领域重点突破项目(2009Z026);中央高校基本科研业务费专项资金(21609501)
曾绍东(1983—),男,硕士研究生,研究方向为功能性食品。E-mail:zsdsdaufood@163.com
*通信作者:欧仕益(1963—),男,教授,博士,研究方向为食品化学及功能性食品。E-mail:tosy@jnu.edu.cn
