蚕类抗菌肽异源表达与应用研究进展*
2010-03-22马振刚蓝希钳周泽扬
马振刚 蓝希钳 周泽扬,2*
(1.西南大学农业部蚕桑学重点实验室,重庆400716;2.重庆师范大学生命科学学院,重庆400047)
在现代医学发展中,抗生素以其极佳的抗菌作用在细菌性疾病治疗过程中占据了主要地位,它为人们治疗微生物感染疾病提供了新的方向,为人类健康事业做出了巨大的贡献[1]。但是随着抗生素的大量应用,细菌耐药性的产生和新生抗生素的筛选瓶颈使得抗生素的应用受到一定的制约。近年来的研究发现,抗菌肽(Antimicrobal peptides,AMPs)以其独特的作用机理和分子特性成为抗生素最为理想的替代药物。
抗菌肽是由生物体产生的一类具有抗菌活性的短肽免疫效应因子,在生物机体的先天免疫中起着重要的作用。自从1980年瑞典科学家Boman等人从惜古比天蚕(Hyalophora cecropia)蛹中诱导分离得到杀菌肽天蚕素(Cecropin)以来[2],在昆虫中已经陆续发现了200多种抗菌肽[3]。抗菌肽分子量小,一般含6~60个氨基酸残基。蚕类抗菌肽是指那些存在于蚕体及蚕蛹的血淋巴等免疫系统中,具有高效杀菌活性的肽类物质,具有抗菌谱广、分子量小、热稳定性强、水溶性好、作用机制独特等特点。它成为昆虫高效的先天免疫系统的重要组成部分,增强了蚕自身对病原微生物的抵抗力,减少了蚕类病原疾病的发生[4]。经过最近二十几年的研究显示,抗菌肽不仅对细菌、真菌[5]有广谱的抗菌活性,对病毒、原虫[6]也有作用。
1 蚕类抗菌肽的家族分类
家蚕是重要的经济昆虫,2006年中国蚕丝业生产价值达到1.77千万美元[7]。由于家蚕容易饲养,可利用的突变体多等特点使之成为继果蝇之后的昆虫遗传学研究的模式生物。2003年家蚕基因组序列测序已经完成[8];2007年,高精度的家蚕基因组数据得以诞生,夏庆友等人预测其基因数目大约为14,623个。2006年Tingcai Cheng等人[9]利用家蚕基因数据库本地Blast鉴定了35个与其它昆虫抗菌肽相似的氨基酸序列:包括Cecropins、Enbocins、Attacins、Moricins、Gloverins、和Lebocins等家族成员。2008年Wen等[10]进行了家蚕De-fensin-like1(BmdefA)基因的序列结构和表达方式的研究,鉴定出一个Defensin-like(BmdefA)基因。同年Yoichi Kaneko等人[11]从家蚕脂肪体中克隆得到了脂肪体组织特异性表达的Defensin-like2(BmdefB)基因。至此家蚕抗菌肽Defensin家族成员也被成功鉴定。
1.1 Moricins家族
家蚕抗菌肽Moricin是由Seiich Hara等人[12]于1995年首先发现的,是他们在研究家蚕血淋巴抗金黄色葡萄球菌的抗菌活性时分离得到的一种新型抗菌肽。此类抗菌肽可分为两类,分别命名为Moricin1和Moricin2,它们的区别在于信号肽的第6位氨基酸残基,Moricin1是Phe,Moricin2是Lys,相似度高达97.2%,成熟肽是完全相同的。用大肠杆菌注射家蚕幼虫,在脂肪体、马氏管组织中能观察到Moricin基因表达,而在丝腺、中肠没有检测到表达[11]。2006年,Tingcai Cheng等人[9]通过对家蚕数据库分析,发现家蚕抗菌肽Moricins家族有12个成员,并将其分为家族A和B。家蚕Moricins前体包含65或66个氨基酸残基,前22或23个氨基酸残基是预测的信号肽,成熟肽有42个氨基酸残基,具有强碱性,带正电荷,等电点比天蚕素高,分子的N端每隔3~4个氨基酸残基就有一个带正电荷的氨基酸残基(图1a),C端富含碱性氨基酸残基[13]。抗菌肽Moricins对革兰氏阳性菌和革兰氏阴性菌都有较强的抗菌活性,用细菌脂多糖(LPS)能诱导家蚕Moricins的产生,说明Moricins的靶标是细菌的膜部分[14],进一步研究表明Moricins是通过增加膜的通透性而达到杀菌的作用。目前在其他昆虫中也发现了与家蚕Moricins相似性很高的类似抗菌肽[15],抗菌肽Moricins在不同种昆虫中高度保守,推测其在进化中具有重要地位。

图1 家蚕抗菌肽氨基酸序列
1.2 Cecropins家族
1980年,Boman等从Hyalophora cecropia中首次分离出Cecropin。天蚕素广泛存在于昆虫中,目前人们已经在鳞翅目的蛾类、蝴蝶及双翅目的蝇类中纯化出Cecropin。Cecropins由约40个氨基酸残基组成,分子量约为4kDa,并且具有热稳定性。目前为止,家蚕Cecropin A、B、D、E都已经有了研究报道[16-19],它们包含有2个α-螺旋结构,N-端富含亲水氨基酸残基,C-端富含疏水氨基酸残基,主要是抗革兰氏阴性菌,在细菌膜上形成离子通道引起菌体内容物外流,最终导致细菌死亡[20]。
1.3 Lebocins家族
Lebocins家族富含脯氨酸,由32个氨基酸残基组成[21],第15(15-Thr)位是一个糖基化位点(图1d),有利于提高抗菌肽活性。Lebocins的结构和抗菌特征与蜜蜂的抗菌肽Abaecin相同。目前有3个Lebocins(Lebocin 1、2、3)得到分离,Lebocin 1和2氨基酸序列高度相似,Lebocin 4已被克隆,它与其它3个Lebocin高度相似。Lebocins在生理条件下抗菌活性很低,但是当有Cecropin D或糖存在时能大大的增加其抗菌活性。在家蚕中,Cheng等[9]只鉴定到1个Lebocin,推测其它成员可能定位在家蚕基因组序列的gaps上。
1.4 Gloverins家族
Gloverins家族富含甘氨酸,且甘氨酸位置高度保守,不含有半胱氨酸,热稳定性好,能与脂多糖(LPS)相互作用,并特异的抑制菌体细胞壁形成,引起膜通透性增加,最终导致菌体缓慢生长甚至死亡。2006年7个Gloverin基因被Cheng等[9]在家蚕基因组数据库中得以分析鉴定。
1.5 Attacins家族
抗菌肽Attacins富含甘氨酸,分子量约为20kDa,无半胱氨酸。昆虫Attacin按其等电点的不同可以划分为两大类:碱性攻击素和酸性攻击素。经过大量研究表明,Attacin与天蚕素(Cecropin)、防御素(Defensin)以及溶菌酶(Lysozyme)共同构成了昆虫非特异性先天免疫系统的主体[20]。2006年Cheng等[9]鉴定了2个家蚕Attacins基因,它们位于同一个scaffold上,与果蝇的Attacin基因相似。Attacin主要是对革兰氏阴性菌起作用,抑制菌体外膜蛋白的合成达到杀菌的目的。
1.6 Defensin家族
Defensin家族抗菌肽分子量约4kDa左右,由约34-43个氨基酸残基组成,富含半胱氨酸,主要对革兰氏阳性菌起作用。2008年Wen等[10]通过家蚕基因组数据库和表达序列标签分析,获得了一个Defensin-like(BmdefA)基因,该基因的开放阅读框编码了一个含有22个氨基酸残基的信号肽,一个34个氨基酸残基的前导肽和一个36个氨基酸残基的成熟肽,其成熟肽分子量约为4.0kDa;成熟肽包含了昆虫Defensin共有的6个半胱氨酸基序,其理论等电点为4.12,因此我们推测这是一个新型阴离子抗菌肽。2008年Yoichi Kaneko[11]等人从家蚕脂肪体cDNA文库中克隆获得了Defensin-like2(BmdefB)基因,该基因编码的抗菌肽能在蚕体受到大肠杆菌、枯草芽孢杆菌以及真菌的诱导下大量的表达。虽然BmdefB同样具有由6个保守的半胱氨酸残基构成的基序,但是它与BmdefA的氨基酸序列相似性只有27%(图1c),且它是一种阳离子抗菌肽,推测它们可能来自不同的祖先[22]。
1.7 Enbocins家族
1998年Sang等[30]利用探针杂交法获得了Enbocin基因,氨基酸序列与Cecropin家族类似,但是却表现出不同的抑菌活性,Cecropins对抗革兰氏阴性菌有较强的抑菌活性,而Enbocin对革兰氏阳性菌有较强的抑制作用。2006年Cheng等[9]鉴定了2个家蚕Enbocin基因,其成熟肽氨基酸序列相似性极高(图1b),基因染色体定位表明它们成簇的排列在同一条染色体上[22]。
2 蚕类抗菌肽的异源表达系统
2.1 大肠杆菌表达系统
为获得较纯的抗菌肽样品,同时为抗菌肽批量生产,对抗菌肽异源表达的研究十分迫切且具有应用意义。由于抗菌肽分子中存在碱性氨基酸残基,因此蛋白酶对其影响显著。同时,表达的抗菌肽对表达宿主菌具有抑制和杀伤作用,使得抗菌肽的异源表达量不高。目前,解决这一难题的方法有基因的串联表达策略以及基因的融合表达策略,而研究者们主要采用抗菌肽的融合表达策略来解决抗菌肽在异源表达系统中遇到的问题,该方法是将抗菌肽基因与一个编码较大蛋白质分子的基因融合在一起共表达,较大的蛋白质分子能够与抗菌肽本身的碱性氨基酸中和,并且暂时影响抗菌肽分子构象,导致抗菌肽的杀菌活性下降,从而降低对宿主菌的杀伤作用;同时也增强了抗菌肽分子稳定性,防止其被酶解。待获得纯净的融合表达蛋白后,采用酶切或者化学剪切作用切除大分子标签,使抗菌肽分子恢复应有构象,并重新获得较强的抑菌活性[23]。由于原核表达操作简便(如图2A),亦能获得活性肽,许多研究者都采用此系统研究抗菌肽的异源表达。目前成功的融合表达系统主要有GST系统、β-半乳糖苷酶系统、麦芽糖结合蛋白(MBP)系统等;纯化标签融合表达也有一定的应用,如His-tag、FLAG-tag和HA-tag等[24]。
1998年Seiichi Hara等[25]将Moricin基因克隆至原核表达载体pXa1 and pMAL-c2中,在大肠杆菌中成功表达具有抑菌活性的目的蛋白。2008年赵岩龙等[26]将家蚕抗菌肽Moricin基因与表达载体pET-32M连接,在大肠杆菌中融合表达,成功纯化出目的蛋白,并证明其对大肠杆菌具有抗菌活性;2008年韩晋辉等[27]根据天蚕素特征,设计了4条抗菌肽,将设计抗菌肽的基因克隆到载体pUC19上,在大肠杆菌JM109中融合表达目的多肽,抑菌圈法测定其抗菌活性,结果表明其中抗菌肽AMP-Cec具有较强的抑菌活性。
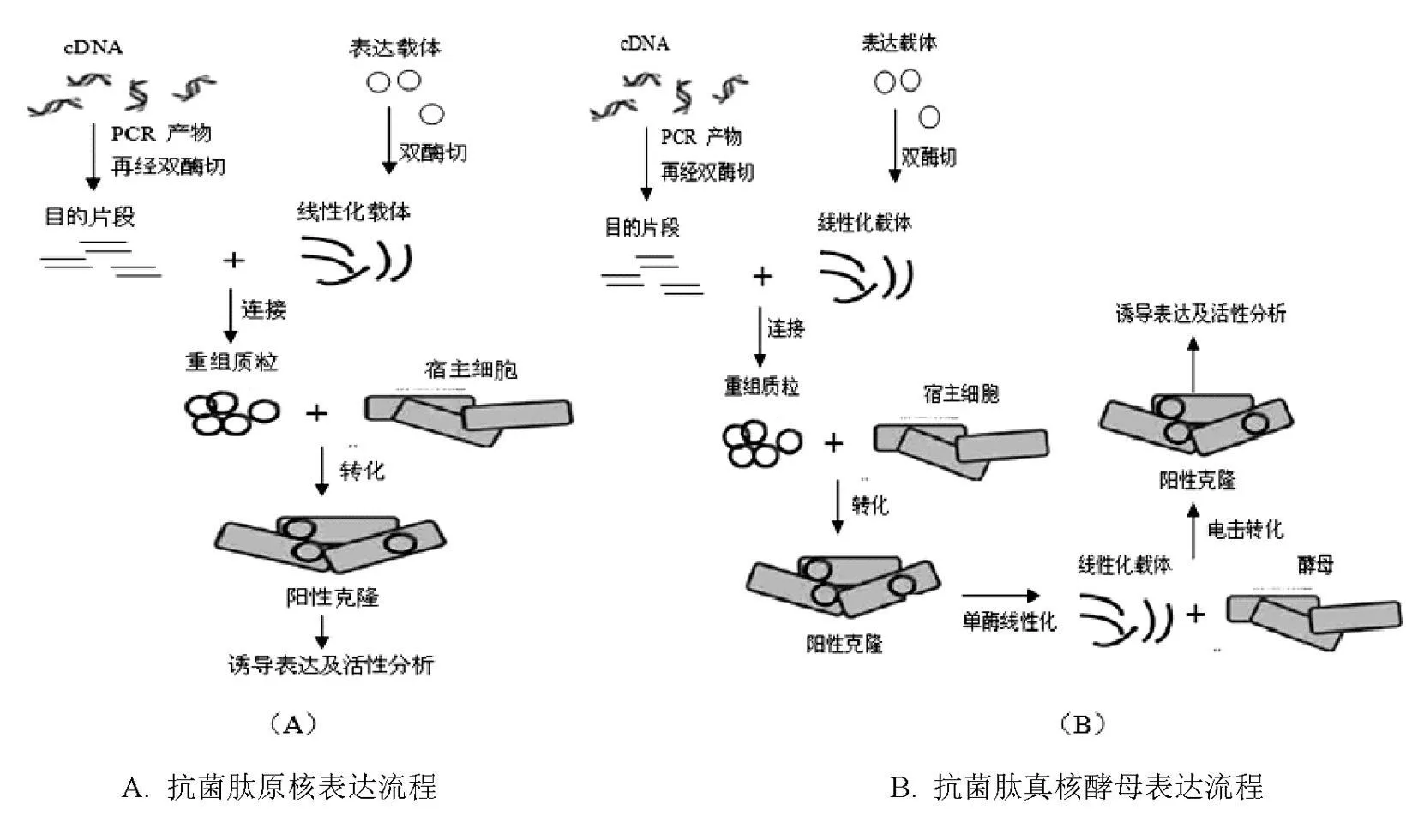
图2 蚕类抗菌肽异源表达流程
2.2 真核酵母表达系统
目前发现的抗菌肽种类繁多,来源广泛,其中真核生物抗菌肽占很大比重。由于原核异源表达系统缺乏对表达蛋白的加工与修饰,因此真核生物抗菌肽在其中表达往往活性较低或无活性。酵母表达体系是目前抗菌肽基因和生物工程中重要且应用最为广泛的表达体系之一,该表达系统具有以下优点:1能够直接表达小分子肽;2具有外源蛋白的加工与修饰系统;3基因操作相对简单(如图2B);4产物的表达量高、易大量发酵培养和易纯化。因此在昆虫抗菌肽表达研究方面有着重要的应用。在现今的真核酵母表达系统中,常用的表达载体有pPICZα A、pGAPZα A和pPIC9K,由于其具有分泌蛋白的引导肽且能加工切除重组蛋白的信号肽,因此表达的目的蛋白能够分泌到细胞外,从而避免酵母內源蛋白酶对其降解,同时还便于后续纯化目的蛋白,这些优点使得酵母表达系统得到广泛的应用。
2008年王秀青,张素芳等[28]亚克隆Cecropin B并将3个亚克隆串联在一起,将串联体克隆至表达载体pPICZα A上,电击法转化毕赤酵母SMD1168,甲醇诱导重组蛋白表达,抑菌实验结果表明重组蛋白具有明显的抑菌活性。2009年王秀青,朱明星等[29]设计引物对前期构建成功的载体天蚕素类杂合肽CecropinA-magainin进行定点突变,使其生成杂合肽的衍生物,测序正确后转化毕赤酵母受体细胞SMD1168,甲醇诱导表达重组蛋白,活性试验表明其对金黄色葡萄球菌具有较好的抑菌活性。
2.3 昆虫细胞表达系统
在抗菌肽的异源表达的研究过程中,针对抗菌肽结构与氨基酸残基组成的特点,选择不同的异源表达体系,除了众多研究者采用的原核表达体系和真核酵母表达体系外,Sang等[30]于1998年用昆虫细胞表达了具有抑菌活性的家蚕抗菌肽Enbocin,其将家蚕Enbocin基因克隆至表达载体pBacPAK9中,构建重组杆状病毒并转染Sf21细胞,培养4天后收集细胞培养基上清,通过抑菌圈试验证实其能抑制革兰氏阳性菌和革兰氏阴性菌的生长。截止到目前,由于细胞水平表达抗菌肽成本高且对试验设备要求严格,昆虫细胞表达系统并没有得到广泛的应用。
3 蚕类抗菌肽异源表达研究现状
过去几年对蚕类抗菌肽的研究,以抗菌肽基因分析、肽结构解析和天然抗菌肽的获取[31-33]为主要方向。由于天然抗菌肽表达量低、提取过程复杂等原因,使得对抗菌肽结构解析与作用机理的研究受到阻碍[34]。近年来,异源表达重组抗菌肽的研究逐渐增多,而各家族成员基因表达现状具体见表1。从总体上来看,对蚕类抗菌肽异源表达的研究进展处于刚刚起步阶段,其相关报道远少于家蝇等其他物种,如Attacin、Defensin与Lebocin等家族的异源表达研究仍无文献报道。由于蚕类抗菌肽基因属于真核生物基因,原始表达的抗菌肽可能经过真核系统的修饰与加工,但现今大多数研究采用原核异源表达体系,如Moricin[25]与Gloverin[35]家族,着重研究其原核表达体系,真正获得的重组抗菌肽活性均低于天然抗菌肽活性,且降低了获得生物活性肽的几率;加之原核融合表达产量低,不符合工业开发的要求。在真核表达过程中,酵母表达体系以其自身优势更适合工业开发与生产,家蝇抗菌肽真核异源表达系统研究已经深入所有家族,但现今蚕类抗菌肽中只有Cecropin家族有相关报道[28-29],因此,蚕类抗菌肽真核异源表达系统的构建与应用更值得关注。
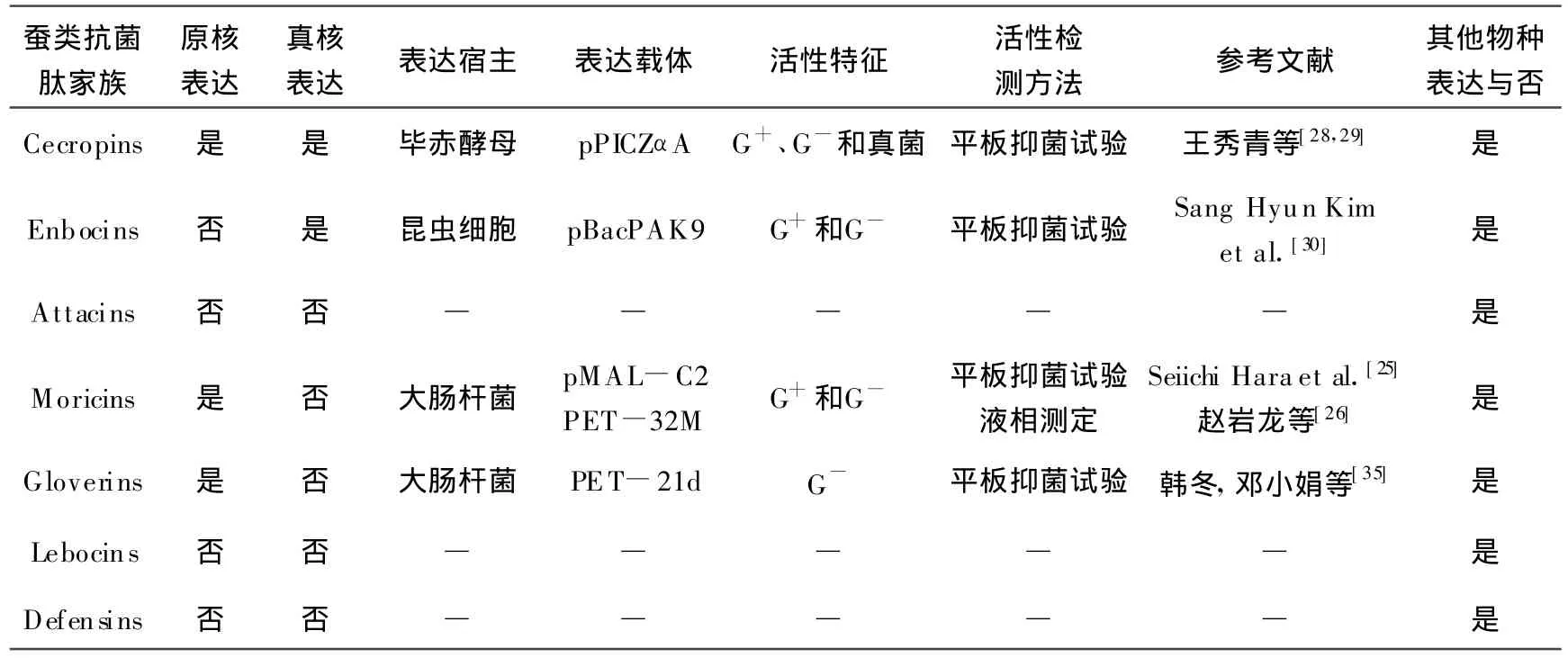
表1 蚕类抗菌肽异源表达情况
4 应用与展望
蚕类抗菌肽是蚕体对外界病原物侵染而产生的先天免疫产物,其自身具备的特点使它在医药、植物抗病、食品工业、畜牧业等方面得到应用。
4.1 在医药方面的应用
虽然抗生素的出现为人类的健康做出了许多贡献,但是随着抗生物的大量使用导致了许多耐药病原菌的产生;并且抗生素的使用对生物机体有害,因为它能刺激内毒素的释放,有时还会造成脓毒休克。抗菌肽在使用时就无此现象发生,且它能抑制细菌产物诱导产生对人体有害的细胞因子;抗菌肽具有独特的抗菌机理,它通过对细胞膜的物理化学损伤使细胞破裂,或者抑制细胞壁的呼吸而达到抑制细菌繁殖的效果。赵东红等[36]在扫描电镜下观察到家蚕抗菌肽CM4对离体U937、Hela癌细胞骨架及核骨架有明显损伤作用。柞蚕抗菌肽能抑制乙型肝炎病毒DNA复制,又能选择性杀伤肿瘤细胞,对动物安全、无毒副作用,在医药上已制成“肾肝宁”胶囊治疗肾炎及肝炎[37]。
4.2 在植物抗病方面的应用
1998年,张祥喜等人研究发现家蚕抗菌肽能够抑制花生青枯病,且花生青枯病病菌的生长速率与家蚕抗菌肽浓度对数值间呈负相关[38]。2008年李波等[39]讨论了抗菌肽Cecropin及其在转基因植物抗菌中的应用,阐述了转基因植物表达Cecropin抗菌肽具有应用优势和实用价值。借鉴已成功的昆虫抗菌肽转基因工程,如转基因棉花、转基因水稻等,把特异的抗菌肽基因转入农作物,产生抗病新品种,使其自身抵制病虫害的能力增强,从而能够减少化学农药的投用,减少了对自然环境的危害,也为人们提供了健康的绿色食品。
4.3 在食品工业方面的应用
目前我国使用的食品防腐剂多以苯甲酸、山梨酸及其盐类、对羟基苯甲酸脂类等化学合成剂为主,这些防腐剂在食品加工中的添加量都较大,容易超标而危害人体健康;蚕类抗菌肽具有抗菌谱广、热稳定性好和水溶性好等特点,将它作为食物加工及保存的添加剂具有广阔的应用前景[40]。抗菌肽在食品发酵方面也有重要的应用,它能用于防止食品发酵过程中的杂菌污染,除了直接添加这类肽以外,还可以把抗性基因转入发酵菌株,让发酵菌株表达这类抗菌肽以防止杂菌污染。
4.4 在畜牧业方面的应用
抗菌肽在畜牧业方面的应用主要体现在抗菌肽作为饲料添加剂。目前,抗生素应用导致大量抗性菌产生,使得抗生素在此领域的应用受到质疑。而蚕类抗菌肽作为一种广谱、高效、绿色的新型抗生素,其应用已初现雏形。2010年陈冰等[41]在对虾饲料中添加家蝇幼虫抗菌肽提取物,添食实验说明饲料中添加适量的家蝇抗菌肽对凡纳滨对虾有一定的促生长作用,并能提高对虾的免疫相关指标。
目前,蚕类抗菌肽还处在试验和应用推广阶段,成熟可靠的研究成果将有助于蚕类抗菌肽的实用化。作为新世纪抗生素取代药物之一,绿色、高效、稳定的特点将使抗菌肽类产品具有巨大的应用潜力。而家蚕丝绸产业作为中国重要进出口产业之一,蚕类抗菌肽的应用也将受到其积极的影响,在新世纪丝绸之路愈加辉煌的过程中,蚕类抗菌肽药物也必将倍受重视,在农业、畜牧业、医药行业、食品业等领域作出巨大的贡献。
[1]Hancock REW,Knowles D.Are we approaching the end of the antibiotic era[J].Current Opinion in Microbiology,1998,1:493-494.
[2]H.Steiner,H.G.Boman.Sequence and specificity of two antibacterial proteins involved in insect immunity[J],Nature,1981:246-248.
[3]Lamberty M,Zachary D,Lanot R.Insect immunity.Constitutive expression of a cysteine-rich antifungal and a linear antibacterial peptide in a termite insect[J].Biol Chem,2001,276(6):4085-4092.
[4]范涛,王储炎,吴传华,等.蚕类抗菌肽的研究现状[J].安徽农业科学,2009,37(1):194-195.
[5]Vogle HJ,Schibli JD,Jing W.Towards a structure-function analysis of bovine lactoferricin and related tryptophan and arginine containing peptides[J].Biochem Cell Biol,2002,80:49-63.
[6]Park IY,Park CB,Kim MS,Parasin I.An antimicrobial peptide derived from histone H2A in the catfish[J].Parasilurus asotus.FEBS Lett,1998,437:258-262.
[7]Tang L,Liao M.Analysis and expectation of silk industry in 2006[J].Silk Monthly(chinese),2007,3:1-5.
[8]Q.Xia,et al.,A draft sequence for the genome of the domesticated silkworm(Bombyx mori)[J].Science,2004,306:1937-1940.
[9]Cheng T,Zhao P,Liu C,et a1.Structures,regulatory regions,and inductive expression patterns of antimicrobial peptide genes in the silkworm,Bombyx mori[J].Genomics,2006,87(3):356-365.
[10]Hongxiu Wen,Xiqian Lan,et al.Sequence structure and expression pattern of a novel anionic defensin-like gene from silkworm(Bombyx mori)[J].Mol Bio Rep,2008,36:711-716
[11]Yoichi Kaneko;Hiromitsu Tanaka,Jun Ishibashi.Gene Expression of a Novel Defensin Antimicrobial Peptide in the Silkworm,Bombyx mori[J].Bioscience,Biotechnology,and Biochemistry,2008.72:2353-2361.
[12]Hara S,Yamakawa M.Moricin,A novel type of antibacterial peptide isolated from the silkworm,Bombyx mori[J].J BiolChem,1995,270(50):29923-29927
[13]Furukawa,S,Tanaka,H,Inducible gene expression of moricin,a unique antibacterial peptide from the silkworm(Bombyx mori)[J].BiolChem,1999,340(1):265-271.
[14]周永富,吴晓萍,饶军华.家蚕(Bombyx mori)中的一种新型抗菌肽-Moricin[J].生物学杂志,1997,14(80):4-6.
[15]Oizumi,Y,Hemmi,H,Isolation,gene expression and solution structure of a novel moricin analogue,antibacterial peptide from a lepidopteran insect,Spodoptera litura[J].BiolChem,2005,1752:83-92.
[16]Teshima T,Structure determination of lepidopteran C,self-defense factor produced by silkworm[J].Tetrahedron,1986,42:829-834.
[17]M orishima I,Isolation and structure of cecropins,inducible antibacterial peptides,from the silkworm Bombyx mori[J].Comp BiochemPhysiol B,1990,95B:551-554.
[18]Hara S,Isolation and a-amidation of the non-amidated form of cecropin D from larvae of Bombyx mori[J].Comp Biochem Physiol,1994,108B:303-308.
[19]Sun-Mee Hong,Structure and Expression Analysis of the Cecropin-E Gene from the Silkworm,Bombyx mori[J].Biosci.Biotechnol.biochem,2008,72(8):1992-1998.
[20]林立鹏,蓝希钳.家蚕抗菌肽[J].蚕学通讯,2007,27(3):11-17.
[21]Hara S,Yamakawa M.A novel antibacterial peptide family isolated from the silkworm Bombyx mori[J].Biochem,1995,310:651-656.
[22]孙伟,沈以红,向仲怀,等.家蚕抗菌肽基因研究进展[J].蚕业科学,2009,35(1):196-203.
[23]魏泉德,余新炳.抗菌肽的原核表达及应用前景[J].国际医学寄生虫病杂志,2006(33):206-210.
[24]张丽芳.抗菌肽原核表达策略[J].黑龙江科技信息,2010,6:5-5
[25]Seiichi Hara,Minoru Yamakawa.Production in Escherichia coli of Moricin,a Novel Type Antibacterial Peptide from the Silkworm,Bombyx mori[J].1996,220:664-669.
[26]赵岩龙,沈兴家,郭锡杰.家蚕抗菌肽morincin在大肠杆菌中的融合表达及抗菌活性测定[J].蚕业科学,2008,34(2):232-236.
[27]韩晋辉,翟培,施用晖,等.设计天蚕素抗菌肽在E.coli中的表达及活性鉴定.食品与生物技术学报,2008,27(6):86-89
[28]王秀青,张素芳,曹瑞兵,等.抗菌肽天蚕素B基因及其串联体在毕赤酵母中的表达[J].南京农业大学学报,2007,30(3):120-123.
[29]王秀青,朱明星,张爱君,等.天蚕素类杂合肽cecropinA-magainin突变体的合成以及在毕赤酵母中的分泌表达[J].2009,40(11):95-98.
[30]Sang Hyun Kim,Beom Seok Park et a1.Cloning and Expression of a Novel Gene Encoding a New Antibacterial Peptide from Silkworm,Bombyx mori[J].Biochemical and Biophysical research communications,1998,246(2):388-392.
[31]Guangshun Wang,Xia Li.APD2:the updated antimicrobial peptide database and its application in peptide design[J].Nucleic Acids Research,2008,1:1-5.
[32]Seiichi HARA.Minoru YAM AKAWA.A novel antibacterial peptide family isolated from the silkworm,Bombyx mori.Biochem.J.1995,310:651-656.
[33]Jobin Varkey,Shashi Singh.Antibacterial activity of linear peptides spanning the carboxy-terminal βsheet domain of arthropod defensins.2006,27:2614-2623.
[34]Aaron B.Ingham,Robert J.Moore.Recombinant production of antimicrobial peptides in heterologous microbial systems.2007,47:1-9.
[35]韩冬,邓小娟,杨婉莹,等.家蚕拟抗微生物肽Gloverins基因(Bmglv)的原核表达及抗菌活性鉴定[J].昆虫学报,2008,51(6):561-568.
[36]赵东红,张双全,戴祝英,等.重组家蚕抗菌肽CM 4对癌细胞骨架及核骨架破坏作用的观察[J].高技术通讯,2000,1:23-27.
[37]黄自然,廖富蘋,郑青,等.昆虫抗菌肽在医药上的应用[J],天然产物研究与开发,2000,13(2):79-83.
[38]张祥喜,罗绍春,董秋洪,等.家蚕抗菌肽对花生青枯病菌的抑制作用初报[J],中国油料作物学报,1998,20(2):84-86.
[39]李波,张耀洲.抗菌肽Cecropin及其在转基因植物抗菌中的应用[J].中国生物工程杂志,2008,28(5):122-127.
[40]姜明,尚德静,李德梅.柞蚕抗菌肽的防腐机理研究.[J].食品科学,1993,11:11-13.
[41]陈冰,曹俊明,陈平洁,等.家蝇抗菌肽对凡纳滨对虾生长性能及免疫相关指标的影响[J],中国水产科学,2010,17(2):258-265.
